糖组检测在肝脏疾病诊疗中的应用现状与未来展望
2022-01-10王蕾李维泉陈力陈萃英
王蕾,李维泉,陈力,陈萃英*
(1. 先思达生物科技有限公司,江苏 南京 211800;2. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032)
糖基化修饰是蛋白质翻译后修饰的重要形式,约70%的蛋白需要经过糖基化修饰后,转移到细胞膜或分泌到细胞外行使功能。在真核生物中,蛋白上的糖链共价连接到天冬酰胺、苏氨酸或丝氨酸残基上,参与蛋白的翻译后折叠和质控[1]。此外,糖链还可以连接到脂质分子上,甚至RNA上[2]。在多细胞生物中,糖链广泛参与受精、发育、生长、分化以及免疫等生命过程中[3]。
糖组泛指在特殊的时间、空间和环境下细胞和组织产生的所有糖链的集合[4]。对比基因组、转录组和蛋白组的蓬勃发展,糖组研究受限于分析技术。近20年来,由于分析技术的突飞猛进,糖组的研究也开始进入爆发期[5]。包括质谱(MS)、毛细管电泳(CE)、高效液相色谱(HPLC)和凝聚素芯片等在内的新技术,推动了肝脏糖链新标志物在疾病领域的临床应用。
肝病诊断中仍然存在着许多挑战。以肝癌为例,α-甲胎血清蛋白(AFP)仍然是临床肝癌检测最常用的血液标志物,其特点在于特异度高(80% ~94%),而灵敏度有限(25% ~ 65%)。进一步研究表明,AFP的糖基化物即AFP异质体(AFP-L3)在肝细胞癌(HCC)患者血清中的改变更具特异性,也成为肝癌早期诊断的血清标志物[6]。近年来,异常凝血酶原(PIVKA-II)也逐渐在肝癌的诊断中发挥作用,并与AFP在临床使用中互补,但是其临床效能需要进一步验证[7-8]。指南上推荐的基于液体活检方案的微小RNA(miRNA)、长链非编码RNA(lncRNA)、循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)技术作为潜在的肝癌标志物[9-10],其临床使用受限于样本量、检测周期和成本等因素。
本篇综述旨在总结肝脏疾病发生发展过程中,糖组作为标志物在肝脏疾病的早期诊断、治疗效果监测和预后评估中的潜力和最新进展。
1 人血清中糖组的稳定性
生理条件下,糖蛋白主要来源于肝脏与免疫细胞[11]。对血液中主要糖蛋白的定量和糖型分析显示,血液中蛋白总量为70 ~ 75 g · L-1,其中非糖基化的白蛋白约为40 g · L-1。糖基化的蛋白中,免疫球蛋白(Ig)家族中Ig G在血清中平均能达到约12 g · L-1,Ig A和Ig M在血清中浓度约为4 g · L-1,Ig E和Ig D在血清中含量较低。除Ig之外,包括纤维蛋白原、结合珠蛋白、酸性糖蛋白和载脂蛋白等在内的肝脏分泌蛋白约能占到14 g · L-1[11]。
糖链的合成、降解和转运,涉及到至少250种不同的糖基转移酶参与其中,在基因和转录水平上都受到了严格的调控[12]。糖链合成相关基因或调控元件的突变,会导致一系列的先天性糖基化障碍综合征,从而发生胚胎致死,或因婴幼儿时期多系统的发育迟缓和多脏器功能衰竭导致的早夭。对患者血液及组织水平上的蛋白糖基化研究,均观察到了糖基化的显著变化[13]。
除了受遗传因素导致的蛋白糖基化改变外,异常糖基化还与包括衰老、肿瘤、感染和自体免疫性疾病在内的生理病理改变密切相关[14-15]。人群队列的研究表明,糖基化水平与年龄、性别和疾病等生理因素相关,但不受血糖水平、饮食习惯、社会经济地位等生理和非生理因素的影响[16]。个体水平上,血液中蛋白的糖基化水平稳定[17]。以上研究,为糖链/糖组作为疾病的标志物奠定了基础。
2 肝脏疾病相关糖型
糖型与肿瘤的发生密切相关,大量报道都观察到了在肝病尤其是乙型肝炎病毒相关的肝癌患者组织和血清样本中的特征糖型——岩藻糖、多分支、二平分N-乙酰葡糖胺、唾液酸等糖型的变化(见图1)[6]。
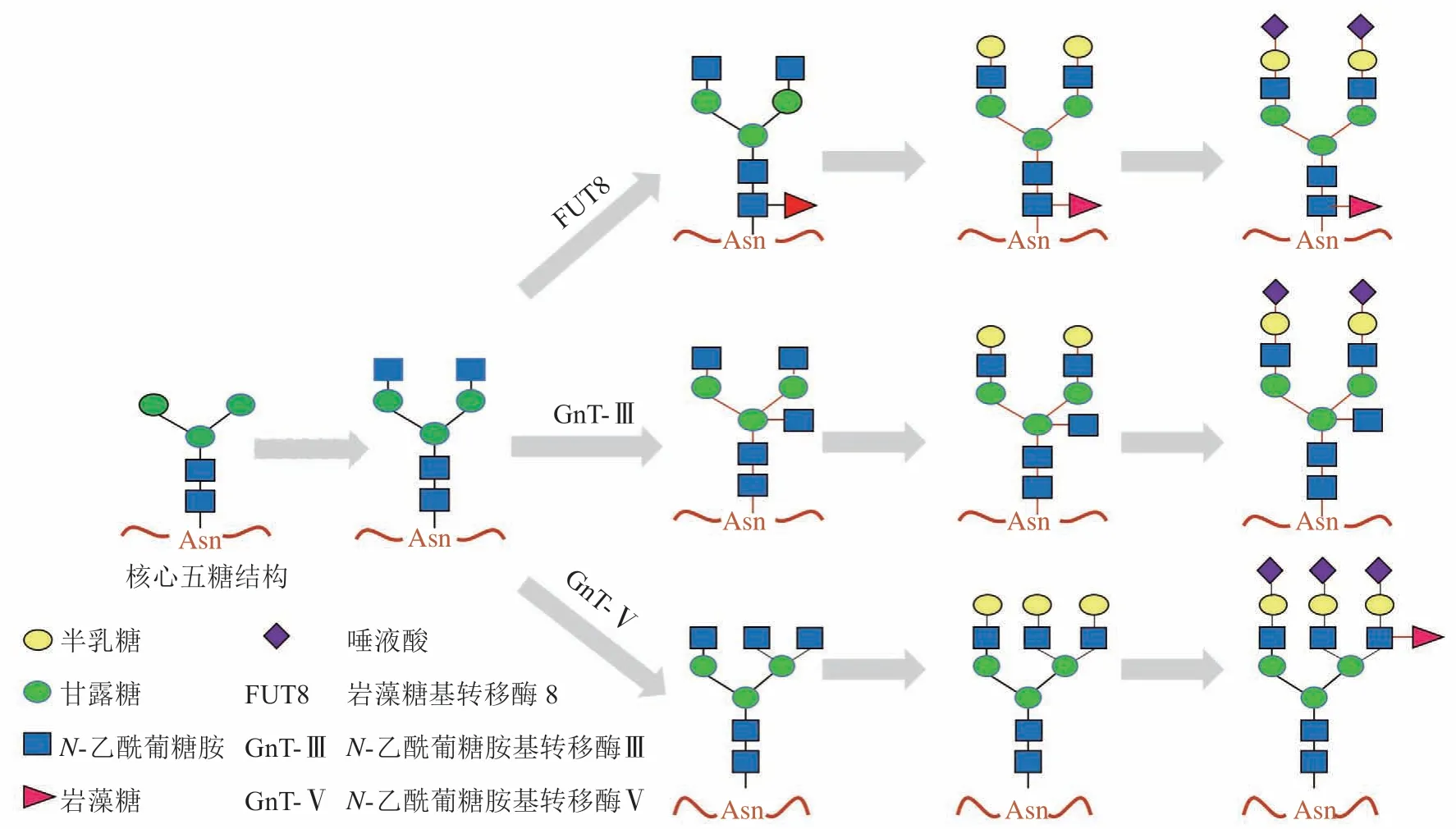
图 1 肝病相关糖型合成通路Figure 1 Synthetic pathway of live disease-related glycan
2.1 岩藻糖糖型
岩藻糖基化的改变是由岩藻糖基转移酶(FUT)缺乏或过度表达所致,在肝病尤其是肝癌中,可观察到核心岩藻糖基化和分支岩藻糖基化水平的升高。且基因组分析显示,负责核心岩藻糖基化的糖基转移酶FUT8的基因在HCC样本中过度表达,与肝癌的发生发展相关[18]。
研究发现,在非酒精性脂肪肝、肝硬化和肝癌患者的血清和肝组织中可观察到蛋白过度核心岩藻糖基化[19-22]。在非酒精性脂肪肝患者中,岩藻糖基化的结合珠蛋白显著升高,并与肝细胞的气球样变相关[19]。研究人员比较了健康对照组和肝硬化患者血浆中的Ig G蛋白和其他血清蛋白质,均发现双天线糖型、三天线糖型和四天线糖型的岩藻糖基化水平升高了约2倍[21]。岩藻糖基化N-聚糖,如核心α-1,6-岩藻糖基化三天线聚糖,在包括HCC在内的晚期肝病患者的血清中显著升高[22]。
岩藻糖基化的标志物AFP-L3(即AFP上修饰了核心岩藻糖基化的糖型)在临床实践中展示了对早期肝癌的诊断效能[23-24]。在肝癌的组织病理样本中,应用N-糖基化的质谱成像分析也观察到了岩藻糖糖型的显著升高,显示其在肝癌诊断中的潜在价值[25]。
2.2 多分支糖型
与未患肝癌患者的样本相比,研究人员在肝癌患者的组织以及血清样本中也发现了高分支糖链的异常改变。多分支糖型的增加主要由N-乙酰葡糖胺基转移酶Ⅴ(N-acetylglucosaminyltransferase Ⅴ,GnT-Ⅴ)的上调引起[26]。
在严重的肝硬化患者中,研究人员观察到α1-抗胰凝乳蛋白酶(AAT)的双天线寡糖减少[27]。并且,在肝硬化和肝癌患者中,AFP和AAT蛋白均出现了多分支的聚糖变化[28],以及四天线寡糖链水平的增加[29]。多分支糖型的改变同样也在肝癌患者的组织病理样本中被观察到[25]。
编者按:2018年是中国改革开放四十周年。四十年来,上海化工行业发展由封闭向开放,由简单初级向绿色高端,由传统要素投入向科技创新驱动加快转变的40年。四十年来,上海化工人众志成城、砥砺奋进、艰难探索,实现了上海石化产业的跨越式发展。四十年的历史值得记载,四十年的经验值得总结,四十年的春华秋实,让人感慨。本刊特开辟纪念专栏,向读者介绍上海石化产业改革发展的典型事例和成功经验,以飨读者。
2.3 二平分N-乙酰葡糖胺糖型
二平分N-乙酰葡糖胺通过N-乙酰葡糖胺基转移酶Ⅲ(N-acetylglucosaminyltransferaseⅢ,GnT-Ⅲ)转移到核心五糖β连接的甘露糖上。与健康人、肝炎和肝硬化患者相比,肝癌患者血清样本中的GnT-Ⅲ活性显著升高,并在有效治疗后出现下降[30]。
肝纤维化向肝硬化进展的过程中,MS和CE分析结果表明,除了岩藻糖基化的改变外,二平分N-乙酰葡糖胺糖型显著增加[31]。并且,随着肝硬化向肝癌转变的过程中,二平分N-乙酰葡糖胺糖型出现下降,但依然高于健康组和肝纤维化组[32]。在肝癌患者样本中,GnT-Ⅲ和GnT-Ⅴ都会升高,在竞争同一底物的过程中,GnT-Ⅲ的活性强于GnT-Ⅴ[33-35]。GnT-Ⅲ会一定程度上阻碍肿瘤的进展,而GnT-Ⅴ则会促进肿瘤进展[36-37]。
2.4 唾液酸糖型
唾液酸的高表达,伴随着肝癌的发生和进展。在肝病尤其是HCC患者的组织和血清中也观察到了α-2,3-和α-2,6-唾液酸转移酶的异常变化。与正常肝脏和肝硬化肝脏相比,肝癌组织中α-2,6-唾液酸显著过度表达[38]。与肝硬化患者相比,早期HCC患者血清中对氧磷酶1异质体的岩藻糖基化和唾液酸化水平显著升高,表现出其在区分早期肝细胞癌和肝硬化患者中的潜力[39]。
3 血清糖组作为诊断标志物的效能
血清糖组检测是一种评估肝脏状态的非侵入性方法。通过糖组标志物的确定,建立相关的预测模型和方法,来预测和辅助诊断相关的疾病(包括肝纤维化、肝硬化、肝癌),以及进行肝移植的过程监测。
3.1 肝纤维化诊断标志物
肝纤维化是一个病理生理过程,多种致病因子会导致肝内结缔组织异常增生。对于乙型肝炎病毒感染引起的肝纤维化,由于病人体内病毒长期存在,不断刺激免疫系统产生免疫反应,最终导致肝细胞受损、凋亡。
Kam等[40]利用飞行时间质谱技术(MALDITOF)发现,N-糖组图谱可作为乙型肝炎肝纤维化的诊断标志物,在17个N-糖相关的标志物中,通过线性回归发现4个峰纳入诊断模型,对于46例肝纤维化诊断的AUC达到0.912,灵敏度85%,特异度84%。随后,Gui等[41]在173例乙型肝炎患者中,通过荧光CE技术获得血清的N-糖组图谱,发现N-糖链的变化与肝纤维化的分级显著相关。该研究组用GlycoFibroTest算法获得了诊断肝纤维化的AUC为0.740,略优于肝纤四项(FibroTest)。同时,N-糖组图谱对肝纤维化的诊断效能,在128例肝损伤病理结果确认的样本中得到了验证;且研究组进一步发现N-糖组图谱在区分纤维化不同阶段方面的潜力[42]。此后,Cao等[43]基于423例乙型肝炎肝纤维化患者的N-糖组图谱的分析结果,建立了多参数的诊断模型,对于肝纤维化F0-F1/F2/F3/F4的分期效能分别为0.917、0.720和0.785。
3.2 肝硬化诊断标志物
乙型肝炎病毒感染后,肝脏经历损伤、产生纤维因子,使纤维母细胞合成胶原的作用增强,致使肝内纤维组织不断地增生,形成纤维包绕的异常肝细胞结节(假小叶),即形成肝硬化。
Callewaert等[31]基于荧光CE技术,分析丙型肝炎肝硬化病人的血清中蛋白糖组图谱。该方法对于24例代偿期肝硬化病例的灵敏度为79%,特异度为86%;对于24例失代偿期肝硬化病例的诊断,达到了100%的灵敏度和特异度。与之一致,Kam等[40]利用MALDI-TOF获得N-糖组图谱,对46例乙型肝炎肝硬化诊断的AUC达到0.911,灵敏度88%,特异度83%。
3.3 肝癌的诊断标志物
由乙型肝炎病毒所引发的肝炎、肝硬化、肝癌被众多医者比喻为肝癌“三部曲”。我国的肝癌患者约90%与慢性乙型肝炎病毒感染有关。85% ~ 95%的肝癌发生在肝硬化基础上。
陈萃英研究组发现,与乙型肝炎肝硬化患者相比,乙型肝炎肝癌患者血清中的α-1,3-岩藻糖基化三天线寡糖增加,而二平分的核心α-1,6-岩藻糖基化二天线寡糖降低。针对这2个标志物建立的分析预测模型GlycoHCCTest对HCC患者的诊断准确率为81%,优于常规的AFP检测(对HCC患者的诊断准确率为50% ~ 60%)[32]。与此一致,Comunale等[44]报道了总血清的聚糖分析方法,其区分乙型肝炎肝硬化和乙型肝炎肝癌的AUC为0.851,灵敏度为73%,特异性为88%。并且,总血清聚糖分析方法与AFP检测联合应用时,对乙型肝炎肝癌的灵敏度在90%的特异性下可提高到95%。此后,Cong等[45]通过血清糖组中3个特征糖峰,建立了早癌预测模型Glycomics-EHCC。在247例患者中,该模型在临界值为-0.39时,区分早期HCC与肝纤维化/肝硬化的灵敏度为84.6%,特异性为85.0%。此外,在67例早期HCC患者确诊前6和12个月的样本中,该模型预测早期HCC的灵敏度和特异性分别超过90%和85%。
3.4 肝移植过程的监测
肝脏移植是终末肝病的最终治疗手段,移植成功后的病人生存率较长。对于移植手术,移植肝脏的状态直接影响移植结局。在一项肝脏移植手术中,研究人员前瞻性地对肝脏灌洗液进行糖组检测,发现在原发性肝失能病例中出现特征的去唾液酸无半乳糖核心岩藻糖基化二天线N-聚糖,与移植的结局完全相符[46],提示糖组检测在肝移植过程监测中的潜力。
4 糖组检测方法
检测技术的发展和进步,为糖组在各种疾病(特别是肝脏疾病)领域的基础研究和临床应用提供了强有力的支撑。从糖蛋白上释放的糖链/糖组,可通过质谱(成像)、高效液相色谱和CE等技术对其进行直接分离和分析,或使用凝聚素芯片进行间接检测。
质谱技术基于物质质荷比,对分子进行直接解析,在疾病标志物的发现中占有重要的位置。2010年后,质谱技术在糖肽和糖链分析中的显著进步,推动了该技术在糖蛋白质组学和糖组学中的应用[47-48]。质谱技术具有高灵敏度、高覆盖率和高分辨等优势。但是,设备、专业分析人员、复杂样本预处理及结果稳定性不佳等方面的因素,制约了质谱技术在临床中的大规模应用[49]。基于质谱技术的质谱成像技术,在包括肝癌在内的肿瘤诊断中展现了巨大的价值[25]。质谱成像技术在病理切片样本分析中的应用,展现了其无需标记、高灵敏和可反映分子的空间分布等优势。在未来的临床应用中,高昂的平台建设和复杂的前处理过程仍是需要解决的问题。高效液相色谱具有优越的分离功能,常与质谱技术联用,可将灵敏度提高至纳克水平[50]。而单独使用高效液相色谱时,仍需要对样本进行相应前处理来获得高质量的结果。
临床应用场景中,操作简单、灵敏、可靠和高通量是决定检测能否大规模使用的先决条件。CE是以高压电场为驱动力,分离不同构型糖链的方法。只需微量样本,无需样本预处理,即可对样本进行高灵敏和高分辨率的检测,且每次上机可以达到96个样品的检测通量[51]。
凝集素芯片是间接的糖组检测方法,该方法系通过凝集素对特定寡糖结构、糖键和糖型的识别,检测样本间的糖组差异。对于各种天然/重组的凝集素的高需求、糖芯片定制的复杂性,以及特异度不高等因素,限制了该方法在临床应用过程中的推广[52]。
以上糖组检测技术的方法、检测原理、优势和现存问题如表1所示。CE技术因其操作简单、无需样本前处理、只需微量样本、高灵敏等特性,目前正在临床转化过程中[53]。质谱(成像)、高效液相色谱和凝集素芯片技术则广泛应用于实验室研究中。在未来的技术发展过程中,降低仪器成本、简化样本预处理过程、提高样本处理和分析自动化水平是糖组检测技术的主要发展方向。

表 1 糖组检测技术汇总Table 1 Glycome test techniques
5 结语与展望
在生理和病理过程中,糖链均发挥着重要的作用。糖链结构和数量的改变,与肝病尤其是肝癌的发生发展密切相关。近几十年的研究表明,血清糖组在肝纤维化、肝硬化和肝癌的诊断和预后中具有巨大潜力。
未来,血清糖组的临床数据和进入临床后的随访数据,将更清晰地为其在临床病人管理、诊断、治疗和预后中提供方向。此外,在肝癌发生发展的过程中,特征糖链的生物学意义将会得到阐明,为疾病的干预提供新的手段。
感染乙型肝炎病毒后,部分患者会经历肝炎、肝硬化,甚至肝癌的病程阶段,需要终身随访和管理。如何对肝病进行全周期的管理,是一个重大挑战。结合现有的临床诊断和干预手段,我们也对肝病糖组寄以厚望,相信它能为临床的决策提供新的信息和手段。
