眼表局部给药的屏障及克服屏障的方法研究进展
2022-01-10彭后平孙丽萍李晓林操锋
彭后平,孙丽萍,李晓林,操锋
(中国药科大学药学院,江苏 南京 210009)
智能电子产品的普及和学习工作压力的加剧等因素,促使青光眼、干眼症、结膜炎和葡萄膜炎等常见的眼前段疾病发病率逐年提升且出现年轻化的趋势。而人口老龄化、“三高”人数增多和生活方式的改变等因素使年龄相关性黄斑变性(AMD)、巨细胞病毒视网膜炎(CMV retinitis)、脉络膜新生血管生成(CNV)、糖尿病性视网膜病变(DR)等严重威胁视力的眼后段疾病的患病人数逐年上升。眼结构的复杂性使药物向眼前段和眼后段的递送面临巨大挑战,新型眼部药物递送系统的开发成为迫切需求。玻璃体内注射是眼后段疾病的主要给药方式,这种侵入式给药方式的眼部生物利用度虽高,但患者无法自主给药,需手法熟练的医生每1~6个月给患者注射1次药物,患者的顺应性极差,同时还伴随眼部炎症、结膜下出血、晶状体损伤和视网膜脱离等严重的并发症[1]。眼表局部给药是眼前段疾病常用的给药方式,具有使用简便、成本较低和患者接受度高等优点,然而眼表局部给药需克服众多眼部给药屏障,生物利用度低于5%[2]。随着近年来材料科学和纳米制剂的发展,眼表局部给药治疗眼前段和眼后段疾病取得了显著进步。本文介绍了眼表局部给药需克服的屏障,以及克服这些屏障的方法研究进展,以期为眼部疾病的治疗提供新思路。
1 眼的解剖结构及药物到达眼内的途径
眼以晶状体为界分为眼前段和眼后段,眼前段约占眼球的1/3,主要包括角膜、结膜、虹膜、睫状体、房水、晶状体和巩膜前部;眼后段约占眼球的2/3,主要包括玻璃体、视网膜、脉络膜和巩膜后部。现阶段研究认为,局部给药的眼用制剂由3种方式到达眼组织内:1)角膜途径:药物从角膜渗透到房水,后通过玻璃体到达眼后段组织;2)结膜途径:药物从结膜通过,经葡萄膜处的眼周液体扩散至巩膜,后到达脉络膜和视网膜等眼后段组织;3)葡萄膜-巩膜途径:进入房水中的药物横向扩散通过葡萄膜-巩膜,到达脉络膜和视网膜。人体结膜组织和巩膜组织的表面积分别是角膜组织表面积的17倍和16.3倍,结膜途径因其更大的表面积而成为大分子蛋白类亲水性药物和亲水性纳米制剂递送至眼组织内的主要途径[3]。局部给药时,结膜从泪液中摄取药物的量远大于角膜。
2 眼表局部给药屏障
通常眼屏障可分为生理屏障、解剖屏障和其他屏障3部分。眼生理屏障包括泪流、鼻泪管引流和眨眼反射。眼解剖屏障包括静态屏障和动态屏障,其中前者包括眼前段的角膜屏障和血-房水屏障(BAB)以及眼后段的巩膜、脉络膜和血-视网膜屏障(BRB),后者包括眼部的血液、淋巴、泪液和房水。其他屏障则包括眼黏液、黑色素、药物外排转运蛋白和眼部代谢酶等。这些眼屏障限制药物进入眼内,本文将其称之为眼部给药屏障。眼表局部给药无论到达眼前段还是眼后段,共有的眼部给药屏障有泪液屏障、黏液屏障、角膜屏障、结膜屏障、药物外排转运蛋白屏障、黑色素结合和代谢屏障。眼表局部给药到达眼前段的给药屏障还有BAB和晶状体屏障。眼表局部给药到达眼后段的给药屏障还有玻璃体屏障、巩膜屏障、脉络膜屏障和BRB(见表1)。
2.1 眼前段与眼后段共有的给药屏障
2.1.1 泪液屏障 泪液是一种pH为7.4的水性液体,包含电解质、脂质、溶菌酶和黏蛋白或非黏蛋白等蛋白质。泪液屏障包括以下3个部分。1)泪膜屏障:泪膜是位于角膜前最外层的薄膜,从外到内依次是脂质层和水层,总厚度约为3 μm。脂质层由游离脂肪酸、三酰甘油、磷脂和胆固醇等物质组成,可密封天然泪液,防止水层被蒸发。水层占泪膜总体积的90%,可润湿和润滑眼表,洗去外来颗粒,并有助于防止眼部感染,溶菌酶是其主要成分。2)鼻-泪引流与泪液周转:角膜前的区域保留容量有限,仅有约30 μL。每滴滴眼液滴入眼内后,大部分药物溶液会通过鼻泪管迅速从眼表排出,泪液恢复到7.5 μL的原有体积[4],这导致药物在角膜前损失。正常情况下,泪液的周转速率为0.5 ~ 2.2 µL · min-1,给药后的眨眼反射使泪液的周转速率加快,这导致药物在眼表的滞留时间缩短[5]。3)泪液中的蛋白质与药物的结合:泪液的准确组成未知,但已确定的蛋白如球蛋白、白蛋白和乳铁蛋白等会与药物结合,导致眼内游离药物减少。眼表局部给药后,药物及其制剂必须首先克服泪液屏障才可能向眼内转运。
2.1.2 黏液屏障 黏液覆盖于人体黏膜表面,是复杂的黏弹性水凝胶。眼的角膜和结膜也覆盖一层黏液,该层在上皮细胞顶端最密集,向外延伸到泪液中变稀[6]。眼黏液约95%的成分为水,其他成分为黏蛋白和非黏蛋白以及盐和脂质等,具有润滑、细胞信号传导及保护上皮免受外部有害物质侵害的作用。黏蛋白是富含脯氨酸、苏氨酸和丝氨酸重复结构域的多肽骨架,其高度糖基化且整体带负电荷。黏蛋白之间通过二硫键、静电、氢键和疏水力作用组装成交联网络,保护底层组织免受异物侵害。黏蛋白不仅彼此间相互作用构成三维网络结构,还与药物经静电相互吸引或排斥影响粒子的扩散,构成药物向眼内递送的屏障[7]。

表 1 眼表局部给药屏障Table 1 Barriers of topical ocular drug delivery
2.1.3 角膜屏障 角膜位于眼球前部,是无血管和淋巴的完全透明的最大的静态屏障。角膜分为上皮细胞层、前弹力层、基质层、后弹力层和内皮细胞层,其中角膜上皮细胞层和基质层是药物递送的主要屏障。角膜上皮细胞层由3~6层富含脂质并紧密连接的上皮细胞构成,对大多数亲水性药物和少数亲脂性药物起屏障作用,导致药物大多停留在上皮层。基质层由水、胶原、蛋白聚糖和角膜基质细胞组成,占角膜厚度的90%,是亲脂性药物渗透通过角膜的主要屏障[4]。内皮层由孔状的单细胞层组成,通透性比上皮层大,允许大分子物质通过。基于角膜上皮细胞层和基质层的双重屏障作用,只有具合适的油水分配系数和解离常数(pKa)的药物分子和有适当的黏附性和渗透性的制剂,才有较好的角膜渗透性。
2.1.4 结膜屏障 结膜连接眼睑与眼球,是富含血管的透明薄层黏膜,表面积为16 ~ 18 cm2。结膜覆盖于眼睑前面和眼球后面,包括睑结膜和球结膜以及二者交界处的穹隆结膜。结膜产生的泪膜和黏液可润滑和保护眼睛。亲水性和相对分子质量小于20 000的药物易穿透结膜的黏液层到达结膜淋巴液和血液内,被结膜淋巴和血液循环带走[8],降低到达眼组织内的药物量。
2.1.5 药物外排转运蛋白屏障 同人体其他组织一样,眼组织细胞膜上也存在可保护眼组织免于暴露于潜在有毒异物的药物转运蛋白,角膜、结膜、BAB和BRB中药物转运蛋白均可能影响药物向眼内的递送。抗生素、抗病毒药、抗炎药、α-肾上腺素能受体激动剂、前列腺素类似物和抗代谢物等小分子药物,广泛受药物转运蛋白的影响。药物转运蛋白分为内流转运蛋白和外排转运蛋白,前者包括寡肽转运蛋白、葡萄糖转运蛋白-1、单羧酸转运蛋白、有机阴离子转运体和有机阳离子转运体等,后者包括P-糖蛋白(P-gp)、乳腺癌耐药蛋白(BCRP)和多药耐药相关蛋白(MRP),是药物递送的屏障。已知P-gp限制两亲性化合物进入正常组织和癌症组织,MRP外排有机阴离子和共轭化合物。在此仅简述药物外排转运蛋白。
药物转运蛋白的表达在保护角膜免受异物的刺激和毒害方面发挥重要作用。人角膜表达P-gp、BCRP和MRP(包括MRP1、MRP2、MRP3、MRP4、MRP5和MRP6)[9]。目前关于人角膜表达的药物外排转运蛋白对药物递送的影响的研究较少,已报道的离体和体内研究主要集中在兔角膜,但药物转运蛋白在角膜上皮细胞的表达存在物种差异性,因此将此类数据从动物外推到人时必须谨慎。药物在结膜的清除主要依赖结膜的血液和淋巴循环,药物转运蛋白的屏障作用相对较小,因此结膜上药物转运蛋白的表达与活性受到的关注与研究更少,仅证实P-gp和MRP1在兔结膜顶侧表达[10]。BAB是以虹膜-睫状体为解剖基础的血-眼屏障,P-gp、BCRP、MRP1、MRP2和MRP3在人睫状体和虹膜上表达,其中睫状体无色素上皮细胞层顶膜的MRP经研究被认为参与构成BAB[11]。BRB是以视网膜为解剖基础的血-眼屏障,已确证RPE表达P-gp、BCRP和MRP,但各外排转运蛋白表达和定位的详细信息在不同的报道里不一致。总之,需开展更多研究以确定药物外排转运蛋白在角膜、结膜、BAB和BRB中的表达和定位,以及其对药物转运产生的影响。
2.1.6 药物与黑色素结合 黑色素是约1 μm左右的颗粒,含羧基且带负电荷,具有酸性和疏水性,在眼葡萄膜和视网膜色素上皮中广泛存在。葡萄膜又称为色素膜,是位于巩膜与视网膜之间的富含色素和血管的组织,其包括眼前段的虹膜和睫状体以及眼后段的脉络膜。药物与黑色素结合但机制尚不清楚,范德华力、离子相互作用、疏水相互作用和电荷转移相互作用可能参与此过程[4]。哺乳动物的黑色素以真黑色素和褐色素这2种不同的化学形式存在,真黑色素与药物的结合效率相对更高,因此有必要进一步研究眼部黑色素的分子组成,以了解和预测其对眼部药物分布的影响。由于黑色素具有酸性和疏水性,所以带正电荷的药物和制剂、脂溶性药物和金属离子易与黑色素结合,如亲脂性的β-阻滞剂与脉络膜和视网膜中的黑色素大量结合,只有小部分处于游离形式,而寡核苷酸类亲水性药物不易与黑色素结合[12]。药物与黑色素的结合具有高亲和性和高容量性,微摩尔级别的黑色素也能结合较多的药物量。黑色素与药物的结合影响眼后段组织中药物的分布已被证实,例如食蟹猴多次接受溴莫尼定眼表局部给药后,含黑色素的眼组织虹膜、睫状体和视网膜/脉络膜中药物的曲线下面积(AUC)分别是无色素眼组织玻璃体中药物的1 103、1 396和1 561倍[13]。葡萄膜中的黑色素与药物的结合一方面使眼后段游离药物的浓度降低,另一方面导致药物向RPE和脉络膜蓄积,延长药物的作用时间。Rimpelä等[13]研究了5种模型药物(氯喹、普萘洛尔、噻吗洛尔、双氯芬酸和甲氨蝶呤)在RPE和无色素人视网膜上皮细胞ARPE-19中的药物结合与摄取,发现RPE中药物的细胞摄取率为ARPE-19中的30 ~ 270倍,RPE中药物的未结合率为ARPE-19中的10% ~ 33%,表明色素细胞中有大量药物与黑色素结合。可见,黑色素结合是药物递送设计中应考虑的重要因素,其既有利于形成药物贮库、发挥缓释控释效果,也有利于药物靶向色素细胞。
2.1.7 代谢屏障 药物代谢酶分为Ⅰ相药物代谢酶和Ⅱ相药物代谢酶,其在药物代谢中起重要催化作用,在眼组织中也不例外。Ⅰ相药物代谢酶属于微粒体药物代谢酶系统,CYP450是其中重要的一类,它们是含血红素的同工酶家族,参与约80%药物的氧化代谢和约50%药物的消除[14]。Ⅱ相药物代谢酶是非微粒体酶系统,主要催化葡萄糖醛酸化、硫酸化或乙酰化反应。眼组织中的药物代谢酶可使药物分子降解或者对药物产生的毒性起解毒作用,但这对眼部疾病的治疗药物构成屏障作用,有文献称之为眼的代谢屏障,并且认为人眼的代谢屏障主要由CYP450组成[15]。在人角膜、视网膜和脉络膜组织中均检测到CYP2A6、CYP3A4、CYP2C8、CYP2D6和CYP2E1的基因,尽管已经在mRNA和蛋白质水平上表征了几种眼部CYP450,但需要开展更多的研究以确定该酶底物的特异性以及这种特异性对药物向眼内递送产生的影响。关于眼部的Ⅱ相药物代谢酶,研究发现牛睫状体、RPE和脉络膜中存在谷胱甘肽S-转移酶和N-乙酰基转移酶。从人Y-79视网膜母细胞瘤、ARPE-19、角膜上皮和角膜角化细胞系,或新鲜分离的眼组织和上皮细胞中获得的永生化细胞系对于识别眼部药物代谢酶的存在至关重要[16]。体外微粒体、细胞质和S9组分是研究全眼或眼部组织总体药物处置后代谢的有利模型。这类模型简单、可重复且易于在临床前研究进行不同种属与人之间的桥接。在组织或细胞水平上测定眼部代谢对了解局部用药后药物的眼部处置和转运具有重要意义。
2.2 眼前段的给药屏障
2.2.1 血-房水屏障 BAB是以眼前段的睫状体和虹膜为解剖基础的血-眼屏障,由无色素睫状上皮细胞和虹膜后部以及虹膜周围的紧密内皮和睫状体内毛细血管构成。从内向外,睫状体一共分为五部分:无色素睫状上皮、色素睫状上皮、基质、睫状肌和睫状体上腔。其中无色素睫状上皮细胞间以及色素睫状上皮细胞间存在紧密连接,阻碍药物分子进入眼内。虹膜内毛细血管管径较小,内皮细胞间连接紧密,血液内血浆蛋白等大分子不能通过,药物大分子在血液和房水间的往来也受到阻碍。睫状上皮下的毛细血管的管径较大,血管内皮细胞壁上有小孔,血液中的分子可自由通过进入到实质组织。兔虹膜和睫状体的总血流量约为144 mL · min-1,小分子亲脂性化合物的血流清除率高达10 ~ 20 mL · min-1[17],大分子如菊粉在虹膜和睫状体的血流清除率则基本为零。房水98.78%的体积为水,BAB的存在使房水中蛋白成分比血浆低,正常情况下房水的生成率为2 ~ 2.5 mL · min-1。药物及纳米制剂通过BAB的渗透性取决于渗透压和药物分子的理化特性,其中分子的大小是主要因素,小分子可渗透,蛋白质和直径2 nm及以上的大分子通过受到限制[18]。
2.2.2 晶状体屏障 晶状体位于眼球后方,处于虹膜后表面和玻璃体表面之间,由晶状体囊和晶状体纤维组成,是透明的无神经且无血管的组织。晶状体囊主要由胶原、硫酸软骨素和纤维蛋白构成,晶状纤维由蛋白质和类蛋白质构成,主要包括α-、β-、γ-晶状体蛋白,每种蛋白的分子结构内都含有数目不同的巯基。因晶状体是高度填充的纤维细胞,故药物在晶状体内的分布相当缓慢。Sigurdsson等[19]给兔眼局部滴注地塞米松后,观察到晶状体中地塞米松的浓度为房水中浓度的6.47%,为虹膜和睫状体中浓度的8.08%。Heikkinen等[20]研究了16种药物和3种荧光染料在整个猪晶状体中的分布,结果表明,药物和染料在晶状体中始终仅分布在结构较疏松的囊、上皮和皮质中,而不在结构致密的晶状体核中分布,药物分布到猪晶状体的程度普遍较低而与化合物的性质无关。总之,晶状体在前房和玻璃体之间形成的致密屏障限制了药物从前房到玻璃体的分布。
2.3 眼后段的给药屏障
2.3.1 玻璃体屏障 玻璃体位于晶状体和视网膜之间,由98%的水与2%的胶原和透明质酸组成,为无色透明的胶体。成人的玻璃体体积约为4.5 mL,占人眼的80%左右。玻璃体中的蛋白大部分为结构蛋白,包括胶原蛋白、纤维蛋白和软骨寡聚基质蛋白,还含有白蛋白、免疫球蛋白、补体蛋白和转铁蛋白等少量的功能性蛋白。结构蛋白呈三维结构排列形成网架,其上附着透明质酸黏多糖。透明质酸黏多糖是相对分子质量为2h 106~ 4h 106的阴离子亲水聚合物,整体的净电荷为负,能吸引并结合正离子和水[21]。透明质酸在眼内分布不均匀,其提供的溶胀压力使纤维蛋白分开而支撑视网膜。玻璃体组织本身形成的静态屏障和其凝胶状态拥有的流变特性形成的动态屏障共同构成玻璃体的屏障作用。一般来说,带正电的纳米材料会与玻璃体网格的带负电组分相互作用,导致在扩散中受阻,带负电的粒子,如聚乳酸-羟基乙酸(PLGA)或人血清白蛋白等,可成功地分布在玻璃体的各部分[22]。制剂在黏性水凝胶状态的玻璃体液内的移动或扩散非常缓慢且不一致。药物分子的消除和分布主要取决于药物在玻璃体中的扩散速率,较大的粒子由于扩散更慢而在玻璃体中的停留时间比小粒子更长[23]。
2.3.2 巩膜屏障 巩膜是眼球最外层的不透明保护性膜,富含胶原蛋白和弹性纤维。巩膜可分为3层,巩膜表层为一层疏松的纤维组织,巩膜基质层为粗细不均匀且斜向紧密排列的不透明的致密结缔组织层,棕黑色板层由细小的弹力纤维组成,内含大量的色素细胞[24]。巩膜的膜面积约为16 ~ 17 cm2,为排列疏松的胶原纤维,水化程度高,约1/3的膜面积被球结膜黏附,药物到达此处易被清除。巩膜复杂的纤维网络结构使小分子药物在巩膜的渗透性更高,此外亲水性分子比亲脂性分子更易通过巩膜。研究还发现巩膜细胞外基质的蛋白聚糖带负电荷,故呈正电性的分子在巩膜中的渗透性较低[25]。
2.3.3 脉络膜屏障 脉络膜是位于视网膜色素上皮和巩膜之间的高度血管化层,可将血液中的氧气和营养物质输送到视网膜。脉络膜从外向内分为5层:脉络膜上腔、两层血管层、脉络膜毛细血管层和Bruch膜。脉络膜毛细血管的小孔允许营养物质及蛋白质等大分子通过,高速的脉络膜血液循环为高代谢活性的视网膜色素上皮细胞提供必需的氧气和营养物质。Abarca等[26]研究了高速的脉络膜血液循环对药物在眼组织中的递送产生的影响,结果显示脉络膜的基质会结合亲脂性药物,亲水性药物注射到脉络膜上腔后,在脉络膜循环中被部分清除,即脉络膜循环阻碍亲水性化合物有效地向眼后段递送。
2.3.4 血-视网膜屏障 BRB是基于视网膜的血-眼屏障,由视网膜毛细血管的内皮细胞组成,分为内BRB和外BRB。视网膜是一层紧贴在脉络膜内面柔软而透明的膜,是眼睛中神经和血管最多的部分。视网膜自内向外分为10层:内界膜、神经纤维层、神经节细胞层、内丛状层、内核层、外丛状层、外核层、外限制层、感光层(由视杆和视锥细胞组成)和RPE。内BRB由视网膜毛细血管内皮形成,阻止视网膜毛细血管内的成分自由地进入到视网膜。视网膜毛细血管内皮顶端细胞间的紧密连接,导致内BRB具有与血脑屏障阻力相当的跨膜阻力,阻碍直径2 nm及以上分子的渗透,小分子可以一定程度地渗透到内BRB。外BRB由RPE、Bruch膜和脉络膜毛细血管层组成,阻止脉络膜来源的异常成分进入视网膜。与RPE和视网膜内皮血管相比,脉络膜毛细血管缺少紧密连接,允许蛋白质等大分子通过[27]。因此,构成外BRB的脉络膜毛细血管不是限制大分子向视网膜扩散的主要因素。RPE细胞间的紧密连接是限制直径2 nm及以上的大分子药物及纳米制剂渗透的主要因素,小分子的渗透则取决于它们的亲脂性,例如同为小分子化合物,亲水性药物萘多洛尔的渗透率为2h 10-6cm·s-1,而亲脂性药物紫杉醇的渗透率是萘多洛尔的8倍[16]。
3 克服眼表局部给药屏障的方法
材料科学和制剂学的进步使基于纳米制剂的眼表局部新型药物递送系统成为治疗眼科疾病的新希望。相比传统制剂和侵入式治疗,经眼表局部给药的新型眼部药物递送系统可延长药物在眼表的滞留时间、增强药物在眼组织的渗透性并有效地将药物递送至靶部位。经调研,眼表局部给药常用的手段有凝胶、乳剂、胶束、聚合物纳米颗粒、环糊精聚集体、层状双氢氧化物、脂质体、脂质纳米颗粒、树状聚合物和前药(见表2)。
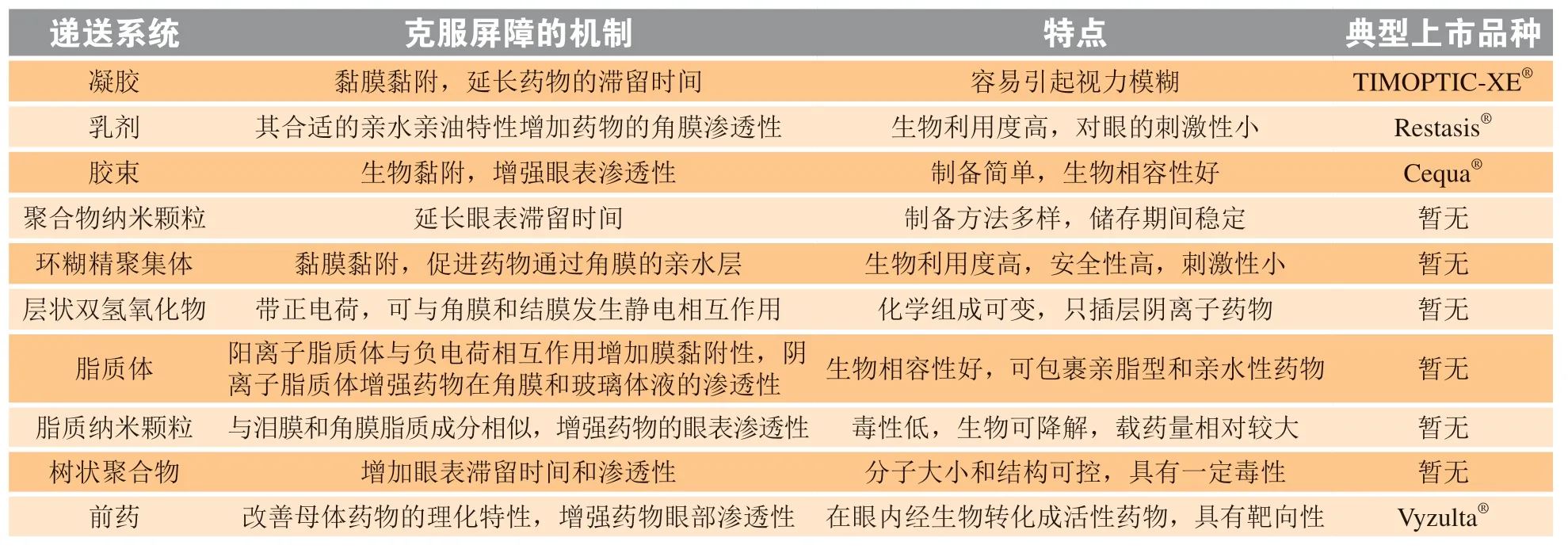
表 2 克服眼表局部给药屏障的方法Table 2 Strategies to overcome the ocular barriers via topical administration
3.1 凝胶
凝胶分为普通凝胶和即型凝胶。普通凝胶可延长药物的眼表滞留时间,减少药物鼻泪引流,但给药不便,用药期间视力模糊。即型凝胶以低黏度的溶液形式滴入眼表,在眼表离子(Na+、Mg2+和Ca2+等)、温度或pH环境条件的刺激下转化为凝胶状态[28]。TIMOPTIC-XE®是Valeant Pharms研制的以结冷胶为凝胶基质的马来酸噻吗洛尔离子敏感型眼用即型凝胶,1993年11月被FDA批准用于治疗眼前段疾病青光眼。Karthik等[29]研究显示,基于结冷胶制备的纳他霉素(NT)即型凝胶(NTG)与市售混悬液Natacyn®相比,其在兔角膜的稳态通量提高6.3 ~ 9.0倍,给药6 h后NTG组的角膜和巩膜中NT量显著高于Natacyn®组。曲安奈德(TA)是治疗后葡萄膜炎和糖尿病性黄斑水肿等眼后段疾病的皮质类固醇。Akshaya等[30]以TA的固体脂质纳米粒(TA-SLN)为基础加入结冷胶作为凝胶基质制备了离子敏感型即型凝胶(TA-SLN-IG),在兔眼单次局部给药后,TA-SLN-IG组的玻璃体、视网膜和巩膜中的TA浓度分别是TA-SLN组的2.8、4.1和4.2倍。TA-SLN-IG因克服了泪液屏障、结膜屏障和巩膜屏障而延长了药物在眼表和结膜囊中的滞留时间,增加了角膜渗透性,进而增加眼后段组织中的药物浓度。除离子响应性即型凝胶外,温度响应性即型凝胶和pH响应性即型凝胶也被认为是向眼内递送药物的良好载体,它们都具有成本低、易于生产和生物相容性好等优点[31]。
3.2 乳剂
乳剂分为普通乳、微乳和纳米乳,尺寸为5 ~200 nm的乳剂可增强药物在角膜前的渗透性及眼部药物的生物利用度。O/W型乳剂因可改善脂溶性药物的溶解度且对眼组织刺激性低而被用于眼表局部药物的递送[32]。Restasis®是Allergan公司研制的O/W型环孢素A阴离子纳米乳剂,用于治疗眼部炎症导致的干眼症,2002年12月被FDA批准上市,是首个市售的眼用乳剂。Ayman等[33]制备的曲伏前列素纳米乳剂同市售曲伏前列素滴眼液(Travatan®)相比,单次给药后Travatan®可维持36 h的治疗时间,而曲伏前列素纳米乳剂可维持正常的眼压直至60 h。乳剂在结膜囊中的滞留时间长,合适的亲水亲油特性使其容易渗透通过角膜屏障,大的比表面积增加药物在角膜的吸收,因此增加药物在眼部的生物利用度。Zhang等[34]制备的他克莫司阳离子纳米乳与市售制剂Talymus®相比,药物在角膜前的滞留时间延长,兔房水的平均驻留时间(MRT)显著延长。乳剂可改善药物的水溶性,增加药物的载药量并延长药物在眼表的滞留时间,是将疏水性药物递送至眼前段的合适载体,是一种应用于眼部疾病的有前景的剂型。
3.3 胶束
包含表面活性剂纳米胶束和聚合物纳米胶束在内的纳米胶束逐渐成为将药物递送至眼内的新型递送手段。两亲性分子或高分子聚合物在水性介质中自组装形成具有核-壳结构的纳米胶束递送载体,其纳米级的尺寸(10 ~ 100 nm)具有药物递送的优势,如制备简单、增加药物的溶解性和稳定性、增强眼表的渗透性以及生物相容性好[35]等。Cequa®是Sun Pharma研制的一款环孢素A纳米胶束制剂,可提高泪液产量,用于治疗干眼症,2018年8月被FDA批准上市。Lin等[36]制备了他克莫司两亲性聚乙二醇-聚谷氨酸苄基酯嵌段共聚物纳米胶束,对兔眼单次给药30 min后,其房水中产生的药物浓度比市售制剂高18倍。笔者所在课题组设计的用于眼表局部药物递送的主动靶向型壳寡糖-缬氨酰缬氨酸-硬脂酸纳米胶束(CSO-VV-SA),在细胞和动物水平上获得了与基于Cequa®处方制备的混合纳米胶束(氢化蓖麻油40/辛氧基醇40)相当的滞留时间、渗透性和生物利用度,并证明了纳米胶束主要通过结膜途径到达眼后段[37]。胶束被认为是一种治疗眼前段和眼后段疾病非常有前景的载体。
3.4 聚合物纳米颗粒
聚合物的组成具有多样性,具有胶体纳米尺寸(1 ~ 1 000 nm)的聚合物纳米颗粒是合适的新型眼部药物递送系统。PLGA是获FDA批准的可用于眼部药物递送的纳米载体,也是目前纳米载体系统领域应用最广泛的生物相容性和可生物降解的聚合物材料。Qureshi等[38]制备了对视神经有保护作用、可应用于青光眼治疗的PLGA-聚乙二醇(PEG)纳米颗粒,在离体兔角膜和巩膜中有较高的渗透率。Fan等[39]制备了曲安奈德PLGA复合物纳米颗粒,对兔眼给药后,药物在房水中的峰浓度Cmax和AUC0-6h分别为曲安奈德混悬液组的36.8和44.9倍。细胞穿透肽具有细胞膜穿透作用,可携带寡核苷酸、质粒DNA、小肽、蛋白质和纳米颗粒等物质克服眼屏障,增加制剂在眼表的渗透性和靶部位的药物浓度。Jiang等[40]设计了一种类似“章鱼”的柔性八价穿透蛋白(8VP),以多臂PEG为核心,PEG臂两端的结合穿透蛋白作为伸展触角,促进治疗性核酸的浓缩和输送。8VP稳定地将核酸压缩成小于100 nm的带正电的多聚体,可使细胞摄取效率提高近100%,使转染率提高75%以上。将8VP注入结膜囊后,8VP通过非角膜途径使核酸在视网膜中迅速分布且保留时间长于6 h。在视网膜母细胞瘤荷瘤小鼠模型中,局部滴注8VP/siRNA可有效抑制眼内肿瘤蛋白的表达且眼部耐受性良好。纳米颗粒是经眼表局部给药将药物有效递送至眼内的良好载体。
3.5 环糊精聚集体
环糊精是一种用途广泛的功能性辅料,其外表存在羟基,分子之间可以形成氢键,在水溶液中可以自组装形成聚集体。对于药物-环糊精包合物而言,疏水性的药物客体分子也能驱动聚集体的形成,从而形成纳米和微米级的聚集体。利用药物与环糊精的包合物在水溶液中易自组装形成聚集体的特性,制备环糊精聚集体也成为提高药物眼表局部给药生物利用度的策略之一。环糊精聚集体主要从以下3个方面促进药物在眼部的吸收:1)包合物聚集体可增加药物在水溶液中的溶解度,从而提高药物在泪液中的浓度;2)聚集体具有黏膜黏附性,可以延长药物眼表滞留时间,持续释放药物;3)聚集体作为载体能促进药物通过亲水层从而直接到达角膜外侧[41]。Jansook等[42]制备了含有环糊精聚集体的多佐胺-γ环糊精混悬滴眼液,与市售的多佐胺滴眼液(Trusopt®)相比,家兔单次眼表局部给药4和8 h后,房水中多佐胺的浓度分别提高了13和45倍。环糊精聚集体滴眼液可提供房水中长达24 h的持续高浓度多佐胺,而Trusopt®在给药8 h后在房水中几乎检测不到多佐胺。Johannsdottir等[43]通过家兔的组织分布试验证明了地塞米松-γ环糊精混悬滴眼液可将治疗浓度的地塞米松递送到眼后段组织,并研究表明非角膜途径是地塞米松从眼表渗透到眼后段的主要途径。此外越来越多的相关研究显示环糊精聚集体技术在提高药物眼表局部给药生物利用度和实现药物眼后段递送方面具有一定潜力。
3.6 层状双氢氧化物
层状双氢氧化物(LDH)是由带正电的水-镁石样层组成的无机层状化合物,中间层区域包含电荷补偿阴离子和溶剂化分子,整体带正电。阴离子药物易插层于LDH板层间形成LDH插层材料。有机无机杂化的LDH因同时具有有机材料和无机材料的优点而在药物递送中受到重视。近10年来笔者所在课题组开展了基于LDH的眼表局部药物递送系统的研究,基于LDH和壳聚糖-谷胱甘肽(CG)衍生物,合成了吡诺克辛钠(PRN)眼用新型纳米复合滴眼液(CG-PRN-LDH),兔体内角膜前滞留实验结果显示CG-PRN-LDH纳米复合滴眼液的MRT和AUC0-6h分别比市售PRN滴眼液高2.1和6.3倍。在LDH表面接上PepT-1的底物缬氨酰缬氨酸(VV)后获得的靶向制剂CG-VV-PRN-LDH在兔体外角膜渗透试验中的累积渗透量比市售制剂高5.2倍。体内实验中兔眼晶状体的AUC0-8h和MRT分别比市售制剂组高14.7和2.2倍[44]。用LDH、功能性羧甲基壳聚糖(CMCS)、VV和谷胱甘肽-甘氨酰肌氨酸(GS)制备的地塞米松磷酸钠(DEXP)靶向纳米复合物滴眼液CMCS-GS-DEXP-LDH的兔角膜前滞留数据AUC0-6h、Cmax和MRT较市售DEXP滴眼液分别增加8.35、2.87和2.58倍。对兔单次滴眼给予CMCS-GS-DEXP-LDH 3 h后,仍能在其视网膜和脉络膜组织中检测到120.04 ng · g-1的药物,荧光成像和组织分布结果表明结膜-巩膜途径是CMCG-GSDEXP-LDH在眼内的转运途径[45]。研究表明,有机-无机杂化LDH纳米粒是有前景的眼表向眼内高效递送药物的纳米复合物。
3.7 脂质体
脂质体是脂质分散在水性介质中自组装形成的囊泡,可包封亲水性和亲脂性药物,通过融合、吸附、内吞和脂质交换等机制促进药物的吸收。脂质体的外表面修饰聚合物材料可增加制剂的黏膜黏附性和在眼组织中的渗透性,在外表面引入PEG化单元是常见的修饰,修饰后的脂质体有更强的眼表渗透性、更高的生物利用度和更低的眼毒性。Zorzi等[46]研制了修饰PEG的脂质体囊泡,用其装载siRNA以治疗眼角膜炎,此脂质体复合物与洗必泰的组合疗法在小鼠模型中可使角膜损伤减少60%。阳离子脂质体药物载体也被用于眼部药物的递送。其通过与负电荷相互作用,从而延长药物在眼表的滞留时间和渗透性,提高药物的眼部生物利用度。阴离子脂质体则可增加眼表黏附性,增强载体系统穿透角膜屏障的能力,还可克服眼后段玻璃体等眼部屏障,提高药物向眼后段递送的效率。Davis等[47]构建了蛋白annexin A5修饰的阴离子脂质体以递送贝伐单抗,用于治疗AMD。相比市售制剂Avastin®,annexin A5修饰的阴离子脂质体在大鼠眼后房和兔视网膜/脉络膜中获得显著更高的贝伐单抗浓度,研究还显示该脂质体可克服角膜屏障,增加药物向眼后段的递送。经眼表向眼前段和眼后段递送药物时,脂质体因其良好的生物相容性成为极具潜力的递送系统。
3.8 脂质纳米颗粒
固体脂质纳米粒(SLN)、纳米结构脂质载体(NLC)和杂化脂质纳米颗粒是研究中经常使用的3种脂质纳米颗粒。脂质纳米颗粒的脂质成分,与泪膜的脂质成分相似,可增加载体在结膜囊中的滞留时间;与细胞膜的脂质成分相似,可增加药物的眼表渗透性和眼部生物利用度,并为亲水性和亲脂性药物提供可控的药物释放。Hussein等[48]用壳聚糖(CTS)和PEG涂层修饰的SLN制备了氧氟沙星固体脂质纳米粒,给兔眼局部给药24 h后,相比于市售氧氟沙星滴眼液,氧氟沙星固体脂质纳米粒的角膜渗透率高1.66倍,在房水中的药物浓度高2 ~ 3倍。Yadav等[49]制备的阿托伐他汀(ATS)脂质纳米粒在兔角膜中的渗透率比市售制剂高2.5倍,在房水和玻璃体中的AUC0-50h分别为市售制剂的8和12倍。Platania等[50]将多球壳菌素装载到NLC中,与多球壳菌素的混悬液相比,NLC制剂在家兔和小鼠视网膜中的达峰时间(Tmax)延长3倍,AUC0-240min增加1 000多倍。故SLN和NLC都被认为是向眼内递送药物的良好载体,它们易克服泪膜屏障、角膜屏障和BRB而增加药物在眼表的渗透性和眼内靶部位的生物利用度。与SLN相比,NLC的固体基质中掺入了液体脂质,可增加脂质纳米粒中不规则晶型的比例,使空间容量增加从而增加载药能力,此外控制液体脂质的比例可使NLC在体温下保持固体骨架结构并实现控制释放。Balguri等[51]制备了吲哚美辛的SLN制剂和NLC制剂,SLN制剂表现出更高的角膜渗透性,NLC制剂的载药能力更强并且维持更高的角膜和巩膜药物浓度。总之,SLN和NLC可增加药物与眼睛表面之间的接触时间从而增强眼表渗透性,是具有应用前景的眼部药物递送载体。
3.9 树状聚合物
树状聚合物是球形的树枝状纳米级(3 ~ 20 nm)有机聚合物,药物可通过离子间相互作用、疏水相互作用、氢键、化学键偶联等方式嵌入聚合物网络中。对树状聚合物的外围官能团进行表面修饰可有效延长药物在眼表的滞留时间和增加药物在眼表的渗透性。研究表明,树状大分子与眼部黏蛋白发生显著的相互作用利于药物克服黏液屏障并向眼后段递送。聚酰胺-胺型树状高分子(PAMAM)是水溶性且无免疫原性的材料,是树状聚合物中研究最广泛的材料之一,用PEG修饰PAMAM,可增加其生物相容性。PAMAM树状大分子与角膜上皮细胞外膜的脂质双层的结合使角膜上皮细胞间的连接疏松,有利于药物从PAMAM树状大分子中释放并通过旁细胞途径转运到角膜,克服角膜屏障并增加角膜渗透性,从而提高药物的眼部生物利用度。Bravo-Osuna等[52]制备了阿昔洛韦的碳硅烷树状大分子,发现其与眼黏蛋白之间的永久性相互作用使阿昔洛韦的降眼压效果显著提高。Yang等[53]构建了环状精氨酸-甘氨酸-天冬氨酸六肽和细胞穿透肽共修饰的PEG化PAMAM纳米载体(NC),将其用于脉络膜新生血管的治疗,结果显示,与未经修饰的树状聚合物相比,NC体外角膜渗透性提高1.5倍,在角膜和视网膜分布浓度更高,且延长药物在视网膜的滞留时间至12 h以上。树状聚合物可克服角膜、结膜和黏液等眼部给药屏障,有望成为治疗眼前段和眼后段疾病的一种眼部药物递送系统。
3.10 前药
在过去的几十年中,化学方法的前药策略已被用于赋予原型药物新颖的理化特性,以改善药物在眼部的生物利用度。Barot等[54]介绍了眼部前药设计中的化学修饰,包括形成酯、氨基甲酸酯、磷酸盐和肟,这种修饰使药物成为具有合适理化性质的前药,前药在眼内降解转化为活性原型药物。拉坦前列素、甲基强的松龙、地塞米松的琥珀酸酯或磷酸酯是典型的经化学策略制备的眼用前药。Vyzulta®是Bausch Health公司研制的拉坦前列素硝酸酯滴眼液,2017年11月2日获FDA批准上市,用于治疗开角型青光眼或高眼压。前药与其他新型眼部药物递送系统相结合可提高药物的眼部生物利用度。Zhang等[55]制备了琥珀酸地塞米松(Dex-SA)前药超分子水凝胶,对兔眼单次局部给予该制剂后,房水中的药物浓度显著高于地塞米松磷酸钠水溶液组(Dexp),AUC0-6h是Dexp组的5.6倍。Dex-SA超分子水凝胶的黏度大,可延长药物在角膜的滞留时间。Mandal等[56]等开发了环西多福韦生物素化脂质前药的靶向聚合物前药系统,其可自组装形成稳定的纳米胶束,并在生物素的作用下绕过外排转运蛋白将药物靶向至视网膜。研制前药以及将前药与新型制剂手段相结合,改善了药物的理化性质,使药物在眼部的渗透性增强,并在眼前段和眼后段靶部位维持较长时间的活性药物浓度。前药在克服眼部角膜屏障、向眼前段递药方面具有优势,在向眼后段递送药物方面也具有一定的潜力。
4 临床研究中的眼表局部给药新制剂
以上综述了目前在研的新型眼部药物递送系统,笔者所在课题组近期还综述了市售的眼用新剂型[57]。本节通过ClinicalTrials.gov网站和Pharmaprojects数据库检索了新型眼表局部给药系统的临床研究进展(见表3),结果显示进入临床研究阶段的剂型主要为凝胶和乳剂,而纳米粒、胶束、混悬液和环糊精聚集体较少。除地塞米松的环糊精聚集体混悬滴眼液用于治疗眼后段疾病(糖尿病性黄斑水肿)外,其他制剂的适应证均为眼前段疾病。
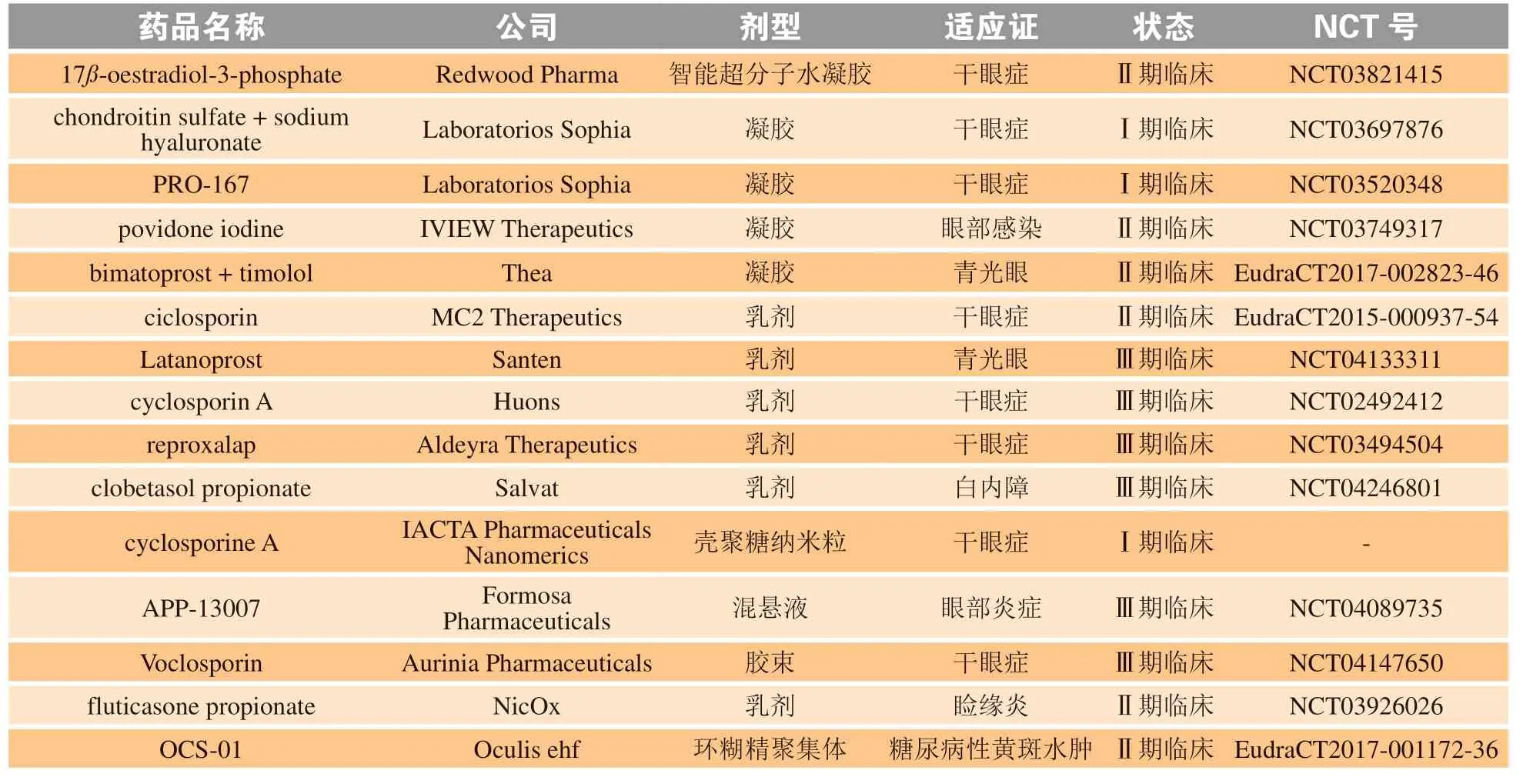
表 3 新型眼表局部给药系统的临床研究Table 3 The clinical research on new topical ocular drug delivery system
5 结语与展望
眼作为一种精密复杂的器官存在诸多屏障,防止异物进入眼内以保持视觉正常,但这些屏障使向病变的眼组织递送药物存在困难。眼表局部给药生物利用度低,玻璃体内注射不良反应多。基于纳米制剂的新型眼部药物递送系统使经眼表局部给药将药物有效递送至眼组织内成为可能。理想的眼表局部药物递送系统需关注以下3个关键点:1)延长药物的眼表滞留时间;2)克服多种眼部给药屏障,增强药物的多组织深层渗透;3)较长时间内,药物在靶组织中的浓度可维持在有效治疗浓度以上。眼表局部给药向眼内递送药物时面临的眼部给药屏障主要为角膜屏障、BAB和BRB。结合文献研究和临床研究最新进展,笔者发现凝胶、乳剂、胶束和前药是经眼表局部给药向眼前段递送药物的有效方法,目前均有相关制剂上市,它们常用于治疗眼前段疾病如干眼症、青光眼和结膜炎等。文献研究中的上述递送系统均可被设计为从眼表将药物向眼前段和眼后段递送的系统,但目前除地塞米松的环糊精聚集体外,尚无向眼后段递送的制剂成功进入临床试验阶段,提示从眼表高效递送药物到眼后段仍面临巨大挑战。基于纳米制剂的新型眼部药物递送系统可延长药物的眼表滞留时间、增强药物的多组织渗透性并显著提高药物在眼内靶部位的生物利用度,故在药物从眼表向眼后段的递送中显示出良好的应用前景,具备进一步临床开发的潜力。
