甲巯咪唑诱导自身免疫样药物性肝损伤1例报告
2022-01-05崔仕元郑美芳王珊珊高润平
崔仕元, 郑美芳, 张 玮, 王珊珊, 高润平
吉林大学第一医院 肝胆胰内科, 长春 130021
Graves病(Graves disease, GD)肝功能异常包括甲状腺素过多直接引起的肝损伤、抗甲状腺药物诱导的肝损伤以及同时存在肝脏疾病[1-3]。甲巯咪唑(methimazole, MMI)少见引起肝损伤和肝内胆汁淤积,其发病机制可能与过敏有关[4],近年有报道[5]MMI可诱导自身免疫性疾病包括抗中性粒细胞胞浆抗体阳性关节炎和胰岛素自身免疫综合征。曾有报道[6]糖皮质激素成功治疗MMI停药后或MMI治疗期间熊去氧胆酸(ursodesoxycholic acid, UDCA)治疗2周胆汁淤积仍进行性加重的病例。本中心诊治了1例在GD合并慢性乙型肝炎(CHB)基础上出现MMI诱导自身免疫样药物性肝损伤(autoimmune-like drug induced liver injury, AI-DILI)的患者,现报道如下。
1 病例资料
患者男性,35岁。因“腹泻、乏力2年,目黄10 d”于2020年9月27日入本院。患者入院前2年无明显诱因出现乏力、排稀便,当地诊断为GD。1年前自觉症状略加重服用MMI,30 mg/d,持续1个月,隔日服药,持续2个月,GD症状略有缓解,出现厌食停药。入院前1个月患者自觉乏力,排稀便。20 d前自服MMI 30 mg/d,服用6 d后因厌食停用,10 d前出现目黄、尿黄,1周前当地医院化验血清HBsAg阳性,肝功能:AST 722.3 U/L,ALT 818.4 U/L,ALP 192U/L, TBil 447.7 μmol/L,DBil 349.5 μmol/L。既往无高血压病和心脏病史,无烟酒嗜好,未检HBV血清学标志物。查体:体温36.5 ℃,脉搏100次/min,血压135/78 mmHg。全身皮肤、巩膜重度黄染,未见肝掌及蜘蛛痣。心率100次/min,心音正常。腹软,肝脾肋下未触及,移动性浊音阴性。双下肢轻度浮肿。入院辅助检查: WBC 4.86 × 109/L , Hb 96 g/L, PLT 89×109/L。肝功能:AST 133.9 U/L,ALT 137.7 U/L,ALP 149.3 U/L,ChE 2676 U/L,Alb 30.4 g/L,TBil 831.9 μmol/L,DBil 554.6 μmol/L,总胆汁酸(TBA) 493.5 μmol/L。空腹血糖2.8 mmol/L。凝血功能:INR 1.51,PTA 38%。甲状腺功能:血清促甲状腺激素<0.0025 μIU/mL,血清游离三碘甲腺原氨酸(FT3)>30.7 pmol/L,血清游离甲状腺素(FT4)>64.3 pmol/L,抗甲状腺球蛋白抗体阳性。HBsAg、HBeAg和抗-HBc均阳性,HBV DNA载量3.28×104IU/mL, 抗-HAV IgM、抗-HEV IgM和抗-HCV IgG均阴性。EB病毒、巨细胞病毒核酸定量阴性,铜蓝蛋白正常,抗核抗体(ANA)均质型 1∶320,IgG 22.17 g/L[正常值上限(ULN)<17.4 g/L]。CT示:肝形态正常,脾大。甲状腺彩超示:甲状腺体积增大、伴实质弥漫性声像改变。甲状腺摄碘率:2 h 37.9%;4 h 43.6%;24 h 41.3%,提示甲状腺摄碘率增高。超声心动图未见异常。
入院初步诊断:GD合并CHB和MMI诱导药物性肝损伤,慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)早期,遂予恩替卡韦抑制HBV复制,乙酰半胱氨酸和丁二磺酸腺苷蛋氨酸保肝,患者进食正常,反复出现低血糖,每日静脉补充葡萄糖250 g,氨基酸50 g持续治疗20 d。患者于住院第2、5、8和12天行4次人工肝治疗,模式为双重血浆分子吸附系统(dual plasma molecular adsorption system, DPMAS)联合足量血浆置换(plasma exchange, PE),血清胆红素明显下降(图1)。患者于住院第10天行131I治疗,血清FT3、FT4逐渐下降,PTA渐趋改善。因血清TBil控制不理想,住院第18天行第5次DPMAS联合PE治疗,住院第19天复查肝功能: ALT 72.2 U/L,TBil 289.9 μmol/L,TBA 226.4 μmol/L,开始给予UDCA,750 mg/d,口服,次日ALT、TBil和TBA进行性增高,住院第24天患者自觉搔痒,睡眠不佳,烦躁,复查肝功能:ALT 96.2 U/L,TBil 440.1 μmol/L,TBA 491.8 μmol/L,PTA 67%,HBV DNA 87 IU/mL,FT3 7.1 pmol/L,遂加用苯巴比妥钠50 mg,每晚睡前1次,肌肉注射,醋酸泼尼松30 mg,1次/d,口服,7 d后患者ALT、TBil和TBA明显下降,瘙痒及失眠症状好转,遂停用糖皮质激素。3 d后复查ALT、TBil和TBA呈现反弹,继续服用醋酸泼尼松30 mg/d,1周后搔痒消失,睡眠正常,遂停用苯巴比妥钠,醋酸泼尼松减量至25 mg/d,继续用药,患者病情逐步好转。住院第43天行肝穿刺组织学检查示:Masson三色加网状纤维染色显示部分临近汇管区相连分隔周围肝实质、间质轻度纤维化,HE染色显示汇管区可见中度淋巴细胞和浆细胞为主的炎细胞浸润,明显的界面炎,玫瑰花样肝细胞易见(图2),汇管区周围细胆管增生明显,肝细胞可见胆色素颗粒,多处见毛细胆管胆栓;HBsAg在肝细胞膜大量表达。病理结果提示CHB (G3S3),AI-DILI。基于患者RUCAM积分7分,简化的IAIHG评分为6分(AIH可能),临床上考虑患者是在GD高代谢引起营养不良合并CHB基础上出现了MMI诱导AI-DILI。患者住院第47天,自觉食欲改善。查体脉搏和血压正常,皮肤巩膜轻度黄染。复查肝功能:AST 50.3 U/L,ALT 69.1 U/L,Alb 30.0 g/L,TBil 104.7 μmol/L,TBA 107.7 μmol/L。凝血功能检查正常。甲状腺功能:FT3 5.81 pmol/L。HBV DNA 55 IU/mL。患者遂出院继续用药:恩替卡韦、醋酸泼尼松片(25 mg/d,1周; 20 mg/d,2周; 15 mg/d,3周)、丁二磺酸腺苷蛋氨酸片和UDCA。出院后第45天复查肝功能:TBil 61.1 μmol/L,TBA 41.3 μmol/L。在抗HBV治疗同时,醋酸泼尼松(10 mg/d)和UDCA继续巩固治疗1个月,复查肝功能正常,HBV DNA 9.8 IU/ml,IgG和ANA正常。遂停用糖皮质激素和UDCA。继续随访3个月,未见复发。

图1 患者住院期间治疗措施及重要指标变化趋势
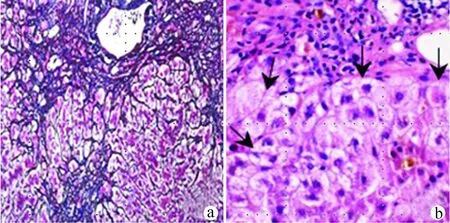
注:a.部分临近汇管区相连分隔周围肝实质,间质轻度纤维化(网织+Masson染色);b.汇管区可见淋巴浆细胞浸润,明显界面炎,可见玫瑰花样肝细胞(箭头),部分肝细胞可见胆色素颗粒和毛细胆管胆栓(HE染色)。
2 讨论
CHB是由HBV持续感染引起的肝脏慢性炎症性疾病,其主要病理特征为肝细胞碎屑样和/或桥状坏死,炎症细胞浸润和纤维化形成。CHB可以隐匿发病,通过检查才被发现。CHB急性加重是细胞毒性T淋巴细胞介导的表达HBV抗原肝细胞的免疫溶解,临床上出现HBV DNA骤然上升伴随肝细胞功能受损(ALT > 5×ULN或>既往曾经出现较高水平的3倍),临床多数表现为肝功能代偿,也有表现肝功能失代偿,甚至死亡[7]。CHB急性加重引起ACLF通常肝脏呈现大块或亚大块坏死的组织病理学特征,其临床表现符合亚太肝病学会[8]对ACLF的定义,即在先前诊断或未诊断的慢性肝脏疾病的基础上,出现黄疸和凝血功能障碍(INR>1.5)等急性肝损伤表现,4周内出现腹水和/或脑病。本例患者既往从未行HBV检测,本次发病发现脾大,PLT 89×109/L, ALT >5×ULN (入院前1周),Alb 30.4 g/L,TBil 831.9 μmol/L,HBeAg阳性,HBV DNA 3.28×104IU/mL, 病程中存在一过性凝血机能障碍,未出现腹水和肝性脑病,肝活体组织病理学呈现 (G3S3)含有桥状坏死,可见大量肝细胞表达HBsAg,符合CHB,未见大块或亚大块肝坏死,故该患者可确诊CHB。此外,患者TBil和TBA严重升高,肝活检病理学显示汇管区周围细胆管增生的胆管反应,伴毛细胆管胆栓和肝细胞色素沉积加上玫瑰花样肝细胞,中度界面炎和淋巴浆细胞浸润也不符合CHB急性加剧的临床与病理特点。因此认为,该患者出现ACLF除CHB还存在着其他原因所致肝损伤的叠加因素。
目前普遍认为部分甲亢患者由于能量代谢亢进,引起肝缺氧和营养不良,过多的甲状腺素增加肝代谢负担,影响肝脏各种代谢酶活性,致抗氧化作用降低,毒性产物代谢障碍,但甲亢本身引起肝损伤通常发生在失代偿的甲亢患者[3]。本例患者入院时进食量正常,然而反复出现低血糖,考虑存在GD高代谢引起的营养不良。近年来MMI引起肝毒性和胆汁淤积屡有报道[9]。MMI可能通过如下环节引起肝毒性和胆汁淤积:(1)门静脉系统相对缺氧致肝细胞变性和坏死;(2)MMI可加重胆汁代谢异常个体的症状,如Gilbert综合征;(3)MMI代谢过程产生活性物质损伤肝细胞和基质;(4)多数认为可能与过敏反应有关[10]。已有报道[11],尽管无肝组织学证据,糖皮质激素能够成功治疗保肝药物或UDCA难以控制的MMI引起的胆汁淤积症。本例患者1年前曾服用MMI治疗甲亢,本次入院前再次服用MMI,1周后出现黄疸,以转氨酶明显升高和严重的胆汁淤积症为主要表现,在131I和恩替卡韦有效控制甲亢和HBV复制的情况下,常规保肝及UDCA治疗仍难以控制,糖皮质激素治疗后症状明显好转, 转氨酶和胆红素显著下降。患者RUCAM积分7分[12],此外,患者血清ANA和IgG升高,肝组织病理学具有典型的AIH样特征(玫瑰花样肝细胞,中度界面炎和淋巴浆细胞浸润),简化的IAIHG评分[13]6分,患者对糖皮质激素治疗初期呈依赖性,继续用药应答良好,持续用药3个月停药不复发,随访3个月IgG和ANA恢复正常,因此该患者符合MMI相关AI-DILI诊断。
AI-DILI的发生机制至今仍尚未完全阐明。目前普遍认为药物活性代谢产物与肝细胞膜蛋白共价结合形成新抗原,活化具有非选择抗原受体CD8+T淋巴细胞,加上机体短暂的免疫调节缺陷使自身免疫耐受暂时丧失,进而引起短时间肝细胞损伤[14]。已有米诺环素、非诺贝特、甲基多巴、他汀类药物相关的AI-DILI报道[15],基于该患者的临床表现和肝组织病理学特征笔者认为MMI作为新被认知的药物可引起AI-DILI。
综上所述,该患者符合GD合并CHB基础上出现MMI相关AI-DILI,而GD高代谢引起营养不良、CHB以及MMI相关AI-DILI共同导致ACLF的早期临床表现。入院后立即实施基础治疗包括恩替卡韦抑制HBV复制,补充足量葡萄糖和氨基酸以阻断甲亢高代谢所致营养不良以及常规保肝药物和血浆支持治疗是合理的。患者甲亢合并肝衰竭,应立即停用抗甲状腺药物,且不宜行甲状腺次全切除术,因此放射性131I治疗成为该患者甲亢治疗的最佳选择[16]。131I治疗短期内可以使甲状腺腺泡细胞损伤和甲状腺素释放增加,有诱发肝衰竭加重的风险,因此,该疗法在患者住院初期难以实施。
DPMAS能特异性清除机体过多的胆红素,消除部分炎症介质,PE能清除肝衰竭毒素,补充生物活性物质(白蛋白,凝血因子)。因此,该患者入院后18 d内接受5次DPMAS联合PE治疗,有效降低了血清TBil,改善了凝血状态和患者一般状况,为患者住院第10天接受131I治疗创造了前期条件和后期安全保障。伴随HBV DNA的有效抑制,131I治疗1周后甲状腺素接近正常水平,凝血功能改善,患者血清TBil和TBA在人工肝停止后仍难以控制,ALT仍然呈高水平。
苯巴比妥类药物是临床常用镇静催眠药物,同时能诱导肝微粒体葡萄糖醛酸转移酶活性,促进胆红素与葡萄糖醛酸结合,降低胆红素浓度,但该患者使用苯巴比妥钠除发挥镇静作用外,在消退黄疸方面作用有限。糖皮质激素在治疗难以控制的AI-DILI或者特发性AIH均为一线选择药物。糖皮质激素治疗AI-DILI具有疗程短,停药后不复发的优点[17]。本例患者MMI诱导的AI-DILI对醋酸泼尼松治疗应答良好,疗程3个月肝功转氨酶和胆红素完全恢复正常,且停药后不复发。
笔者团队成功诊治1例在GD合并CHB基础上出现MMI相关AI-DILI的患者,该患者入院后有ACLF的早期表现,病情危重、复杂,治疗难度大,值得借鉴。笔者认为:甲亢高代谢的营养不良和CHB重叠MMI诱导AI-DILI共同引起ACLF的发生。131I治疗是控制该患者甲亢的唯一选择,DPMAS联合PE在缓解ACLF和为131I治疗创造条件和安全保障具有不可替代的作用。在甲亢和HBV复制得到有效控制,ALT和胆红素居高不下时,要考虑MMI诱导AI-DILI的可能,肝活检组织病理学检查有助于AI-DILI确诊及其与原有肝脏疾病和DILI的鉴别。糖皮质激素在MMI诱导的AI-DILI的治疗中可以发挥重要作用。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:崔仕元、郑美芳负责资料分析,撰写论文;张玮、王珊珊参与收集数据;高润平负责拟定写作思路,指导撰写文章并最后定稿。
