不同干燥方式燕麦蛋白的性质及对肌原纤维蛋白凝胶特性的影响
2021-12-31卢亚东张成楠李秀婷陈振家张治华牛晓峰
卢亚东, 张成楠, 李秀婷, 陈振家, 王 愈,*, 张治华, 牛晓峰
(1.山西农业大学 食品科学与工程学院, 山西 太谷 030801;2.北京工商大学 食品与健康学院, 北京 100048;3.太原六味斋实业有限公司, 山西 太谷 030801)
植物蛋白(如大豆蛋白)等被广泛用作肉制品中的辅料,从而改善肉制品的营养和功能特性[1]。相较于其他植物来源的蛋白质,燕麦蛋白具有较高的消化率、净利用率和生物学价值,其蛋白质功效比值与酪蛋白相当[2];燕麦蛋白含有人体所需的8种必需氨基酸,其必需氨基酸含量在总氨基酸含量中的占比接近WHO/FAO的推荐值,是一种全价蛋白质[3];燕麦蛋白不含麸质,特别适合于乳糜泻与麸质过敏患者食用[2]。尽管燕麦蛋白具有诸多优点,但是目前在肉食品工业中燕麦蛋白的应用仍然较少,原因在于人们对其功能和性质了解还不够透彻;因此明晰燕麦蛋白的功能和性质是其广泛应用于肉食品工业的前提和基础[4]。
在肉制品加工中,粉状物料是常用的形式。制备蛋白质粉有多种干燥方法,包括喷雾干燥、冷冻干燥、真空干燥和微波干燥等。不同的干燥方法对蛋白质的功能特性具有显著影响,这主要由于干燥过程中蛋白质的分子结构发生了改变[5]。目前,不同干燥方法对大豆蛋白等其他蛋白质的结构和功能特性的影响已有研究:Hafez 等[6]发现微波加热可使大豆蛋白的溶解性显著下降,而熊犍等[7]的研究结果表明,大豆蛋白的溶解性随着微波功率和处理时间的增加呈现先提高后下降的趋势;时文芳等[8]比较了冷冻干燥和喷雾干燥对莲子蛋白结构及其功能特性的影响,发现喷雾干燥制备的莲子蛋白的持水性和起泡性均优于冷冻干燥制备的莲子蛋白,然而相较于冷冻干燥,喷雾干燥的莲子蛋白的乳化特性、溶解性、持油性等均有降低。尽管研究已表明,热处理对燕麦蛋白的结构性质具有显著影响[9-11],然而不同干燥方法处理的燕麦蛋白的结构及性质差异仍鲜有报道,不同干燥方法处理的燕麦蛋白对肉食品的质构影响仍不十分清楚。
肌原纤维蛋白(myofibrillar protein, MP)是肉中具有重要生物学功能的蛋白质,具备很强的凝胶能力,在加热条件下,蛋白质量分数不到1%时就可形成网状的凝胶结构[12]。在肉类凝胶制品中,MP对凝胶的形成和水的结合能力起着重要作用,特别对乳化型肉制品的质构有重要的影响。本研究拟对碱溶酸沉法提取的燕麦蛋白(oat protein extract, OPE)进行喷雾干燥、冷冻干燥、真空干燥和微波干燥处理,分析不同干燥方法对燕麦蛋白的结构和性质的影响;将不同干燥方法处理的OPE与MP按一定比例混合,考察混合凝胶的流变特性、持水能力及微观结构等,研究其对蛋白凝胶特性的影响,希望为谷物- 肉类复合凝胶的制备和肉食品品种的开发提供参考,也为功能性肉制品的研究提供一些理论基础。
1 材料与方法
1.1 材料与试剂
燕麦(坝莜一号),购买于山西省农业科学院。鸡胸肉购买于北京市永辉超市,置于-20 ℃冰箱保存。
氯化钠、氯化镁、乙二胺四乙酸二钠、磷酸二氢钠、磷酸氢二钠、2,4,6-三硝基苯磺酸(TNBS)、四硼酸钠、十二烷基硫酸钠(SDS)、L-亮氨酸、邻苯二甲醛、丝氨酸、β-巯基乙醇、乙酸、乙醇、考马斯亮蓝(G- 250)、甘氨酸等,均为分析纯,购自北京索莱宝科技有限公司。
1.2 主要仪器与设备
T18数显型高剪切分散乳化机,德国IKA公司;Himac CR22N型高速冷冻离心机,日本Hitachi公司;F- 7100型荧光分光光度计,日本Hitachi公司;Nicolet iS50型傅里叶变换红外光谱仪,美国Thermo公司;Varioskan LUX型酶标仪,美国Thermo公司;Discovery 混合型动态流变仪,美国TA公司;TMS- Pro型质构仪,美国FTC公司;SU3800型扫描电子显微镜,日本Hitachi公司;GPW120- Ⅱ型微型喷雾干燥机,山东天力干燥设备有限公司;FDU- 2110型冷冻干燥机,杭州嘉维创新科技有限公司;YZG/FZG型系列真空干燥机,常州市邦达干燥设备有限公司;QX- 60HM9型微波干燥机,东莞齐协微波设备有限公司。
1.3 实验方法
1.3.1燕麦蛋白的提取及干燥
将脱脂燕麦粉溶解在pH值为10的稀碱溶液中,50 ℃下恒温搅拌2 h,4 000 r/min离心15 min,除去不溶物,随后将pH值调至5.5,静置2 h,离心收集沉淀,获得燕麦蛋白提取物。使用凯氏定氮法分析燕麦蛋白提取物,蛋白质量分数为65.32%。
不同干燥方法处理燕麦蛋白:喷雾干燥处理燕麦蛋白(OPE1),采用离心式雾化器,雾化盘直径18 mm,转速18 000 r/min,进风温度140 ℃;冷冻干燥处理燕麦蛋白(OPE2),温度-40 ℃,真空度50 Pa;真空干燥处理燕麦蛋白(OPE3),真空度30 Pa,温度40 ℃;微波干燥处理燕麦蛋白(OPE4),功率1 500 W,微波干燥终结时蛋白样品温度65 ℃。
1.3.2不同干燥方法处理的燕麦蛋白结构和性质分析
1.3.2.1 十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳分析
十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS- PAGE)分析参考徐婧婷等[13]的方法。将不同干燥方法处理的燕麦蛋白溶解于0.6 mol/L的NaCl溶液中,蛋白质质量浓度为2 mg/mL。移取10 μL上清液与一定量的上样缓冲液(β-巯基乙醇1.0 mL,SDS 0.4 g,甘油2.0 mL,1.0 mL质量分数为0.1%的溴酚蓝)混匀,将还原后的样品上样至预制聚丙烯酰胺凝胶,浓缩胶和分离胶分别在80 V和100 V下进行电泳。使用考马斯亮蓝R250对凝胶进行染色,采用凝胶成像分析系统对凝胶进行拍照。
1.3.2.2 羰基含量的测定
参考徐红艳等[14]的方法。使用0.1 mol/L NaCl溶液配制5 mg/mL不同干燥方法处理的燕麦蛋白溶液,添加2 mL体积分数为0.2%的2,4-二硝基苯肼(DNPH)溶液,室温下避光反应1 h。随后加入2 mL 20%的三氯乙酸沉淀蛋白。待沉淀蛋白中试剂挥发完后,添加3 mL 6 mol/L的盐酸胍溶液,37 ℃水浴保温30 min溶解沉淀,在370 nm处测定上清液吸光度,羰基的浓度以摩尔消化系数22 000 L/(mol·cm)计算,结果表示为单位质量可溶性蛋白中含有的羰基,μmol。
1.3.2.3 游离氨基含量的测定
使用甲醇配制0.4 g/mL的邻苯二甲醛溶液,随后依次向溶液中加入2.5 mL 200 g/L的SDS溶液、25 mL 0.1 mol/L的硼酸溶液及100 μL的β-巯基乙醇,混合均匀,用蒸馏水定容至50 mL,制备成测试溶液用于后续检测分析。量取4 mL测试试剂与200 μL不同干燥方法处理的燕麦蛋白样液充分混匀,在35 ℃下水浴处理2 min,在340 nm处测定吸光值。
1.3.2.4 红外光谱分析
红外光谱分析条件:波长范围为400~4 000 cm-1,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数64次,温度25 ℃。对酰胺Ⅰ带(1 600~1 700 cm-1)的光谱进行基线校正、平滑和去卷积处理,并使用高斯曲线拟合来获得凝胶样品的二级结构含量,其中在1 646~1 664 cm-1为α-螺旋,在1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠,在1 664~1 681 cm-1为β-转角,在1 637~1 645 cm-1为无规则卷曲。
1.3.2.5 荧光光谱分析
将OPE溶液稀释至0.5 mg/mL,使用荧光分光光度计在激发波长290 nm处测定OPE溶液在300~400 nm的荧光发射光谱[15]。
1.3.2.6 表面疏水性的测定
用溴酚蓝法测定表面疏水性。配置不同干燥方式的燕麦蛋白悬浊液各1 mL,加入200 μL 1 mg/mL溴酚蓝溶液在室温下混合2 h。6 000 r/min离心15 min,收集上清液,在595 nm下测定吸光度,计算蛋白质的结合量。
1.3.2.7 蛋白溶解度的测定
参考Li等[16]的方法并稍作改动。配制质量分数为1%的燕麦分离蛋白溶液,搅拌0.5 h,随后加入一定量的0.6 mol/L的NaCl溶液,搅拌15 min,10 000 r/min离心10 min,用考马斯亮蓝法测定上清液蛋白质含量。
1.3.3肌原纤维蛋白的提取
参考Wijaya等[17]的方法提取MP并适当修改。将鸡胸肉解冻后切成肉粒,添加4 ℃下预冷的4倍体积的0.01 mol/L提取液 (0.1 mol/L NaCl,0.002 mol/L MgCl2,0.001 mol/L EDTA,pH值为7.0),高速匀浆60 s。在4 ℃下7 000 r/min离心20 min,收集沉淀部分。按前述步骤重复提取3 次。将收集的沉淀与4 ℃下预冷的4 倍体积的0.1 mol/L NaCl溶液混合,高速匀浆60 s,7 000 r/min离心20 min,移除上清液,沉淀部分洗脱3次,所得沉淀即为MP。MP中的蛋白含量使用双缩脲方法测定。
1.3.4凝胶的制备
将MP与不同干燥方法处理的OPE以质量比为1∶1的比例混合,溶解于0.6 mol/L NaCl溶液中,蛋白总质量浓度为40 mg/mL。使用高剪切分散乳化机在8 000 r/min均质1 min。混合蛋白溶液以1 ℃/min的升温速率从25 ℃升至80 ℃,随后在80 ℃下保持10 min,取出后迅速置于冰水中冷却,4 ℃下过夜保存。
1.3.5凝胶性质分析
1.3.5.1 凝胶流变学性质分析
参考Lin等[18]的方法,使用动态流变仪分析凝胶的流变学性质。采用40 mm平板夹具,乳液或凝胶加载于平行板间,狭缝初始距离设置为1 mm。温度扫描参数:频率设置为0.1 rad/s, 应变设置为0.5%,温度范围为20~80 ℃,记录储能模量(G′)。角频率扫描参数:温度设置为25 ℃,应变设置为0.5%,频率为0.1~100.0 rad/s,记录储能模量(G′)和损耗模量(G″)。
1.3.5.2 凝胶持水力分析
准确称取3 g凝胶,在4 ℃下5 280 r/min离心15 min。持水力表示为离心后的凝胶质量占离心前凝胶质量的百分比。
1.3.5.3 凝胶微观结构的分析
参考周扬等[19]方法,凝胶样品使用质量分数为3%的戊二醛溶液固定24 h,随后依次在50%、70%、80%、90%和100%的乙醇溶液中浸泡30 min进行脱水,冷冻干燥后对样品进行喷金溅射,使用扫描电子显微镜观察凝胶的微观结构。
1.4 数据处理
所有实验均重复3次,使用Origin Pro 9软件进行单因素方差分析(one-way ANOVA)和最小显著性差异法分析(least significant difference,LSD),P<0.05表示差异显著。
2 结果与分析
2.1 不同干燥方法处理对燕麦蛋白结构及性质的影响
2.1.1SDS-PAGE分析结果
燕麦蛋白主要由球蛋白(质量分数为50%~80%)、醇溶蛋白(质量分数为4%~15%)、白蛋白(质量分数为1%~12%)和谷蛋白(质量分数小于10%)组成[2]。燕麦球蛋白根据沉降系数可以分成12S球蛋白、7S球蛋白和3S球蛋白,其中12S球蛋白主要呈现六聚体形态,由多个54~60 kDa的亚基通过非共价键聚集而成,亚基由32~35 kDa的酸性肽链和19~22 kDa的碱性肽链通过二硫键连接而成[20]。4种干燥方法处理的燕麦蛋白的SDS- PAGE分析结果如图1。OPE1、OPE2、OPE3、OPE4均在25~35 kDa和17~25 kDa处有两条比较明显的条带,这与徐悦等[21]和Runyon等[22]报道的燕麦12S球蛋白的亚基分子质量大致相同。OPE2和OPE4在63~75 kDa和48~63 kDa处存在3条明显的条带,其可能主要来源于7S球蛋白[21]。相较于OPE2和OPE4,OPE1和OPE3在63~75 kDa和48~63 kDa处条带的强度显著减弱,这与王婧[10]的研究结果一致。研究表明,燕麦球蛋白对温度敏感,热处理可能导致其亚基在盐溶液中发生聚集和降解,造成SDS- PAGE图谱的差异[23]。本研究表明,相较于冷冻和微波干燥,喷雾和真空干燥处理对燕麦蛋白的结构影响较大。

M:蛋白质分子质量标准Marker。
2.1.2氨基和羰基含量分析结果
燕麦蛋白含有丰富的赖氨酸和谷氨酰胺[2,24]。4种干燥方法处理燕麦蛋白的氨基和羰基含量变化情况如图2。由图2(a)可知,相较于OPE2和OPE4,OPE1和OPE3的氨基含量显著升高。这可能是由于喷雾和热风干燥处理造成燕麦蛋白变性伸展,游离氨基暴露和含量增多[21]。羰基(醛基和酮基)含量是评价蛋白质氧化损伤的指标之一[25-26]。由图2(b)可知,经过喷雾干燥处理后的燕麦蛋白羰基含量显著提高,而冷冻干燥处理的燕麦蛋白的羰基含量最低,表明在喷雾干燥过程中燕麦蛋白的氧化损伤最大,而冷冻干燥最小。本研究结果表明,不同干燥方式对燕麦蛋白的影响不同,喷雾干燥对燕麦蛋白结构的影响较大。

不同小写字母表示组间差异显著(P<0.05)。
2.1.3蛋白质二级结构分析结果


图(b)中β-折叠含量与无规则卷曲含量具有差异,但因图大小的原因,差异不明显,故将这两个结构单独分析,即图(c)和(d)。不同小写字母表示组间差异显著(P<0.05)。
2.1.4荧光光谱分析结果
蛋白质的内源荧光主要来源于芳香族氨基酸残基如色氨酸等,蛋白质内源性荧光强度和发射波长与蛋白质构象变化密切相关[30]。不同干燥方法处理的燕麦蛋白荧光光谱分析结果见图4。从图4可以看出,4种干燥方法处理的燕麦蛋白的最大荧光波长具有一定差异,OPE1和OPE3在348 nm处,而OPE2和OPE4在346 nm处,荧光强度也存在不同。李健[31]发现,燕麦球蛋白的最大发射波长在330 nm附近,超声处理未改变其最大发射波长;王婧[10]发现,不同来源的燕麦球蛋白的最大荧光波长略有不同,分布在325.0~327.5 nm。本研究中获得的结果与文献报道的研究结果具有一定差异,其原因一方面可能是由于蛋白质的种类不同,另一方面可能是因为不同干燥方法会引起蛋白质结构发生不同程度的改变,芳香族氨基酸残基的位置及所处微环境也随之发生改变,从而引发蛋白质内源性荧光强度和最大荧光波长改变[32]。相较于冷冻和微波干燥,喷雾和真空干燥的最大发射波长出现了红移,这可能是由于喷雾和真空干燥处理对燕麦蛋白的三级结构影响更大。
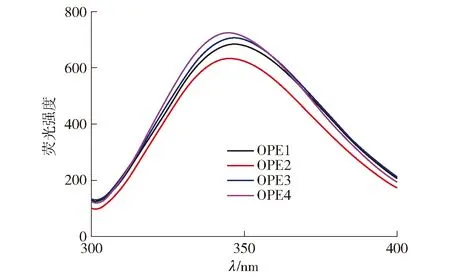
图4 不同干燥方法处理的燕麦蛋白的荧光光谱
2.1.5表面疏水性分析
蛋白质的表面疏水性大小直观地反映了蛋白质疏水基团的暴露程度,表明蛋白质的功能性质与构象变化,是蛋白质变性程度和凝胶性的重要特征[33-34]。不同干燥方法处理的燕麦蛋白表面疏水性分析结果见图5。由图5可知,4种不同干燥方法处理的燕麦蛋白表面疏水性以真空干燥、喷雾干燥、冷冻干燥、微波干燥的顺序逐渐减小。许英一等[11]研究发现,随着热处理温度的升高,燕麦蛋白的表面疏水性逐渐增大,且内源荧光强度与表面疏水性呈正相关。本研究中,喷雾、真空和冷冻干燥处理的燕麦蛋白的内源荧光强度与表面疏水性呈相同的趋势,这与许英一等[11]的研究结果一致。微波干燥处理的燕麦蛋白内源荧光强度较高,但表面疏水性较低,这有待进一步的深入研究。

不同小写字母表示组间差异显著(P<0.05)。
2.1.6溶解度分析
燕麦蛋白主要由盐溶性的球蛋白组成,并且在燕麦蛋白的表面富含谷氨酰胺,这两种因素造成了燕麦蛋白在中性和微酸的条件下溶解性较差[2,24]。不同干燥方法处理的燕麦蛋白溶解度分析结果见图6。从图6中可以看出,在本实验条件下,4种不同干燥方法处理的燕麦蛋白的溶解度均未超过30%。OPE1和OPE4的溶解度显著高于OPE2和OPE3。许英一等[11]研究表明,燕麦蛋白的溶解性随加热温度的升高逐渐升高;王婧[10]研究表明,燕麦蛋白热处理过程中,时间的影响大于温度。喷雾和微波干燥处理过程中的温度高于真空干燥,且处理时间低于真空干燥,这可能是造成真空干燥处理的燕麦蛋白溶解性相比于这两种方法较差的原因之一。冷冻干燥比真空干燥处理的燕麦蛋白的自由氨基含量低[图2(a)],这可能是造成冷冻干燥处理的燕麦蛋白溶解性低的部分原因。本研究表明,4种干燥方法处理的燕麦蛋白均造成了其结构不同程度的改变,影响了其溶解性。

不同小写字母表示组间差异显著(P<0.05)。
2.2 不同干燥方法处理的燕麦蛋白对肌原纤维蛋白凝胶特性的影响
2.2.1温度对混合凝胶储能模量的影响
肌原纤维蛋白的热凝胶过程是不稳定的动态流变过程,在加热条件下肌球蛋白等发生解链、变性和凝聚等构象和性质变化,进而形成蛋白质分子相互交联的三维网状凝胶结构[35]。不同干燥方法处理的燕麦蛋白与肌原纤维蛋白的混合溶胶在热诱导成胶过程中储能模量(G′)的变化如图7。由图7可见,肌原纤维蛋白的G′在20~45 ℃变化不显著,在45 ℃迅速增加,在53 ℃时达到顶峰,随后逐渐下降。这一结果与Chen等[35]和Jiang等[36]的研究结果一致。在45~53 ℃,肌球蛋白的重链逐渐解链和变性,随后发生交联和凝聚,形成了网络结构,引发G′上升;随温度继续升高,肌球蛋白的轻链变性导致蛋白质的流动性增强,破坏了网络结构,造成G′下降[36]。
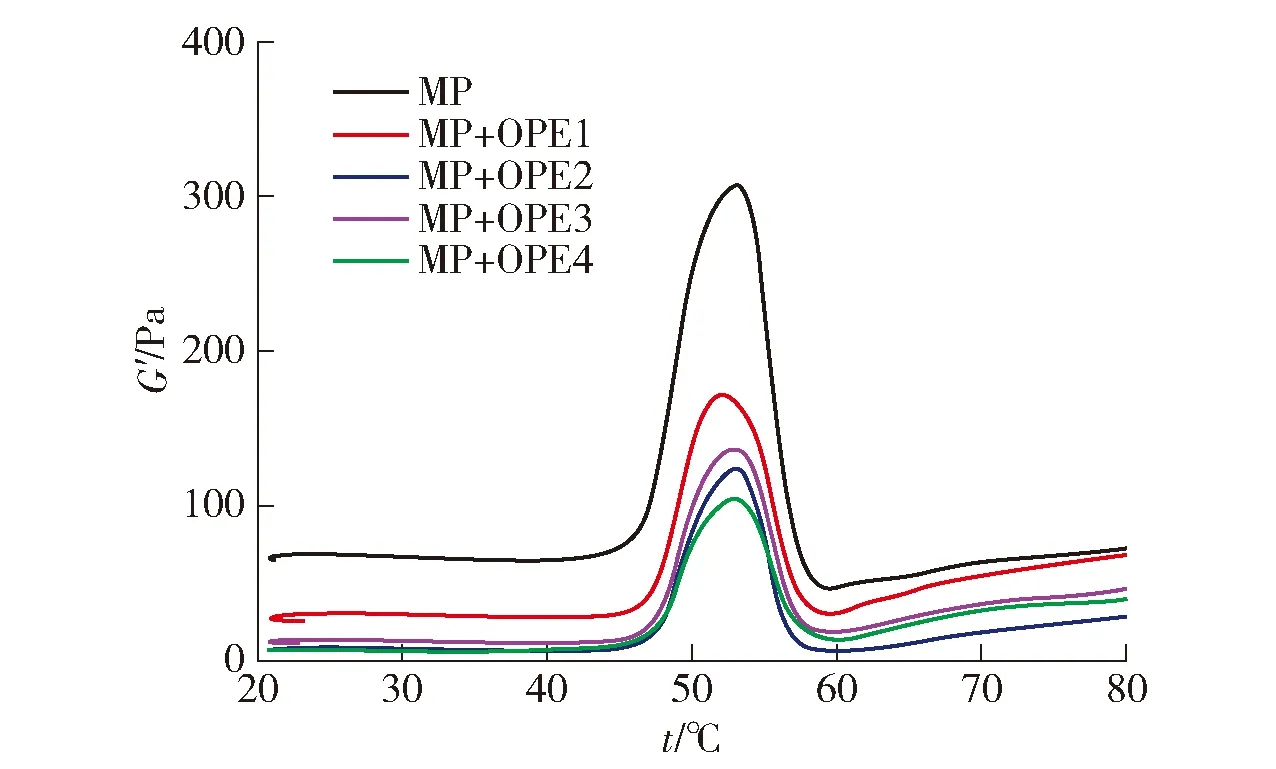
MP与OPE混合的质量比均为1∶1。
图7中,混合蛋白的G′随温度逐渐上升呈现了与肌原纤维蛋白G′相似的变化趋势;与肌原纤维蛋白组相比,冷冻、真空和微波干燥处理的燕麦蛋白的添加未改变G′的峰值温度(53 ℃),但G′均出现了不同程度的下降。燕麦球蛋白在100 ℃加热处理才可能引发六聚体结构的解离和蛋白质单体的聚集,进而形成凝胶[37]。在本研究的实验条件下,不同干燥方法处理的燕麦蛋白可能未完全解离,部分以完整蛋白的形式存在于肌原纤维蛋白形成的三维网状凝胶结构中,从而造成了G′的峰值温度未改变,但数值减小的现象。值得注意的是,相比较于肌原纤维蛋白,喷雾干燥处理的燕麦蛋白与肌原纤维蛋白的混合溶胶的G′的峰值温度降低了2 ℃,这可能是由于喷雾干燥处理的燕麦蛋白与水分子竞争,填充了肌原纤维蛋白凝胶结构的孔隙,造成了峰值温度的降低[36]。
2.2.2振动频率对混合凝胶储能模量与损耗模量的影响
通过分析凝胶在不同振荡频率下储能模量(G′)和损耗模量(G″)的变化可以深入了解凝胶的黏弹特性[39]。不同干燥方法处理的燕麦蛋白与MP的混合凝胶的G′和G″随振荡频率的变化情况如图8。在本研究测试的频率范围内,混合凝胶的G′始终高于G″,表明凝胶在测试过程中保持固态[38]。与肌原纤维蛋白组相比,微波、真空和喷雾干燥处理的燕麦蛋白的添加均提高了凝胶的G′和G″,表明混合凝胶的弹性和黏性提高。Lin等[18]研究了大豆蛋白、豌豆蛋白和MP混合凝胶的流变特性,发现虽然大豆蛋白和豌豆蛋白在实验条件下未形成凝胶,但可能与MP形成的网状结构交织在一起,进而提高了混合凝胶的G′。燕麦蛋白在中性或偏酸性的环境下呈现出较差的溶解性(图6),且在80 ℃条件下难以形成凝胶[2];同时,在pH值为7左右的环境条件下,燕麦蛋白分子和肌原纤维蛋白分子均带负电荷,存在静电斥力[39],这些因素导致燕麦蛋白在热凝胶过程中可能并未与MP发生复杂的相互作用,参与凝胶的形成,而是仅被凝胶结构包裹在内。但燕麦蛋白与肌原纤维蛋白间仍因疏水相互作用和氢键作用等相互影响,从而形成稳定的结构,最终表现为混合凝胶的黏弹性得到改善[39]。从图8中可以看出,混合凝胶的G′以真空干燥、喷雾干燥、冷冻干燥的顺序逐渐递减,这与不同干燥方法处理的燕麦蛋白的表面疏水性呈现相同的变化趋势(图5)。图8显示,相较于肌原纤维蛋白组,添加了冷冻干燥处理的燕麦蛋白的混合凝胶的G′和G″均明显下降,表明凝胶的黏弹性降低。Oechsle等[40]研究了不同分子体积的蛋白质与胶原蛋白混合凝胶的流变特性,发现分子体积小的蛋白质可以包裹在凝胶网络结构内,增强凝胶的黏弹性,而分子体积大的蛋白质可能破坏凝胶结构,造成其黏弹性的下降。冷冻干燥可能造成燕麦蛋白结构疏松多孔,分子体积增大,使MP凝胶结构破坏和黏弹性下降[8]。这些现象表明,4种干燥方法获得的燕麦蛋白与MP的混合凝胶的黏弹性差异可能与多种因素有关。

MP与OPE混合的质量比均为1∶1。
2.2.3混合凝胶持水力变化分析
凝胶的持水能力与其黏弹性质密切相关[41]。不同干燥方法处理的燕麦蛋白与MP的混合凝胶的持水力变化情况如图9。由图9可知,与肌原纤维蛋白组相比,添加了真空和微波干燥处理的燕麦蛋白的混合凝胶的持水力无显著性差异,而添加了喷雾和冷冻干燥处理的燕麦蛋白的混合凝胶的持水力显著下降,这与混合凝胶黏弹性的变化趋势基本一致(图8),表明混合凝胶持水能力的不同主要归因于混合凝胶结构的差异[41]。由此可见,不同干燥方法对燕麦蛋白及燕麦蛋白与MP混合凝胶性质的影响均显著。

MP与OPE混合的质量比均为1∶1,不同小写字母表示组间差异显著(P<0.05)。
2.2.4混合凝胶微观结构变化分析
不同干燥方法处理的燕麦蛋白与MP的混合凝胶的微观结构特征如图10。肌原纤维蛋白组凝胶呈现孔径相对均一的网络结构[图10(a)],而添加了不同干燥方法处理的燕麦蛋白后,混合凝胶的微观结构呈现了不同的变化。喷雾干燥处理的燕麦蛋白与MP形成的凝胶网络具有更为紧密的网状结构,且孔径相对较小[图10(b)],这可能是造成凝胶持水能力相对较差的原因之一(图9);冷冻干燥处理的燕麦蛋白与MP形成的凝胶网络结构较为疏松,孔径相对较大,可能其凝胶结构遭到了部分破坏[图10(c)];真空和微波干燥处理的燕麦蛋白与MP形成的凝胶网络不均匀,虽存在孔隙,但都相对较小[图10(d)、图10(e)]。

MP与OPE混合的质量比均为1∶1。
3 结 论
不同干燥方法对燕麦蛋白的结构及性质影响不同,相比较于冷冻和微波干燥,喷雾干燥处理的燕麦蛋白游离氨基和羰基含量显著提高,β-折叠结构含量下降而无规则卷曲结构含量上升;荧光光谱分析结果表明,相比较于冷冻和微波干燥,喷雾和真空干燥处理的燕麦蛋白的最大发射波长出现了红移;微波干燥处理的燕麦蛋白表面疏水性最低且溶解性最好。添加不同干燥方法处理的燕麦蛋白对肌原纤维蛋白的凝胶性质影响不同,与纯肌原纤维蛋白相比,添加冷冻、真空和微波干燥处理的燕麦蛋白未改变凝胶温度,而添加喷雾干燥处理的燕麦蛋白降低了2 ℃;添加微波、真空和喷雾干燥处理的燕麦蛋白均提高了凝胶的G′ 和G″,且与这3种干燥方法处理的燕麦蛋白的表面疏水性呈现相同的变化趋势,而冷冻干燥处理的燕麦蛋白的添加降低了凝胶的G′ 和G″, 表明混合凝胶的黏弹性降低;扫描电子显微镜结果显示,喷雾干燥处理的燕麦蛋白与肌原纤维蛋白形成的混合凝胶网络具有更为紧密的网状结构,且孔径相对较小,而冷冻干燥处理的燕麦蛋白与肌原纤维蛋白形成的混合凝胶网络较为疏松,孔径相对较大。本研究表明,燕麦蛋白作为一种天然优质植物蛋白,添加到肉制品中可改变肉制品的蛋白质组成,从而增加其相应的功能效应,希望本研究可为谷物- 肉类混合型肉制品的开发提供一定的理论参考。
