酿酒用高产洛伐他汀红曲菌的筛选
2021-12-31吴玉峰刘双平应维茂
吴玉峰, 刘双平, 韩 笑, 应维茂, 毛 健,*
(1.江南大学 粮食发酵工艺与技术国家工程实验室/食品学院, 江苏 无锡 214122;2.浙江古越龙山绍兴酒股份有限公司 国家黄酒工程技术研究中心, 浙江 绍兴 312000;3.江南大学(绍兴)产业技术研究院, 浙江 绍兴 312000)
红曲黄酒是我国黄酒产业中独树一帜的一脉,因添加了红曲作为发酵剂而具有与众不同的生理活性功能。红曲是以大米为主要原料,经红曲菌发酵而成的一种独特的酒曲,富含天然红色色素,古时又被称为“丹曲”、“赤曲”等,具有药用保健价值[1]。红曲菌在发酵制曲过程中,产生了多种功能成分,如降脂活性物质洛伐他汀、食品着色剂红曲色素等[2],其中洛伐他汀(lovastatin,又名Monacolin K),由于具有显著的降脂功效,备受国内外学者的重视[3]。将红曲应用于黄酒酿造,赋予了红曲黄酒特有的降脂保健功能及天然棕红色泽。因此红曲的发酵制备是红曲黄酒酿造必不可少的环节,红曲质量的好坏直接影响红曲黄酒的品质。
国家食品药品监督管理局的国食药监许[2010] 2号文件中规定,红曲产品中洛伐他汀应当来源于红曲,在红曲黄酒发酵过程中洛伐他汀几乎不被合成,只能由含洛伐他汀的酿酒原料——红曲带入到发酵醪中[4]。因此,红曲中洛伐他汀含量的高低直接影响红曲黄酒中的洛伐他汀含量,而红曲中洛伐他汀含量取决于红曲菌产洛伐他汀能力。尽管近年来国内外对高产洛伐他汀红曲菌株的选育已开展了大量研究[5-7],然而红曲中洛伐他汀的含量仍然较低,且针对其在红曲黄酒等酒类中的应用研究相对较少。红曲菌的某些菌株会产生毒性物质——桔霉素,使得红曲的应用受到了限制[8],也导致了红曲黄酒产业的发展比较缓慢。由于不同种红曲菌株代谢产洛伐他汀、红曲色素、桔霉素含量及酶活的能力差异很大,目前国内仍缺乏应用于酿酒行业的优良菌种,因此筛选高产洛伐他汀、色素、酶及低产或不产桔霉素的红曲霉菌株对红曲菌菌种资源的开发及其在黄酒中的应用具有重要意义。
我国红曲的生产主要分布在福建、浙江、广东等省份,故本研究对取自福建、浙江等地的红曲样品中的红曲菌进行分离纯化与固态发酵筛选,通过比较菌株发酵产洛伐他汀、红曲色素、桔霉素含量以及糖化酶、液化酶、蛋白酶活力的差异,筛选出一株可应用于红曲黄酒酿造的高产洛伐他汀的红曲霉菌,并通过酿酒实验验证此红曲菌株在实际生产中的发酵潜力,以期为传统红曲霉菌种资源的发掘利用以及对红曲黄酒保健功能的提升奠定基础。
1 材料与方法
1.1 材料与试剂
从福建宁德、尤溪,浙江温州、丹溪和广东梅州等红曲产地收集市售或农家自制的红曲样品40份。
洛伐他汀、桔霉素标准品,阿拉丁试剂公司;2-辛醇、有机酸和氨基酸等标准品,Sigma公司;甲醇、乙腈为色谱纯,百灵威科技有限公司;其他试剂为分析纯,国药集团化学试剂有限公司。
分离纯化培养基为马铃薯葡萄糖琼脂(PDA),调节pH值至4.5~5.5。鉴定培养基为麦芽汁琼脂培养基。固态发酵培养基:取30 g籼米用乳酸调节pH值至5.0并浸泡2 h,转入250 mL三角瓶,8层纱布封口后于121 ℃,0.08 MPa灭菌30 min,冷却至室温备用。
1.2 仪器与设备
SW-CJ-1CCV型超净台,苏州安泰空气技术有限公司;UV-1800型紫外可见光光度计,上海美普达仪器有限公司;DGG-9240B型干燥箱,上海森信实验仪器有限公司;Waters e2695型高效液相色谱系统,美国Waters科技有限公司;Trace型气相色谱质谱联用仪,美国Thermo Fisher公司;ProFlexTMBase型PCR仪,赛默飞科技有限公司。
1.3 实验方法
1.3.1红曲菌的分离纯化
称取适量红曲样品经研钵研碎后,转入至盛有适量无菌生理盐水的带玻璃珠三角瓶中,震荡30 min后进行梯度稀释,吸取0.1 mL稀释液涂布于分离培养基,于28 ℃培养4~5 d,接种环挑取单菌落至新的分离平板上,纯化出具有红曲菌明显特征的菌株[9]。
1.3.2高产洛伐他汀红曲菌株的筛选
将分离得到的红曲菌株转接至PDA斜面,28 ℃培养7 d。待菌丝布满斜面,试管背面为鲜红色,用无菌水洗下斜面上的孢子,以每克(干质量)大米接种106个孢子的比例接种于冷却好的固态发酵培养基中,28 ℃静置培养48 h后摇散、摊平,此后每24 h摇瓶1~2次,直至14 d发酵结束,烘干备用[10]。采用HPLC法测定红曲菌发酵产物中的洛伐他汀含量,紫外分光光度法测定其色价,实验重复3次取平均值。
1.3.3菌株鉴定
菌落形态观察:采用3点接种法将菌株接种于麦芽汁琼脂培养基上,28 ℃培养7 d,肉眼观察菌落的形态特征,包括菌落的大小、颜色、边缘等。
菌株个体形态观察:采用载片培养法在28 ℃下培养7 d,高倍显微镜(1 000倍)观察菌体的个体形态。
分子生物学鉴定:参考文献[11]提取红曲菌H5-3的DNA,以红曲菌总DNA为模版,分别利用引物对菌株的ITS基因序列(ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATTGATATGC-3’)和β-微管蛋白基因序列(Bt2a:5’-GGTAACCAAATCGGTGCTGCTTTC-3’;Bt2b:5’-ACCCTCAGTGTAGTGACCCTTGGC-3’)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[12]。扩增产物送至上海生工公司进行测序。测序结果通过BLAST程序在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中进行相似性比对,利用MEGA 7.0软件进行多序列比对分析,通过Neighbor-Joining邻接法构建系统发育树,自展值设定为1 000次。
1.3.4红曲指标的测定方法
洛伐他汀含量的测定:采用HPLC法,参考文献[9]并稍作修改。
色价的测定:采用紫外分光光度计法,参照GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》。
桔霉素含量的测定:采用HPLC法,参考QB/T 2847—2007《功能性红曲米(粉)》并稍作修改。
糖化酶活力的测定:参照QB/T 5188—2017《酿造红曲》。
液化酶活力的测定:参考文献[13]方法并稍作修改进行检测。
酸性蛋白酶活力的测定:参照QB/T 1803—93《工业酶制剂通用试验方法》。
1.3.5红曲黄酒的酿造
将籼米浸泡2 h后于121 ℃灭菌20~30 min,冷却后接入红曲菌孢子悬液,以每克(干质量)大米接种106个孢子的比例接种,28 ℃静置培养15 d左右,制成纯红曲米。参考文献[14]中红曲黄酒酿造工艺进行红曲黄酒的制备,糯米经浸米、蒸熟、冷却后与黄酒酵母(质量分数0.2%)、麦曲(质量分数0.7%)、清水(质量分数130%)以及自制的纯红曲米(质量分数12.5%)混匀进行落料。前发酵28 ℃进行5 d,每天进行开耙;后发酵15 ℃进行20 d,开耙间隔2 d。在发酵时间24、72、120、168、240、360、480 h取样,检测发酵液的洛伐他汀含量、红色素色价、桔霉素含量、理化指标、有机酸含量、游离氨基酸含量和挥发性风味物质含量。
1.3.6红曲黄酒指标的测定方法
常规理化指标的测定:酒精度、总酸、氨基酸态氮参照GB/T 13662—2018《黄酒》进行检测,还原糖采用二硝基水杨酸(DNS)法检测[15]。
有机酸含量的测定:参考文献[16],采用HPLC法测定。
游离氨基酸含量的测定:参考QB/T 4356—2012《黄酒中游离氨基酸的测定 高效液相色谱法》并稍作修改进行测定。
挥发性风味物质的测定:参考文献[16],采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合气质联用(gas chromatography-mass spectrometry,GC-MS)法测定挥发性风味物质含量。通过NIST(National Institute of Standards and Technology)质谱数据库检索结合标准物质进行定性分析,再采用SPME方法对外标混合物进行检测,以外标法进行全定量,同时添加内标2-辛醇(101.8 mg/L)作为参考。
1.4 数据分析
采用Origin 2018 软件、SPSS 22.0软件进行数据处理分析。计算结果采用“平均值±标准偏差”表示,并进行方差分析,其中P<0.05视为差异显著。
2 结果与分析
2.1 高产洛伐他汀红曲菌的筛选结果
2.1.1红曲菌产洛伐他汀能力比较
通过稀释涂布和分离纯化,从40份红曲样品中分离出49株具有代表性的红曲菌菌株。对49株红曲菌进行固态制曲实验,检测发酵结束后红曲中的洛伐他汀含量及色价,最终筛选出10株产洛伐他汀和色素能力较强的优良红曲菌株,结果见图1。在这10株红曲菌株中,菌株H5-3的产洛伐他汀能力显著高于其他菌株(P<0.05),产量高达17.90 mg/g。参考GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》采用分光光度计法测定OD505 nm值代表红色素色价,并参考文献[17]补充测定OD410 nm、OD465 nm值代表黄色素色价、橙色素色价,结果见图1(b)。菌株H40-2产红色素含量最高,色价为4 391.14 μ/g,菌株H5-3红色素产量的色价为3 195.27 μ/g,符合我国红曲米标准GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》。

图1 红曲菌产洛伐他汀和红曲色素能力比较
2.1.2红曲菌产桔霉素情况比较
红曲霉在代谢产生洛伐他汀、红曲色素等有益代谢产物的同时,也会产生一定含量的桔霉素,不同种红曲霉生成桔霉素的能力是有差异的,所以对10株红曲菌的桔霉素产量进行了比较分析,结果见表1。分析结果发现,上述10株红曲菌桔霉素产量均低于50 μg/kg,尤其是菌株H5-3、H40-1并未检测到桔霉素的产生,目前在GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》中,桔霉素并未被列入检测指标,而在QB/T 2847—2007《功能红曲米》中对功能红曲米中桔霉素限量为50 μg/kg,因此这10株红曲菌均符合轻工行业标准。

表1 红曲菌产桔霉素含量情况
2.1.3红曲菌产酶能力比较
红曲菌在发酵过程中可以产生多种酶类,如淀粉酶、糖化酶、蛋白酶等。其中淀粉酶能将淀粉分解成糊精、麦芽糖等,糖化酶接着将它们降解成葡萄糖。蛋白酶通常将大米的蛋白质分解为多肽、氨基酸等,既促进酵母快速繁殖,还为发酵后期醇类、醛类、酮类等风味物质的形成提供前体物质。本研究比较了获得的10株红曲菌产糖化酶、液化酶、酸性蛋白酶的能力,结果见图2。由图2可知,高产洛伐他汀菌株H5-3产糖化酶、酸性蛋白酶能力显著高于其他菌株(P<0.05),其糖化酶活、酸性蛋白酶活力分别为2 514.26、300.19 U/g,符合酿造红曲要求。高产洛伐他汀的菌株H5-3产液化酶能力较低,为0.32 U/g。目前,用于红曲黄酒酿造的红曲菌产液化酶活力均较弱,故在红曲黄酒的酿造过程中添加麦曲进行共酵,从而提升黄酒品质。
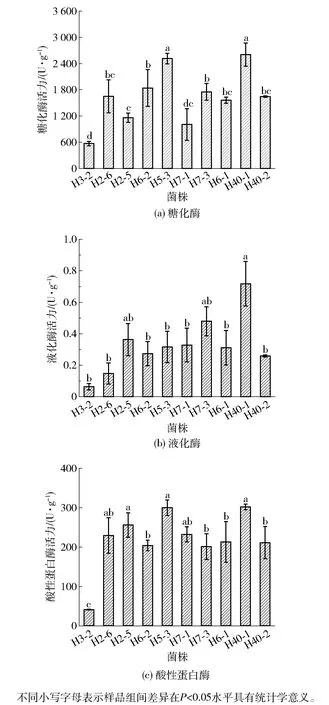
图2 红曲菌产糖化酶、液化酶和酸性蛋白酶能力比较
固态发酵是目前生产功能红曲的常用方法,常聪等[18]、李阔阔等[19]、吴双双等[20]通过诱变技术及固态发酵实验筛选出的高产洛伐他汀的红曲菌株,洛伐他汀产量均低于10 mg/g。本研究基于对10株红曲菌产洛伐他汀、色素、桔霉素以及酶活能力的比较分析,筛选获得的菌株H5-3不仅具有高产洛伐他汀的能力,产色素能力也不低,更不产桔霉素,同时也高产糖化酶、酸性蛋白酶,是可应用于红曲黄酒酿造的功能红曲菌。
2.2 菌株H5-3的鉴定结果
2.2.1形态观察结果
对H5-3菌株在麦芽汁琼脂培养基上28 ℃培养7 d后,进行形态观察,见图3。由图3可知,菌落直径21~22 mm,平坦,有中度密集且短的气生菌丝,呈丛卷毛状,通常为橙红色,边缘不规则。在高倍显微镜下观察,菌株H5-3菌丝分支繁多,且呈不规则状;闭囊壳呈球形,着生于似柄的菌丝上,整体呈橙红色,子囊孢子呈椭圆形。参考《真菌鉴定手册》[21],并根据《红曲菌的形态与分类学》[22]进行检索,该菌株初步鉴定为紫色红曲菌。
2.2.2分子生物学鉴定结果
菌株H5-3基于ITS基因、β-微管蛋白(Bt2a/Bt2b)基因序列的PCR扩增产物经质量分数为1%琼脂糖凝胶电泳验证,凝胶电泳结果见图4。由图4可知,产物片段大小均约为500 bp,条带明显,符合测序要求。对菌株H5-3 ITS rDNA基因和β-微管蛋白基因序列进行测序分析,所得序列分别在GenBank数据库中进行同源序列比对,并利用MEGA 7.0软件构建系统发育树,结果见图5。由图5可知,菌株H5-3与紫色红曲菌(Monascuspurpureus)的同源性最高,相似度高达99%以上。结合形态学观察结果,将菌株H5-3鉴定为紫色红曲菌(M.purpureus)。该菌是食品工业上常见的红曲菌种之一,是大多数红曲产品标准中的指定菌株,也是国家卫生部门认定的可用于保健食品的安全菌种,产洛伐他汀和红曲色素能力较强。
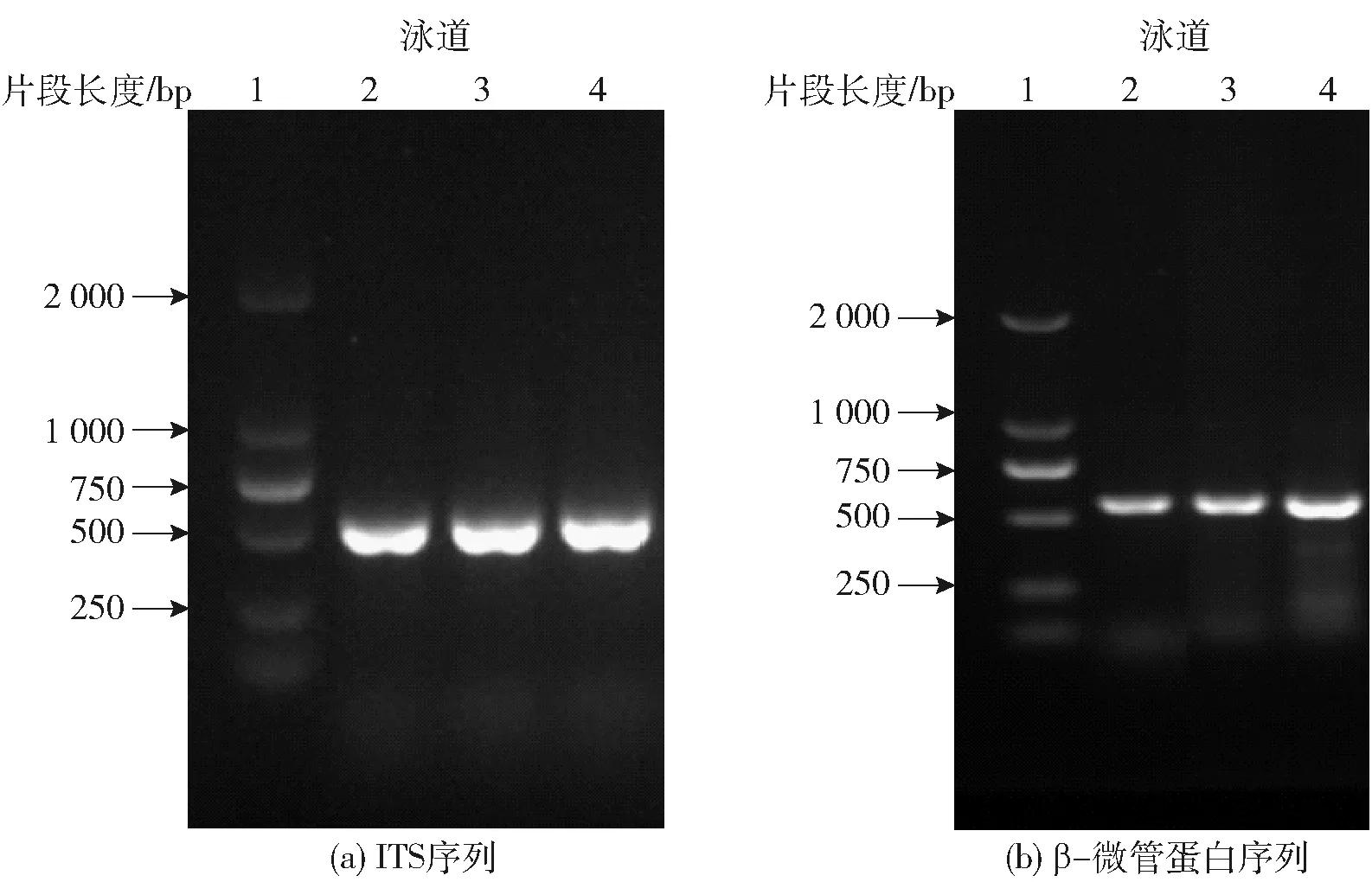
图4 菌株H5-3的rDNA-ITS PCR产物及rDNA-β-微管蛋白 PCR产物电泳图

图5 基于ITS序列与β-微管蛋白序列构建的菌株H5-3系统进化树
2.3 菌株H5-3酿造红曲黄酒的分析结果
2.3.1红曲黄酒理化指标测定结果
将筛选获得的高产洛伐他汀的红曲菌H5-3固态发酵制成红曲,并进行红曲黄酒的酿造。发酵后所得的红曲黄酒理化指标见表2,酒精度14.86%,总酸4.90 g/L,氨基酸态氮0.83 g/L,由于红曲液化力偏低,故在酿酒过程中添加了麦曲,进而使酒中氨基酸态氮含量偏高。酒体色泽鲜艳红润,色价为22.86 μ/mL,洛伐他汀含量达63.75 mg/L,并且无桔霉素检出。与王龙等[23]、夏艳秋等[24]研制的功能性红曲黄酒相比,本研究制备的功能性红曲黄酒不仅含有更高的洛伐他汀,色价也更高。

表2 红曲黄酒理化指标测定结果
2.3.2红曲黄酒发酵过程中洛伐他汀和红色素色价的变化
红曲酒在酿造过程中的洛伐他汀含量和红色素色价的变化情况见图6。由图6可知,在红曲酒发酵的0~120 h内,发酵液中洛伐他汀含量、色价迅速增加,分别达到68.23 mg/L、24.44 μ/mL;接着48 h后发酵醪中的洛伐他汀含量、色价略微下降,发酵结束时红曲酒中的洛伐他汀含量、红色素色价分别为63.75 mg/L、22.86 μ/mL。研究表明红曲黄酒中的洛伐他汀主要来源于红曲原料[4]。在红曲黄酒发酵过程中,红曲中的洛伐他汀会逐渐被浸提到发酵醪中,因此红曲中的洛伐他汀含量越高,红曲酒中的洛伐他汀含量也就越高。

图6 红曲黄酒发酵过程中洛伐他汀含量和红色素色价的变化
2.3.3红曲黄酒中主要风味物质分析
红曲黄酒的风味物质主要有游离氨基酸、有机酸和挥发性风味物质,它们对红曲黄酒的品质起着重要作用。对红曲黄酒中的有机酸、游离氨基酸和挥发性风味物质进行检测,结果见图7和表3。由图7可知,发酵结束后的红曲黄酒有机酸总量达12.70 g/L,乳酸、乙酸、琥珀酸、酒石酸、柠檬酸为主要成分,分别占总量的28.2%、21.9%、14.5%、12.2%、5.7%,除柠檬酸含量较低外,其余有机酸成分比例与福建清爽红曲酒[25]相似;红曲黄酒游离氨基酸总量3 540.58 mg/L,甜味、苦味、涩味、鲜味4种氨基酸风味比例与文献[14]一致。
红曲黄酒主要挥发性风味物质及含量见表3。由表3可知,红曲黄酒中共检测出包括13种酯类、6种醇类、6种醛类、4种酸类、4种酚类在内的共33种风味物质。在红曲酒挥发性风味物质中,酯类、醇类为主要成分,分别占总量的48.4%、43.9%,其中乙酸乙酯、乳酸乙酯、丁二酸二乙酯、正丙醇、苯乙醇等含量较高,对风味有较大贡献。在红曲黄酒中检测到酚类物质总量为(5.04±0.74)mg/L,主要是愈创木酚、4-乙烯基愈创木酚、苯酚,与文献[26]中福建老酒等酒类相比,具有较高的酚类物质含量。与文献[25-26]中报道的红曲黄酒挥发性风味物质组分相比,本研究制备的功能红曲黄酒呈香正常,符合红曲黄酒的基本风味特征。
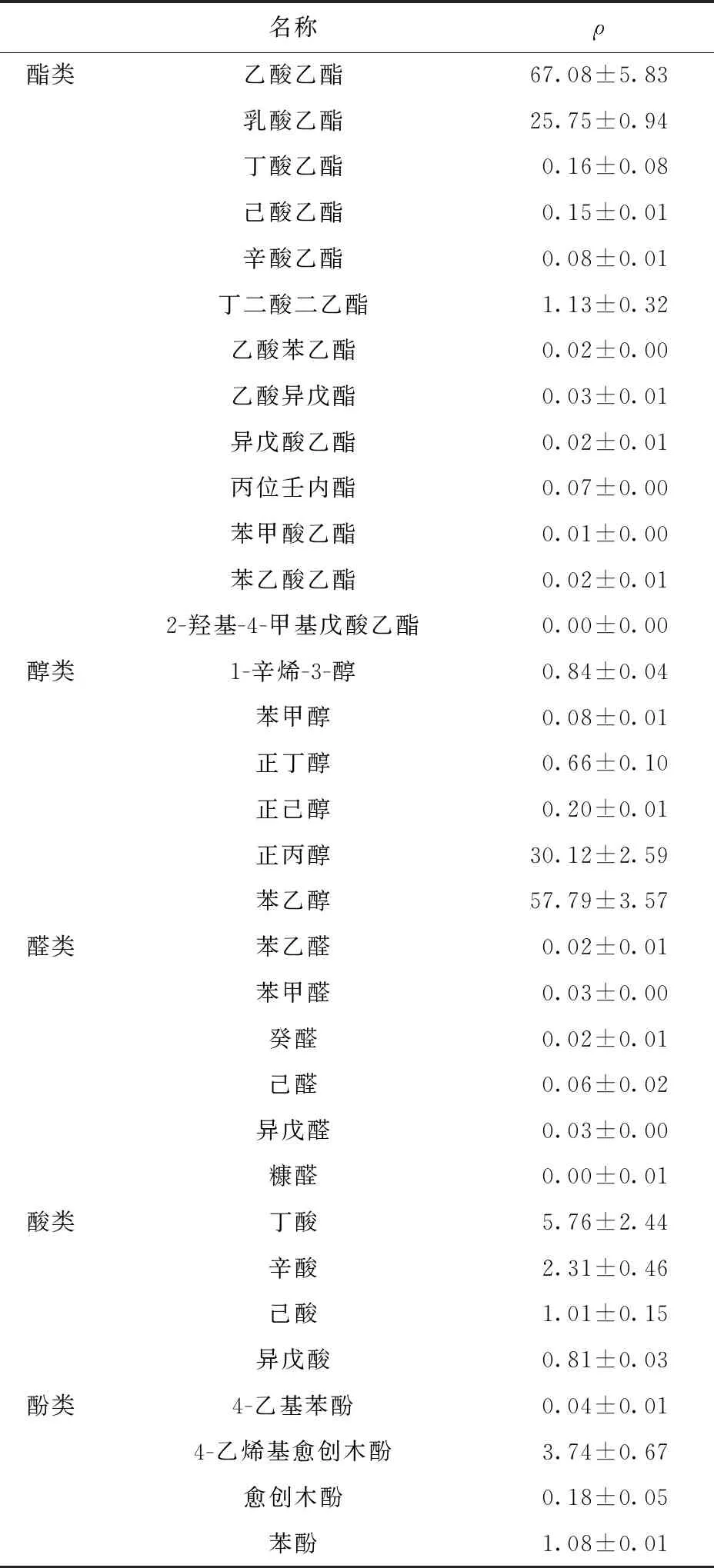
表3 红曲黄酒中的主要挥发性风味物质及含量
3 结 论
为获得酿酒用高产洛伐他汀红曲菌株,本研究以洛伐他汀含量、红曲色素色价、桔霉素含量及红曲菌产酶能力为评价指标,通过对不同产地40份红曲样品中的红曲菌进行分离纯化与固态发酵筛选,获得了1株高产洛伐他汀的菌株H5-3,经形态观察和分子生物学鉴定,判定该菌株为紫色红曲菌(M.purpureus)。经过检测,菌株H5-3的洛伐他汀产量高达17.90 mg/g,红色素色价3 195.27 μ/g,糖化酶、液化酶、酸性蛋白酶的活力分别达2 514.26、0.32、300.19 U/g,且该菌株不产桔霉素,是可应用于红曲黄酒酿造的功能红曲霉菌。进一步将该紫色红曲菌H5-3应用于红曲黄酒的酿造,制得的红曲黄酒中洛伐他汀质量浓度63.75 mg/L,红色素色价22.86 μ/mL,酒精度、总酸、氨基酸态氮等各项红曲酒理化指标均符合黄酒国家标准。对制得的红曲黄酒风味物质进行分析,有机酸、游离氨基酸和挥发性风味物质含量比例协调,酯类、醇类、酚类等挥发性风味物质含量较高,风味口感较佳。但本研究仅对筛选到的高产洛伐他汀菌株进行酿造验证,而其高产洛伐他汀的机理值得进一步探究。
