2-溴棕榈酸缓解脊髓炎性痛的机制研究*
2021-12-29董志斌王煜嘉朱海丽
董志斌,王煜嘉,李 岱,朱海丽
(湖北科技学院药学院,湖北 咸宁 437100)
脊髓炎性痛是脊髓受损后常见的症状之一,导致脊髓炎的因素很多,包括脊髓损伤、感染及自身免疫性疾病等[1]。在中枢神经系统中,神经元和星形胶质细胞两者是结构和功能伙伴关系,在应对伤害或疾病时共同起作用。生理状态下星形胶质细胞处于静息态;病理性疼痛(包括神经痛、炎性痛和骨癌痛)状态下,脊髓星形胶质细胞被激活,释放促炎因子并维持疼痛[2]。
NLRP3炎症小体在炎症因子的加工和释放中起着关键作用,如白细胞介素-1β(IL-1β)和IL-18[3]。NLRP3炎症小体由NOD样受体3(NOD-like receptor 3,NLRP3)、接头蛋白凋亡相关点状样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和效应蛋白半肤氨酸蛋白酶1前体(pro-caspase-1)组成。NLRP3炎症小体介导pro-caspase-1活化为caspase-1,进而导致IL-1β和IL-18的成熟和释放,发挥免疫炎症效应[4]。
2-溴棕桐酸(2-Bromopalmitate,2-BP)可影响蛋白质在膜结构上的定位及功能,是一种常用的蛋白棕桐酰化抑制剂[5]。本研究明确了鞘内给药2-BP对脊髓炎性痛的缓解作用,并探讨其病理机制。
1 材料与方法
1.1 实验动物
本实验中使用的Sprague-Dawley(SD)大鼠购于湖北省实验动物中心,共18只,体质量180~200g,6~8周龄。动物合格证号:No.42000600041944。
1.2 主要试剂
二甲基亚砜(DMSO)、2-BP、蛋白酶抑制剂均购自美国Sigma公司,加强型RIPA lysis buffer、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒、TNF-α均购自上海碧云天生物技术有限公司。Anti-NLRP3(A12694)、anti-β-actin(A1978)、anti-ASC(A11433)、anti-caspase-1(A0964)、anti-GFAP(A19058)、HRP标记山羊抗兔IgG均购自武汉爱博泰克生物科技有限公司。
1.3 模型建立及分组处理
构建大鼠脊髓炎性痛模型,方法如下[6]:剔除大鼠背部注射部位毛发并进行皮肤表面消毒,用无菌微量注射器于L5和L6脊椎棘突间隙垂直进针,进入蛛网膜下腔,缓慢倾斜45°注入100ng/10μL TNF-α,构建脊髓炎模型大鼠(建模组),分为模型组(n=6)及模型给药组(n=6);对照组大鼠注射同等体积生理盐水,分为空白对照组(n=3)和对照给药组(n=3)。随后所有大鼠,注入TNF-α或生理盐水半小时后,模型组和空白对照组鞘内注射10μL体积DMSO+生理盐水(体积比1∶1),模型给药组和对照给药组注射200μg/10μL体积的2-BP溶液。2-BP溶解在DMSO中,使用前用生理盐水按体积比1∶1进行稀释。
1.4 大鼠自发性缩足反射次数记录
大鼠置于长宽高均为30cm的透明有机玻璃盒内,玻璃平板位于实验平台高50cm的支架上。实验开始前,将大鼠放置玻璃盒中适应30min,观察并记录每5min内大鼠自发性缩足(或舔爪)反射次数,记录3次。建模成功的基础上建模组和对照组分别放回盒内30min后记录缩足(或舔爪)次数/5min,记录3次。进而,继续鞘内注射DMSO+生理盐水(模型组和空白对照组)或2-BP(模型给药组和对照给药组),30min后记录缩足(或舔爪)次数/5min,记录3次。
1.5 免疫印迹法检测脊髓组织GFAP、NLRP3、ASC、caspase-1蛋白表达水平
空白对照组、模型组和模型给药组大鼠行为学记录结束后,给予过量麻醉(10%水合氯醛5mL/kg)处死,分离脊柱,暴露脊髓,剥离脊膜,分离并得到腰段脊髓,进行免疫印迹实验检测胶质细胞标记物GFAP,炎症小体标记蛋白NLRP3、ASC、caspase-1的表达水平。具体过程如下:脊髓组织加入含有酶抑制剂的RIPA裂解液匀浆,12 000r/min、4℃离心15min取上清,BCA蛋白分析试剂盒检测上清中的蛋白质浓度。SDS-PAGE分离蛋白质样品,转PVDF膜,5%脱脂奶粉封闭lh,一抗孵育过夜,二抗孵育1h,LAS500凝胶成像系统扫描观察,Image J软件对比分析空白对照组、模型组和模型给药组的条带灰度值。
1.6 统计学方法
2 结 果
2.1 成功构建大鼠脊髓炎性痛模型
以大鼠自发性缩足(或舔爪)反射次数(Flinches)评估大鼠自发性痛情况。如图1所示,与对照组相比,注射TNF-α后建模组缩足次数明显上升(P<0.05),表明脊髓鞘内注射TNF-α引发大鼠外周痛觉过敏建模成功。

与对照组比较,*P<0.05
2.2 2-BP鞘内给药缓解大鼠脊髓炎性痛
为了检测2-BP对脊髓炎性痛的作用,鞘内给药2-BP后记录大鼠自发性缩足(或舔爪)反射次数。如图2显示,模型给药组大鼠的自发缩足次数明显降低(P<0.05)。同时,对照组中2-BP对正常大鼠的行为学没有影响(P>0.05)。该结果表明鞘内给药2-BP可有效缓解脊髓炎引发的痛觉过敏。
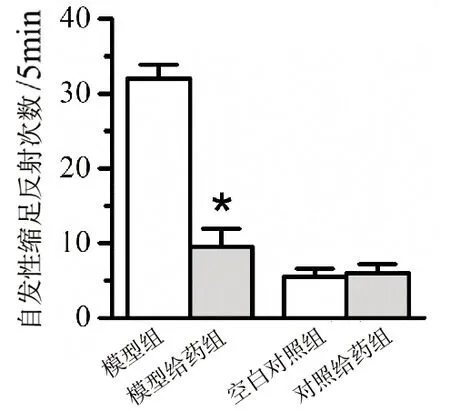
与模型组比较,*P<0.05
2.3 2-BP降低GFAP蛋白表达水平
如图3所示,与空白对照组相比,模型组大鼠脊髓组织中GFAP的表达明显上调(P<0.05)。2-BP给药处理后,脊髓中GFAP的表达明显下调(P<0.05)。表明2-BP鞘内给药显著降低GFAP的蛋白表达水平,降低星形胶质细胞过度激活。

与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.4 2-BP抑制NLRP3炎症小体活化
为验证2-BP对炎症反应的影响,我们检测了NLRP3炎症小体变化水平,包括核心蛋白NLRP3、衔接蛋白ASC和效应蛋白caspase-1的表达,其中pro-caspase-1表征caspase-1的本底表达水平,cleaved-caspase-1表征caspase-1的活化水平。免疫印迹结果显示,与空白对照组相比,模型组大鼠脊髓组织中NLRP3、ASC以及cleavad-caspase-1蛋白表达均增加(P<0.05)。但2-BP给药后NLRP3、ASC以及cleavad-caspase-1的表达水平均明显下调(P<0.05)。上述数据表明,鞘内给药2-BP显著抑制NLRP3炎症小体活化,从而降低脊髓炎症。

与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨 论
本研究以大鼠脊髓炎模型为研究载体,探究2-BP对脊髓炎引发外周痛觉过敏的作用以及相关机制。脊髓组织是小胶质细胞、星形胶质细胞主要分布区域,当诱导脊髓炎症时,这些细胞均会发生炎症激活及代谢异常导致疼痛[7]。GFAP是scar-星形胶质细胞的标志物,反映星形胶质细胞的活性[8]。脊髓炎症包含有多种炎性蛋白参与其形成,由于细胞代谢异常启动炎症NLRP3小体形成,继而促进接头蛋白指向ASC及caspase-1蛋白的表达,从而促进脊髓神经细胞的损伤引起脊髓炎症性疼痛。在炎性因子诱导的脊髓炎模型中,2-BP给药后,脊髓组织中GFAP表达明显降低,表明2-BP可有效降低星形胶质细胞激活。
星形胶质细胞激活可引发炎性蛋白及炎症的形成,NLRP3炎症小体是影响炎症因子表达活化的重要调节因素[9]。静息状态下 NLRP3 位于内质网膜,病理状态被激活后,NLRP3和其配体ASC聚集到细胞核周围,诱导pro-caspase-1转变为成熟的cleavage-caspase-1,进一步切割pro-IL-1β和pro-IL-18,将其转变为具有生物活性的IL-1β和IL-18,并释放到细胞外组织中,参与后续的炎症瀑布反应,强烈的炎症反应会导致脊髓中的神经元死亡[10]。为表征2-BP对炎症小体的作用,如图4所示,我们发现2-BP显著降低NLRP3、ASC和cleavage-caspase-1的蛋白表达,表明2-BP可抑制NLRP3炎症小体活化,
降低星形胶质,最终发挥缓解脊髓炎性痛的作用。
综上所述,2-BP可能通过调节炎性小体NLRP3在小胶质细胞与星形胶质细胞中合成,进而改善药物诱导动物的炎性疼痛,同时该研究也为2-BP在抗炎镇痛中的作用提供了一定的理论依据。
