硫利达嗪协同二甲双胍对肺癌细胞的抑制作用及其机制*
2021-12-29刘星吟王攀琦刘复兴宁志丰
王 芳,刘星吟,王攀琦,刘 洋,刘复兴,宁志丰**
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院基础医学院)
肺癌分为小细胞肺癌和非小细胞肺癌, 非小细胞肺癌又分为肺鳞癌和肺腺癌。肺癌的发病率在各类癌症中位居第二,死亡率在所有类型的癌症中遥遥领先[1]。目前,肺癌主要以化疗和放疗为主。但化疗药物易产生耐药性,且对患者伤害较大,因此,寻找新的抗肿瘤药物成为治疗肺癌的研究热点。二甲双胍是治疗2型糖尿病的口服降糖药,Evans等[2]首次发现二甲双胍可以降低糖尿病患者的癌症发病率,此后,二甲双胍的抗癌作用受到广泛关注。研究表明[3-4],二甲双胍对肺癌、子宫内膜癌等均有抑制作用,具有潜在抗癌价值。硫利达嗪是一种常见的吩噻嗪类抗精神病药物,近年来研究[5-6]发现硫利达嗪对多种癌症如胶质瘤、黑色素瘤等有抑制作用。因此,我们将二甲双胍与硫利达嗪作为新的抗肿瘤药进行研究。
1 材料与方法
1.1 材料
人肺腺癌细胞H1975细胞株为研究模型。主要试剂:盐酸硫利达嗪和盐酸二甲双胍、二甲基亚砜(DMS0)购自美国Sigma公司;四甲基偶氮唑盐(MTT)购自碧云天生物技术研究所;RPMI-1640培养基购自美国 Hyclone公司;胎牛血清(FBS)、青霉素-链霉素购自美国Gibico公司;Matrigel胶购自美国Corning公司;Akt、p-Akt、PI3K、p-PI3K、mTOR、p-mTOR和β-actin抗体购自武汉爱博泰克(ABclonal)生物科技有限公司。
1.2 方法
1.2.1 细胞培养
人肺腺癌细胞H1975细胞的培养条件为5%CO2、37℃。配制含10%胎牛血清和1%双抗的RPMI-1640培养基培养细胞,细胞密度达到90%时进行实验。
1.2.2 MTT细胞增殖实验
将消化后的H1975细胞调整细胞密度至7×104个/mL,96孔板每孔加入100μL的细胞悬液,放置培养箱内培养。细胞密度达70%以上时给药设硫利达嗪组(THZ)浓度为0、2.5、5、10、20、40 μmol/L,二甲双胍组(MET)浓度为0、2.5、5、10、20、40mmol/L,联合给药组(COM)浓度为0、2.5+2.5、5+5、10+10、20+20、40+40(μmol/L硫利达嗪+mmol/L二甲双胍),每组药物做4个复孔,加药后继续培养24h和48h。每孔加入10μL MTT(5mg/mL),培养4h。每孔加入DMSO 150μL,使用酶标仪在490nm处测定吸光度(OD)。细胞存活率=(实验组OD值-对照组OD值)/对照组OD值,设定对照组存活率为1。
1.2.3平板克隆形成实验
将H1975细胞调整细胞密度至500个/mL,每孔1mL铺至6孔板内培养24h后给药。对照组(CON)给药浓度为0、THZ组1μmol/L、MET组1mmol/L、COM组1μmol/L硫利达嗪+1mmol/L二甲双胍,培养至克隆形成。结晶紫染色后拍照并计数。克隆形成率=实验组克隆数/对照组细胞数。设定对照组克隆形成率为1。
1.2.4 细胞迁移实验
预先将细胞饥饿24h。将细胞消化下来用无血清培养基调整细胞密度为2.5×105个/mL。用含20%血清的1640培养基配制药物,CON组给药浓度为0、THZ组5μmol/L、MET组5mmol/L、COM组5μmol/L硫利达嗪+5mmol/L二甲双胍。上室加入200μL细胞悬液,下室加入500μL药物。培养24h后,用结晶紫将小室进行染色晾干后拍照并计数。细胞迁移率=实验组细胞数/对照组细胞数。设定对照组迁移率为1。
1.2.5 细胞侵袭实验
预先将细胞饥饿24h。将Matrigel胶与1640按1∶8比例混合均匀,每个小室加入100μL的混合液,以上步骤冰上操作。放置培养箱30min使胶凝固,将未凝固的培养基吸出。用无血清培养基调整细胞密度至2.5×105个/mL。用含20%血清的1640培养基配制药物,CON给药浓度为0、THZ组5μmol/L、MET组5mmol/L、COM组5μmol/L硫利达嗪+5mmol/L二甲双胍。上室加入200μL细胞悬液,下室加入500μL药物。放置培养箱培养24h后,使用结晶紫染色晾干后拍照并计数。细胞侵袭率=实验组细胞数/对照组细胞数。设定对照组侵袭率为1。
1.2.6 Western blot实验
将COM组0、THZ组10μmol/L、MET组10mmol/L及COM组10μmol/L硫利达嗪+10mmol/L二甲双胍作用8h的细胞提取蛋白。配制裂解液:加入RIPA裂解液、EDTA、磷酸化蛋白酶抑制剂、总蛋白酶抑制剂。用PBS将细胞润洗3次,加入裂解液使细胞充分裂解后开始离心(12 000r/min,4℃,15min),离心后取上清液并记录体积,使用BCA试剂盒检测蛋白浓度;在各蛋白中加入一定体积的5×SDS-PAGE Loading buffer后进行煮沸变性。制备不同浓度的凝胶,每孔上样量不低于50μg;电泳至底部。PVDF膜用甲醇激活后与胶放置在转膜夹内开始转膜(270mA,70min)。5%脱脂牛奶封闭1h;在抗体孵育盒内加入对应的一抗放置4℃冰箱内的摇床上摇床过夜,将条带用TBST 润洗3次,加入对应种属的二抗室温孵育1h,再将条带用TBST润洗3次,每次10min,显影。
1.3 统计学方法
所有实验均重复3次,组间比较采用t检验,以P<0.05为差异有统计学意义。样本均数用Graphpad prism 8.0的非配对t检验,两药联合指数采用CompuSyn软件进行计算,CI>1表示拮抗,CI=1表示相加,CI<1表示协同/增敏,CI<0.4表示强协同/增敏。
2 结 果
2.1 二甲双胍联合硫利达嗪增强对肺癌细胞增殖能力的抑制作用
通过观察二甲双胍和硫利达嗪对H1975细胞的影响,在给药时间相同的条件下,随着给药剂量的增加,细胞活性下降;在给药浓度相同的条件下,随着给药时间延长,细胞活性下降但下降不明显;在相同的给药时间条件下,与MET组和THZ组相比,COM组的细胞活力显著降低(P<0.05),计算联合指数CI<1,在低浓度给药24h时CI可达0.24,因此,二甲双胍与硫利达嗪具有强协同/增敏作用。见图1。


A、B.给药24h细胞活力;C、D.给药48h细胞活力;E.给药24h各组联合指数;F.给药48h各组联合指数(*P<0.05,**P<0.01,***P<0.001)
2.2 二甲双胍联合硫利达嗪增强对肺癌细胞克隆形成能力的抑制作用
观察H1975细胞的克隆形成率,与CON组相比,MET组降低34.7%,THZ组降低23.2%,COM组降低96.4%;COM组较之MET组克隆形成率降低61.7%,比THZ组降低73.2%。见图2。
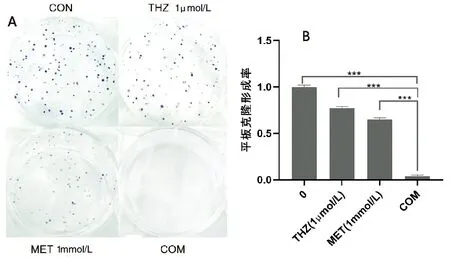
A.克隆形成图;B.克隆形成率比较(***P<0.001)
2.3 二甲双胍联合硫利达嗪增强对肺癌细胞迁移能力的抑制作用
观察H1975细胞的细胞迁移率,与CON组相比,MET组降低42.3%,THZ组降低8.6%,COM组降低92.1%;COM组较MET组细胞迁移率降低49.8%,比THZ组降低83.5%。见图3。

A.细胞迁移图片(×100);B.细胞迁移率比较(***P<0.001)
2.4 二甲双胍联合硫利达嗪增强对肺癌细胞侵袭能力的抑制作用
观察H1975细胞的细胞侵袭率,与CON组相比,MET组降低40.5%,THZ组降低5.7%,COM组降低71.3%;COM组较MET组细胞迁移率降低30.8%,比THZ组降低65.6%。见图4。

A.细胞侵袭图片(×100);B.细胞侵袭率比较(***P<0.001)
2.5 二甲双胍联合硫利达嗪对肺癌细胞PI3K/Akt/mTOR信号通路相关蛋白表达的影响
观察H1975细胞的总的Akt、PI3K、mTOR蛋白表达水平,3组间没有明显差异,无统计学意义(P>0.05)。与CON组相比,MET、THZ组和COM组P-Akt蛋白表达水平均明显下降(P<0.01);与MET组和THZ组相比,COM组p-Akt蛋白表达量明显下降(P<0.01)。与CON组相比,MET、THZ组和COM组P-PI3K蛋白表达均下降(P<0.05);与单药组相比,COM组P-PI3K蛋白表达量显著下降(P<0.001)。与CON组相比,MET、THZ组和COM组p-mTOR蛋白表达均显著下降(P<0.001);与单药组相比,COM组p-mTOR蛋白表达量明显下降(P<0.01)。见图5。

(**P<0.01;***P<0.001)
3 讨 论
二甲双胍是治疗2型糖尿病的一线用药,具有稳定、高效、安全性高等特点。二甲双胍的降糖机制主要包括减少肝脏糖异生,增加外周葡萄糖的摄取和利用,改善胰岛素的敏感性等[7]。近年来,大量研究发现二甲双胍能够抑制肺癌、胃癌、乳腺癌、甲状腺癌、子宫内膜癌等癌细胞增殖[8]。
硫利达嗪是靶向于多巴胺受体 (DR2) 抗精神病药,已有报道硫利达嗪对肝癌干细胞[9]和胃肠肿瘤[10]有抑制作用。研究发现[11],在卵巢癌中,硫利达嗪通过PI3K下游的信号分子的磷酸化,包括Akt和mTOR,抑制卵巢肿瘤的生长。
二甲双胍联合其他药物用于抗肿瘤已有研究,如克唑替尼[12]、IL-12[13]以及放疗药物等[14]。硫利达嗪与顺铂[14]、姜黄素、白藜芦醇[16]等联合用于抗肿瘤已见报道。本研究首次将二甲双胍与硫利达嗪联合使用用于抗癌。细胞的增殖和凋亡失去平衡是肿瘤形成的主要原因。因此,本研究采用MTT法检测肺癌细胞活力,并计算两药的联合指数。实验结果发现,两药均能抑制肺癌细胞增殖,且具有协同增效作用。此外,本研究也做了平板克隆实验检测肺癌细胞增殖能力的影响,结果与MTT实验结果一致。肿瘤细胞的迁移侵袭是肿瘤恶化的主要原因。因此,本研究采用迁移侵袭实验检测两药对肺癌细胞迁移侵袭能力的影响。实验结果表明,两药能够协同抑制肺癌细胞的迁移侵袭能力。因此,协同使用硫利达嗪与二甲双胍有望成为治疗癌症的新方法。
PI3K是一种胞内磷脂酰肌醇激酶,与细胞增殖、分化、调亡等过程密切相关。Akt是PI3K的下游基因,活化的PI3K能够激活Akt,从而调控细胞的各种生命活动,促进细胞凋亡[17]。mTOR是一个289kDa丝氨酸/苏氨酸蛋白激酶,在细胞生长、增殖和存活中起调节作用。mTOR有不同的复合物,mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2),mTORC1主要参与细胞凋亡[18]。 本研究通过Western blot实验检测到协同使用硫利达嗪和二甲双胍后,H1975细胞内p-Akt/p-PI3K/p-mTOR蛋白的表达水平均降低,且联合给药组明显低于单药组,这些实验结果表明硫利达嗪协同二甲双胍抑制肺癌细胞可能是通过阻断PI3K/Akt/mTOR信号通路的激活发挥作用,且联合使用两药对PI3K/Akt/mTOR信号通路激活的阻断作用优于单独使用两药。
本研究尚有许多后续问题待解决,且未涉及动物实验,因此,硫利达嗪联合二甲双胍抑制肺癌在动物体内的作用还未可知。此外,两药协同使用是否对其它癌症也有效还有待研究。在作用机制方面,两药是否也可调控其它癌症相关信号通路发挥作用也未可知。因此,本研究尚存在许多问题,有待进一步研究。
