p53对平滑肌细胞向成骨样细胞转分化的影响*
2021-12-29李清洁李世环李敏才
刘 菲,李清洁,李世环,李敏才
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院基础医学院)
血管钙化(vascular calcification,VC)是钙盐、磷酸盐等矿物质沉积于血管壁的过程[1],已经成为动脉粥样硬化、糖尿病、高血压及慢性肾病等疾病发生率和死亡率增加的独立危险因素[2]。近年来的研究证实VC是主动的可调控的钙盐及磷酸盐高度有序矿化,类似于骨发育生物学过程[3]。血管平滑肌细胞(vascular smooth muscle cell,VSMCs)表型转化是VC的重要现象,VSMCs蛋白合成增加,产生大量细胞外基质,分泌骨相关蛋白,促进VSMCs转分化为骨样细胞,从而导致血管钙化。前期实验[4-6]已经诱导VSMC表达成骨样细胞表型,并阐明了micro-206可以抑制VSMC表型转化。
p53是细胞生长周期中的负调节因子,对细胞生长周期调控发挥重要作用。人体AS斑块中p53表达上调,与血管壁细胞凋亡调节有关。Zheng等[7]报道p53介导肿瘤中上皮-间质转化现象,Li等[8]报道p53介导心肌梗死中内皮细胞转化为成纤维细胞,参与纤维修复,Ubil等[9]报道心肌梗死后,增强的p53表达促进心肌成纤维细胞转分化成上皮细胞。我们推测p53与VC中VSMC表型转化调控密切相关,为此,我们建立小鼠动脉硬化模型,给予p53抑制剂/激动剂药物,观察其对血管钙化的影响,期望对VC调控提供新的靶点和数据资料。
1 材料与方法
1.1 动物
21只apoE-/-雄性小鼠,6~8周龄,体质量约23g,购买于北京Charles river实验动物技术有限公司。动物合格证号:SYXK(鄂)2019-0031。动物饲养于SPF级动物房,温度控制在21℃~27℃,湿度控制在50%~60%,维持昼夜节律。
1.2 试剂和仪器
油红O染液(索莱宝公司),苏木素染液(索莱宝公司),伊红染液(索莱宝公司),茜素红染液(塞维尔公司),体视显微镜(Mshot公司)。
1.3 方法
1.3.1 VC模型构建
21只雄性6~8周龄apoE-/-小鼠,高脂饮食饲养12周后,将小鼠随机分为3组,每组7只,对照组(Con组)、p53激动剂Parthenolide(Par组)、p53抑制剂Pifithrin/-u(PFT-u组)。Par组每只小鼠经腹腔注射5mg/(kg·d)剂量[10]的Parthenolide,PFT-u组每只小鼠经腹腔注射3mg/(kg·d)剂量[11]的Pifithrin/-u,继续饲养4周,对小鼠胸主动脉、颈总动脉予以取材。
1.3.2 油红O染色
取油红O粉末0.5g,溶于100mL异丙醇,混匀,用滤纸过滤得油红O储备液,4℃避光保存。以储备液∶超纯水=3∶2比例配置油红O溶液,混匀后,经0.22μm过滤头过滤,静置10min。血管用60%异丙醇浸泡30min,放入油红O溶液中漂染3h,60%异丙醇溶液洗至胸主动脉背景干净。体视显微镜下观察拍照。
1.3.3 茜素红染色
石蜡切片经常规脱蜡至水化,将切片放入盛有茜素红染液的染缸里5~10min进行染色,然后用自来水冲洗,将切片放到烘箱内将水分烤干,盖玻片封片最后用显微镜进行图像采集。
1.3.4 HE染色
石蜡切片经常规脱蜡至水化,将切片放入苏木素染液中,染3~5min后用自来水冲洗约2min,1%盐酸乙醇酸化15s,水洗约2min,0.6%氨水返蓝1min,继而水洗约4min,切片入伊红染液中染色30s,水洗2min,脱水封片,显微镜镜检,采集图像。
1.3.5 血管环功能测定
取材后,在体式显微镜下迅速将胸主动脉周围的多余脂肪剥离,然后剪取一段长约3mm的血管环,继用两根25μm的钨丝穿过血管环,将钨丝分别固定于张力浴槽的两端,且两根钨丝处于平行状态,用Krebs-Henseniet洗两次,每次15min,然后用氯化钾溶液预收缩5min,加入U46619收缩剂,稳定后依次加入不同浓度的乙酰胆碱(10-9、10-8、10-7、10-6、10-5),各个浓度作用时间约为5min,平衡5~10min后,更换Krebs-Henseniet液2次,平衡后加入U46619收缩剂,约45min稳定后依次加入不同浓度的硝普钠(10-9、10-8、10-7、10-6、10-5),作用时间约为5min。记录数据。
1.4 统计学方法

2 结 果
2.1 p53抑制剂减少主动脉血管粥样硬化斑块
如图1A显示,小鼠胸主动脉与腹主动脉部分组织染成红色,表明均有斑块形成。定量分析血管斑块面积与血管总面积,如图1B显示,与Con组相比,PFT-u组斑块面积/整体面积比值明显降低(P<0.05),Par组斑块面积/整体面积比值显著升高(P<0.05);与Par组相比较,PFT-u组斑块面积/整体面积比值显著性下调(P<0.01)。表明p53抑制剂抑制动脉粥样硬化形成,p53激动剂加重动脉粥样硬化斑块进展。
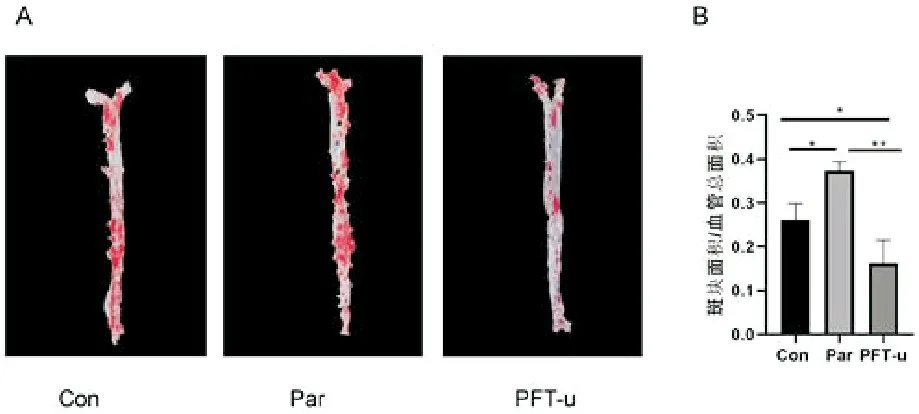
A.主动脉大体油红O染色;B.定量分析斑块面积/整体面积比值(*P<0.05,**P<0.01,n=3)
2.2 p53抑制剂抑制动脉粥样硬化斑块形成
如图2A(封三)结果显示,小鼠颈总动脉管壁增厚、斑块形成,管腔均有一定程度的狭窄。为检查斑块对血管狭窄程度的影响,以斑块面积/血管腔面积比值进行定量分析。与Con组相比,PFT-u组斑块面积/血管腔面积比值降低,具有显著性差异(P<0.05);Par组斑块面积/血管腔面积比值上调,没有显著性差异(P>0.05)。与Par组相比,PFT-u组斑块面积/血管腔面积比值下调,具有极其显著性差异(P<0.01)。结果表明p53抑制剂抑制动脉粥样硬化斑块形成,缓解斑块造成的动脉血管狭窄。
2.3 p53抑制剂减弱动脉粥样硬化斑块内膜的增生
如图3A(封三)染色结果显示,Con组动脉血管壁斑块处结构紊乱,斑块处内膜增厚,内弹力膜结构比较模糊;Par组动脉血管壁斑块处内膜增厚严重,内外弹力膜消失;PFT-u组动脉血管斑块处内膜增厚减弱,内外弹力膜较为清晰、完整。为确定p53抑制剂对内膜增厚的影响程度,以内膜面积/血管总面积比值进行定量分析,如图3B所示:与Con组相比,PFT-u组血管内膜面积/血管总面积比值降低,具有显著性差异(P<0.05);Par组血管内膜面积/血管总面积比值升高,具有显著性差异(P<0.05);与Par组相比,PFT-u组血管内膜面积/血管总面积比值降低,具有极其显著性差异(P<0.01)。结果表明,p53抑制剂减弱动脉粥样硬化斑块内膜增生,缓解血管腔狭窄。
2.4 p53抑制剂改善主动脉血管功能
取apoE-/-小鼠主动脉血管环,先加入U46619引起血管进行收缩,待测定系统平衡后,加入不同浓度的乙酰胆碱和硝普钠舒张血管,检测并记录血管舒张程度。结果如图4A显示,在乙酰胆碱作用下,与Con组相比,PFT-u组小鼠胸主动脉舒张功能升高,具有显著性差异(P<0.05);Par组小鼠胸主动脉舒张功能降低,无显著性差异。与Par组相比,PFT-u组小鼠胸主动脉舒张性显著升高(P<0.05)。在硝普钠的作用下,结果如图4B显示:与Con组相比,PFT-u组小鼠胸主动脉舒张功能升高,无显著性差异;Par组小鼠胸主动脉舒张功能降低,无显著性差异;与Par组相比,PFT-u组小鼠胸主动脉舒张性显著升高(P<0.05)。结果表明p53抑制剂能上调动脉粥样硬化血管的舒张功能。

A.主动脉在乙酰胆碱作用下的舒张作用;B.主动脉在硝普钠作用下的舒张作用(*P<0.05,n=3)
3 结 论
心血管疾病(cardiovascular diseases,CVD)是世界上造成死亡和致残的主要原因,它代表着全球性的健康问题,CVD的特征是一系列疾病,与多种危险因素之间的复杂相互作用有关[12]。动脉粥样硬化是引起心血管疾病死亡的主要原因,是以脂质沉积和斑块形成为主要特征的慢性进行性血管炎症[13]。血管钙化是指血管细胞异位矿化[14],是一个活跃而复杂的过程,涉及钙在动脉壁中沉积的多种机制。研究VC发病机理及调控机制具有非常重要的临床意义,我们建立动脉粥样硬化模型,模拟VC病变过程,并研究其病变的形态学特征。
p53是经典的肿瘤抑制基因,是细胞生长周期中的负调节因子,对诱导细胞生长周期抑制和凋亡发挥重要作用;同时p53是重要的应激-反应基因,参与细胞重新编排[15]。我们在本研究中发现p53抑制剂减少动脉粥样硬化斑块面积、减少血管管腔狭窄、抑制动脉内膜增生,改善胸主动脉血管功能。
Tataria等[16]发现p53基因可以结合到软骨瘤osterix启动子区域,对软骨细胞分化标志物之表达有重要调节作用,促进osterix、Cbf1a/Runx2、ALP等成骨细胞因子表达。已有研究表明[17],VSMC在氧化应激、炎症和机械损伤等刺激下,向具有分泌功能细胞转化,分泌骨形成相关蛋白,如骨形态发生蛋白(bone morphogenic protein-2,BMP2)、碱性磷酸酶(alkaline phosphatase,ALP)等蛋白,促进钙化形成。我们的研究结果符合这些研究现象,p53可以参与血管平滑肌细胞向成骨样细胞转分化,抑制血管平滑肌细胞向成骨样细胞转分化,从而抑制动脉粥样硬化的斑块形成,这为动脉血管硬化的治疗又提供了一条新思路。
