千金藤素对胰腺癌细胞凋亡作用的研究*
2021-12-29梁瑞华陈红霞
梁瑞华,吴 娜,陈红霞,任 平
(湖北科技学院药学院,湖北 咸宁 437100)
胰腺癌是最致命的恶性肿瘤之一,患者确诊时往往已处于晚期,因此,大多数治疗方案效果不佳,预后差,其5年生存率低至2%[1-2]。目前已有许多文献[3-5]报道胰腺癌患者对一线化疗药物吉西他滨耐药,因此,寻求新的用于治疗胰腺癌的药物非常必要。千金藤素(cepharanthine,CEP)是一种从防己科千金藤属植物千金藤中提取的活性成分,属于异喹啉类生物碱,具有抗疟疾、抑菌、调节免疫、抗肿瘤等药理功能[6]。有研究[7-8]表明CEP能够抑制结直肠癌、黑色素瘤、肺癌等肿瘤细胞的增殖,但是,关于CEP对胰腺癌作用的研究报道很少。我们主要探讨CEP对胰腺癌AsPC-1细胞的作用,为CEP治疗胰腺癌提供重要的理论依据。
1 材料与方法
1.1 材料
人胰腺癌AsPC-1细胞株由华中科技大学实验室赠送;CEP购自上海阿拉丁生化科技股份有限公司,纯度>98%;DMSO购自Sigma;胎牛血清购自BI;RPMI-1640培养基购自美国Hyclone公司;双抗购自Gibco;MTT购于上海碧云天生物科技公司;PARP、caspase-3、cleaved-caspase-3、cleaved-casepase-9和β-actin抗体购自万类生物科技公司;ECL发光剂购自大连美仑生物技术公司;凋亡试剂盒、台盼蓝染液购自上海碧云天生物科技公司。
1.2 实验方法
1.2.1 细胞培养
胰腺癌细胞AsPC-1培养于含10%小牛血清、1×105U/L青霉素和100mg/L链霉素的RPMI-1640培养液中,置于37℃、5%CO2、饱和湿度培养箱中培养。每隔2d传1次代。
1.2.2 MTT法检测细胞活力
取对数生长期的AsPC-1细胞调整细胞悬液浓度,以每孔8 000个细胞接种于96孔板中,当细胞生长融合至70%~80%时,各组中加入100μL不同浓度(0、2.187 5、4.375、8.75、17.5、35μmol/L)的CEP处理48h,对照组中加入100μL的培养基,每个浓度设置5个复孔,置于37℃、5%CO2的培养箱中培养,药物作用结束后,加入10μL用PBS配置的MTT溶液,然后将培养板重新置于培养箱中继续作用,4h后用200μL枪轻轻弃去培养板中的上清,随后每孔加入150μL DMSO,用酶标仪测定490nm波长处各孔的吸光度(OD)值,取平均值,计算给药后的细胞存活率,实验重复3次,求出3次给药后细胞抑制率。
1.2.3 细胞形态学观察
将胰腺癌AsPC-1、BxPC-3细胞分别接种到6孔板中,待细胞长到70%左右开始给药。将AsPC-1细胞分为对照组、CEP低剂量(17.5μmol/L)组和CEP高剂量(35μmol/L)组。48h后,采用倒置显微镜20×观察细胞形态的变化。
1.2.4 台盼蓝染色
取出六孔板,加入PBS洗一遍,加入胰酶对细胞进行消化,待细胞变圆后加入适量的PBS稀释,并用枪吹打混匀。取适量台盼蓝染液对细胞进行避光染色,数分钟后,吸取10μL经过染色后的细胞,均匀打入计数池中,在光学显微镜下用细胞计数器计数细胞,统计出蓝色细胞和细胞总数。分别统计千金藤素对照组、千金藤素CEP低浓度组和千金藤素CEP高浓度组作用48h后细胞活力值:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)%,实验重复3次,并求出平均值。
1.2.5 细胞凋亡检测
将AsPC-1细胞按1×106个/孔铺于6孔板中37℃恒温箱培养48h,分别用低剂量(17.5μmol/L)和高剂量(35μmol/L)的CEP作用AsPC-1细胞,48h后,取出6孔板至超净台,把细胞培养液吸出,并用PBS洗涤板中细胞一次,加入适量胰酶细胞消化液消化细胞。细胞培养箱中孵育3min后轻轻吹打孔板,使细胞吹打下来,将其移至1.5mL离心管中,1 000g离心3min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数5~10万细胞重悬,1 000g离心5min,弃上清,加入195μL Annexin V-FITC结合液于离心管中,混匀,再加入10μL碘化丙啶(PI)染色液,混匀,室温避光孵育15min,上机检测。实验重复3次。
1.2.6 Western blot法检测蛋白表达水平
取对数生长期AsPC-1细胞以2×105接种于6孔板中,置培养箱培养过夜。对照组给予正常培养液,给药组分为CEP低剂量(17.5μmol/L)组、高剂量(35μmol/L)组,48h后,取出培养板,收集细胞,提取总蛋白,用BCA法测定不同浓度给药组的蛋白浓度,分别定量后,将蛋白样品加入到配制好的丙烯酰胺凝胶泳道中电泳分离,然后将凝胶中的蛋白转移至PVDF膜上,用含5%的脱脂牛奶将膜室温封闭90min,封闭完成后用TBST清洗膜3次,分别加入对应一抗PARP(1∶1 000)、caspase-3、cleaved-caspase-3(1∶1 000)、cleaved-caspase-9(1∶1 000)和β-actin(1∶1 000),4℃孵育过夜,TBST洗膜3次,然后加入对应羊抗兔二抗(1∶12 000),室温摇床孵育1h后,TBST洗膜3次,ECL发光试剂盒发光显影,定影后进行条带分析。实验重复3次。
2 结 果
2.1 CEP对胰腺癌AsPC-1细胞增殖和活力的影响
采用MTT法检测CEP对胰腺癌AsPC-1细胞活力的影响。不同浓度(0、2.187 5、4.375、8.75、17.5、35μmol/L)的CEP作用于AsPC-1细胞48h,随着药物浓度的增加,CEP对细胞活力的抑制逐渐增强(P<0.01),见图1,提示CEP作用于AsPC-1细胞后,细胞活力呈浓度依赖性被抑制。

与control组相比,*P<0.05,**P<0.01,***P<0.001,n=3
2.2 细胞形态学观察
药物作用分别作用于胰腺癌AsPC-1细胞48h,加入PBS洗两遍,再加入适量的PBS,倒置显微镜下观察AsPC-1细胞的形态学变化,给药组细胞脱落数目明显增多,并且给药剂量越高,细胞脱落数目越多,细胞皱缩变圆细胞所占比例也更多,如图2(封二)所示。
2.3 AsPC-1细胞给药48h后台盼蓝染液细胞活性的检测结果
将AsPC-1细胞分别设置3个给药浓度,AsPC-1细胞对照组、CEP低剂量组、CEP高剂量组,给药48h后,用台盼蓝对给药后细胞活性进行检测,随着剂量的增大,细胞存活率越来越低,其结果有统计学意义(P<0.01)。结果如图3所示。
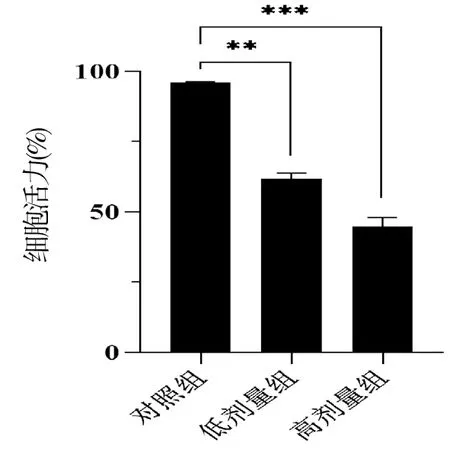
与对照组相比,**P<0.01,***P<0.001,n=3
2.4 细胞凋亡检测结果
通过Annexin V-FITC和PI染色结果发现,对照组与低剂量和高剂量给药组相比,AsPC-1细胞48h凋亡率有统计学差异(P<0.05),见图4(封二)、图5。

与对照组相比,*P<0.05,**P<0.01,n=3
2.5 CEP对胰腺癌AsPC1细胞凋亡相关蛋白表达的影响
用Western blot法检测凋亡相关蛋白的表达情况。结果显示,在低剂量组和高剂量组CEP作用下,与对照组相比,凋亡相关性蛋白PARP、cleaved-caspase-3和cleaved-caspase-9的表达水平显著升高(P<0.05),见图6、7。这说明CEP可诱导胰腺癌细胞AsPC-1细胞凋亡。

与对照组相比,*P<0.05,**P<0.01,n=3
3 讨 论
近年来胰腺癌发病率一直在不断上升,其发病率和死亡率基本相同,靶向治疗成为胰腺癌患者的选择之一,但靶向药物存在价格昂贵、不良反应严重等不足[9]。近年来采用全胰切除术,此方案使胰腺癌的生存期有所延长,但是治疗周期较长,并且易转移至肝脏[10-11]。用于胰腺癌治疗的药物主要以吉西他滨为主,但是胰腺癌细胞株很容易对吉西他滨产生耐药,因此,研究用于治疗胰腺癌的新药是非常有意义的。
CEP是日本自20世纪50年代以来用于治疗一些急慢性疾病的药物,它是唯一批准用于人类的双苄异喹啉类生物碱类药物[12]。CEP具有多种医用效果,并且有多种方式来抑制肿瘤。我们结果显示不同浓度的CEP作用于人胰腺癌AsPC-1细胞,随着药物作用浓度增加,其细胞增值率和活性不断降低,表明CEP对胰腺癌AsPC-1细胞具有抑制作用。有文献[13-14]报道CEP通过巨噬细胞、T细胞、NK细胞等对肿瘤细胞产生抑制作用。癌细胞凋亡机制一直是抗癌研究的热点,这一过程与肿瘤的发生、发展密切相关,这是在基因的调控下主动程序性死亡,其中最主要过程之一是线粒体凋亡。线粒体在相关的信号作用下,开放通透性转换孔。离子的进出改变了膜的电位。线粒体膜的相关功能在此反应下丧失,引发导致细胞凋亡的caspase家族级联反应。另外ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)不仅是修复DNA损伤相关的酶,而且还是caspase的切割底物。因此,caspase家族、PARP是检测肿瘤凋亡的重要指标。
CEP可以抑制子宫内膜癌、乳腺癌细胞的生长并能够促使这两种细胞凋亡的发生[15-16]。CEP在Jurka和K562细胞系中能够促使凋亡相关蛋caspase-9、caspase-3以及PARP的剪切[17]。但是目前尚未有很多有关CEP对胰腺癌抑制作用的报道。基于以上,CEP能否抑制胰腺癌细胞的增殖并且能够促使其凋亡具有重大意义。我们使用不同浓度的CEP作用于人胰腺癌AsPC-1细胞,MTT结果检测发现随着药物作用浓度的增加,AsPC-1细胞的存活率不断降低,通过细胞形态学观察我们发现随着药物浓度的增大,细胞变大、皱缩程度所占比例不断增多,剂量越大细胞变形程度也越明显。台盼蓝染色发现随着给药剂量升高,细胞存活率逐渐降低。并且通过对Western blot实验结果的分析我们发现,不同给药组细胞凋亡相关蛋白PARP、cleaved-caspase-3、cleaved-caspase-9相比于正常对照组表达量均有上调。流式凋亡结果显示,给药后AsPC-1细胞的早期凋亡率和晚期凋亡率均有所增加。
综上所述,CEP有诱导胰腺癌细胞株凋亡的作用。但本实验仅使用了一种人胰腺癌细胞株,关于CEP具体通过什么机制诱导AsPC-1细胞凋亡并未予以探讨,并且CEP在体内作用情况也有待于探究,存在很多不足之处,因此,在以后的实验研究中将继续进行研究。
