补骨脂定对骨髓间充质干细胞向癌相关成纤维细胞分化的抑制作用*
2021-12-29钟媚共阮晓红郑明珠陆文洁陈莎莎林碧华郑焱张鑫
钟媚共,阮晓红,郑明珠,陆文洁,陈莎莎,,林碧华,郑焱,张鑫
[1.江门市妇幼保健院药学部,江门 529000;2.江门市中心医院妇科,江门 529030;3.江门市中心医院中心实验室,江门 529030;4.广东医科大学基础医学院生物化学与分子生物学教研室,东莞 523808;5.广东省人乳头状瘤病毒(HPV)相关疾病分子诊断工程技术研究开发中心,潮州 521021]
乳腺癌、宫颈癌、子宫内膜癌和卵巢癌是最主要的4种女性特发恶性肿瘤,其对应的2018年全球估算的女性新发病率分别是每10万人45.3,13.1,8.4和6.6例,占全部女性肿瘤患者的38.6%,是威胁全球女性健康的重要风险因素[1]。对于中晚期患者,化学治疗(化疗)是关键的治疗方法,但是化疗不敏感及诱导耐药的情况时有发生。研究表明[2-3],癌细胞化疗抵抗的获得与肿瘤微环境的组成密切相关,特别是癌相关成纤维细胞(carcinoma associated fibroblasts,CAFs)对肿瘤细胞的支持在其中起到关键作用。
CAFs细胞一般源于被肿瘤细胞激活招募的成纤维细胞或肌成纤维细胞,也能由间充质干细胞(mesenchymal stem cells,MSCs)在肿瘤细胞招募诱导下分化而成。而α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是MSCs分化成CAFs后所特征性表达的基因之一[4- 5]。有研究报道,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)能被招募到肿瘤组织,并向CAFs方向分化,对肿瘤起促进作用[5- 6];但非成体固有的脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)在归巢至肿瘤组织后,却常起着抑癌作用[7- 8],而 UCMSCs是否能被诱导成CAFs还存争议。
补骨脂定(psoralidin)为中药补骨脂的药效成分之一,属于香豆素类化合物,具有抗骨质疏松、调控细胞分化和抗肿瘤等作用。研究指出,补骨脂定能促进BMSCs向成骨细胞分化并抑制其向脂肪细胞分化[9-11],表明补骨脂定在调控BMSCs分化中起重要作用。因此,笔者通过观察BMSCs、UCMSCs与4种女性特发恶性肿瘤细胞共培养后,向CAFs方向分化的情况,探讨补骨脂定对MSCs向CAFs方向分化的作用,以及对共培养体系中癌细胞的影响。
1 材料与方法
1.1试剂与仪器 补骨脂定购自上海阿拉丁公司,为高效液相色谱对照品,含量:98%,批号:P168140。DMEM/F12培养液、RPMI-1640培养液、MEM培养液、McCoy's 5A培养液、Opti-MEN培养液、胎牛血清(fetal bovine serum,FBS)、L-谷氨酰胺和100×青霉素-链霉素(penicillin/streptomycin,P/S)为美国ThermoFisher公司产品;孔径3.0 μm的PET聚酯膜细胞嵌入皿(Transwell小室培养皿)购自广州洁特公司;细胞增殖毒性检测(CCK-8)试剂盒(批号:CK04)购自日本同仁公司;针对STAT3(批号:9139)、p-STAT3 (Y705)(批号:9145)、JAK2(批号:74987)、p-JAK2 (Y1007/1008)(批号:3776)和α-tubulin(编号:2125)的抗体和Alexa Fluor 488标记的抗小鼠二抗(批号:4408)购自美国Cell Signal Technology公司;针对α-SMA(批号:ab32575)的抗体购自美国Abcam公司。Synergy2多功能酶标仪为美国BioTek公司产品,Mini-Protean电泳和Mini Trans-Blot转膜设备为美国BIO-RAD公司产品,HD9 Touch多功能成像系统为英国UVITEC公司产品,Gallios流式细胞仪为美国Beckman Coulter公司产品。
1.2细胞及培养条件 人骨髓间充质细胞(hBMSCs)、人脐带间充质干细胞(hUCMSCs)、人乳腺癌细胞(BT-549)、人子宫内膜癌细胞(HEC-1B)、人宫颈癌细胞(Hela)和人卵巢癌细胞(SK-OV-3)购自武汉普诺赛公司,均通过短串联重复序列鉴定,经规范培养、传代扩增后,冻存于江门市中心医院中心实验室(临床生物资源库)的液氮罐中。hBMSCs的完全培养基为10% FBS、2 mmol ·L-1L-谷氨酰胺和1% P/S的DMEM/F12培养液,hUCMSCs的完全培养基为人MSCs无血清培养基(武汉普诺赛公司),BT-549的完全培养基为10% FBS和1% P/S的RPMI-1640培养液,HEC-1B、Hela的完全培养基为含10% FBS和1% P/S的MEM培养液,SK-OV-3的完全培养基为含10% FBS和1% P/S的McCoy's 5A培养液;细胞换液、传代、冻存及复苏均按常规操作,所有细胞的培养环境均为5% 二氧化碳(CO2)、37.5 ℃恒温恒湿。
1.3Transwell小室共培养体系 在Transwell共培养体系中,根据实验目的,分别将MSCs或癌细胞接种在小室内(上室)或培养皿中(下室),接种密度均为(500±100)·(cm2)-1;铺板前按常规消化处理细胞,并在共培养体系中加入适量的癌细胞完全培养液润湿,铺板时,用癌细胞完全培养液稀释MSCs和癌细胞,先铺下室,再铺上室,尽量让细胞分布均匀,正常培养72 h。
1.4CCK-8法测量细胞活性 如课题组前期报道所述[12],细胞消化、计数并铺板,正常培养过夜;补骨脂定对hBMSCs活性抑制实验中,浓度梯度为0.1,0.5,1.0,5.0,10.0,50.0和100.0 μmol·L-1,1% 二甲亚砜为对照组,正常培养为参照组;在共培养体系中,待各细胞完全贴壁后,小心用含10.0 μmol·L-1的癌细胞完全培养液换液;均给药培养72 h后,换含10% CCK-8的空白培养液,正常孵育1 h,测定各孔在波长450 nm处的吸光度,按下列公式计算:
抑制率=1-吸光度实验组或对照组/吸光度参照组
所得数据输入CompuSyn软件,参考说明及文献[13],计算对应的半数抑制浓度(half maximal inhibitory concentration,IC50)。在计算不同处理因素对细胞活性变化的影响时,设立对应的实验分组,如上进行操作,按下列公式计算:
活性率=吸光度实验组/吸光度对照组×100%
1.5流式细胞术法分析细胞α-SMA表达阳性率 按实验分组(二甲亚砜+hBMSCs组、补骨脂定+hBMSCs组、二甲亚砜+hUMSCs组、补骨脂定+hUMSCs组)处理细胞后,消化并用中性甲醛室温固定,甲醇冰浴通透;PBS洗涤后,一抗工作液(稀释度为1:50),室温孵育2 h,0.5% BSA-PBS洗涤,二抗工作液(稀释度为1:500),室温孵育1 h,0.5% BSA-PBS洗涤;PBS重悬细胞后,流式细胞分析仪检测,调整并收集每个样品的前散射光(FSC)、侧散射光(SSC)和绿光(α-SMA/Alexa Fluor 488)3个通道的信号,并以FSC/SSC作散点图圈出主细胞群,再以α-SMA/Alexa Fluor 488对主细胞群作图,以单加二抗的正常培养的MSCs为阴性参照,分出α-SMA/Alexa Fluor 488阳性细胞群,并计算各组阳性率。
1.6Western blotting检测蛋白质及蛋白质磷酸化水平 细胞总蛋白提取使用RIPA裂解液,使用前加入蛋白酶抑制剂混合物及蛋白磷酸酶抑制剂混合物,冰上裂解、超声破碎;蛋白定量用二喹啉甲酸蛋白定量试剂盒,并按说明书操作。裂解液上样前加入按上样缓冲液,100 ℃热变性。使用十二烷基硫酸钠-聚丙烯酰胺凝胶蛋白电泳系统,上样量为50 μg总蛋白,电泳参数为8%~12%分离胶、5%浓缩胶,100 V电泳至溴酚蓝指示剂迁移至底部后,进行电转移,使用孔径为0.2 μm的聚偏二氟乙烯膜,300 mA冰浴电转90 min。电转结束后,膜使用5%脱脂奶粉封闭,TBST漂洗,加入稀释的一抗工作液[稀释度:STAT3为1:1000、p-STAT3 (Y705)为1:2000、JAK2为1:1000、p-JAK2 (Y1007/1008)为1:1000和α-tubulin为1:1000],4 ℃孵育过夜,TBST漂洗,加入稀释的二抗工作液(稀释度为1:2000),室温孵育,TBST漂洗,加入电化学发光液,UVITEC Alliance mini HD9多功能成像仪自动成像。
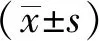
2 结果
2.1补骨脂定对MSCs及癌细胞活性的影响 CCK-8实验中,梯度浓度的补骨脂定处理hBMSCs和hUCMSCs达72 h,用CompuSyn软件求得补骨脂定对两种MSCs的IC50分别为477.34和364.83 μmol·L-1;其中在10 μmol·L-1浓度下,对两种MSCs活性的抑制率分别为(3.77±1.65)%和(3.70±2.11)%,均小于5%,故选为后续研究的浓度。此外,在10 μmol·L-1浓度下,对4种癌细胞(BT-549、HEC-1B、Hela和SK-OV-3)活性的抑制率分别为(8.17±3.04)%,(4.57±3.95)%,(7.79±5.69)%和(8.33±3.45)%,均小于10%。
2.2补骨脂定对MSCs向成纤维细胞分化的影响 用10 μmol·L-1补骨脂定处理2种MSCs达72 h,流式细胞术分析hBMSCs和hUCMSCs中α-SMA表达情况见图1,如图1所示,相对于二甲亚砜处理组,补骨脂定处理2种MSCs细胞后α-SMA的表达差异无统计学意义(P>0.05)。
2.3与癌细胞共培养体系中MSCs向CAFs分化的变化 在MSCs与癌细胞的Transwell共培养72 h后,流式细胞仪分析培养上室MSCs中α-SMA表达情况(表1)。结果显示,相对于单独培养对照组,hBMSCs与4种癌细胞共培养后α-SMA表达阳性率上升(P<0.05),但hUCMSCs在共培养体系中α-SMA表达阳性率变化无统计学意义(P>0.05)。
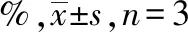
表1 与癌细胞共培养体系中MSCs的α-SMA表达阳性率 Tab.1 Positive expression rate of α-SMA in MSCs in co-culture system of cancer cells
2.4补骨脂定对共培养体系中MSCs向CAFs分化的影响 在MSCs与癌细胞的Transwell共培养体系中,用10 μmol·L-1补骨脂定处理72 h,流式细胞仪分析培养上室MSCs中α-SMA表达情况(表2)。结果显示,相对于二甲亚砜对照组,10 μmol·L-1补骨脂定能显著抑制hBMSCs中α-SMA的表达率(P<0.05),但不影响hUCMSCs中α-SMA的表达率(P>0.05)。
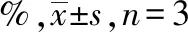
表2 4组共培养体系中α-SMA表达阳性率比较 Tab.2 Positive expression rate of α-SMA in four groups of co-culture system of cancer cells
2.5与MSCs共培养体系中癌细胞活性的变化 在MSCs与癌细胞的Transwell共培养72 h后,以癌细胞单独培养组为对照,CCK-8检测培养下室4种癌细胞的活性变化(表3)。结果显示,与hBMSCs共培养时癌细胞活性提高(t=22.01,11.34,15.93,16.06,P<0.05),但与hUCMSCs共培养时癌细胞活性降低(t=14.99,9.59,8.39,19.75,P<0.05)。
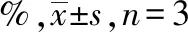
表3 与MSCs共培养体系中癌细胞活性的变化 Tab.3 Cell viability of cancer cells in co-culture system with MSCs
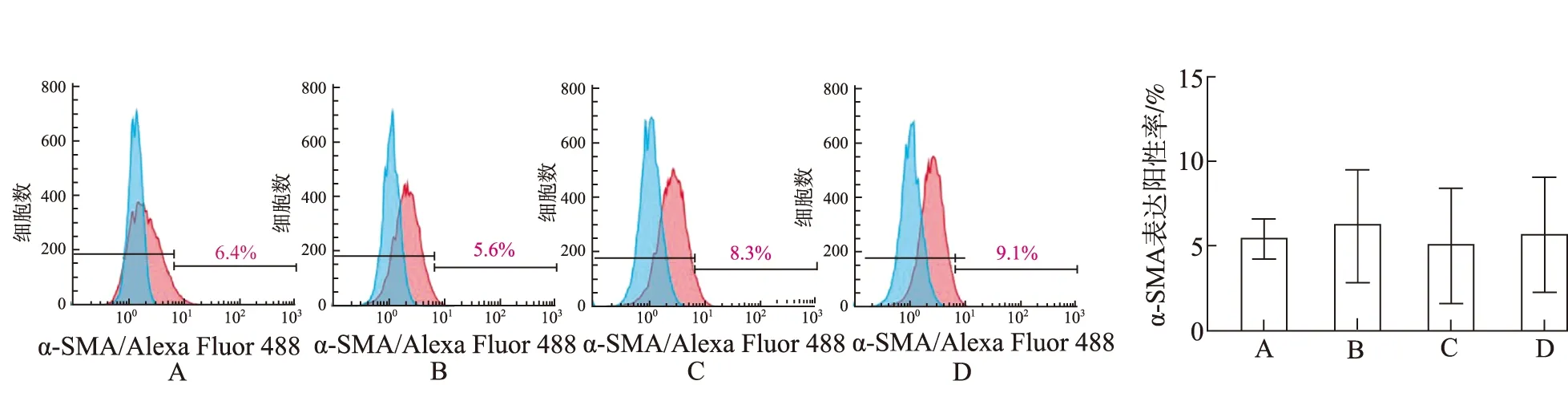
A.二甲亚砜+hBMSCs组;B.补骨脂定+hBMSCs组;C.二甲亚砜+hUCMSCs组;D.补骨脂定+hUCMSCs组。图1 流式细胞术检测MSCs中α-SMA的表达阳性率 A.dimethyl sulfoxide+hBMSCs group;B.psoraldin +hBMSCs group;C.dimethyl sulfoxide +hUCMSCs group;D.psoralidin +hUCMSCs group.Fig.1 Positive expression rate of α-SMA in MSCs determined by flow cytometry
2.6补骨脂定对共培养体系中癌细胞活性的影响 在MSCs与癌细胞的Transwell共培养体系中,以正常共培养组为对照,用10 μmol·L-1补骨脂定处理72 h,CCK-8检测培养下室癌细胞的活性变化(表4)。结果显示,在两种共培养体系中,相对于二甲亚砜对照组,10 μmol·L-1补骨脂定均能显著降低4种癌细胞的活性(hBMSCs共培养组:t=6.62,6.57,5.50,8.68,P<0.05;hUCMSCs共培养组:t=8.62,16.67,4.93,9.06,P<0.05)。
表4 4组共培养体系中癌细胞的活性比较 Tab.4 Cell viability of cancer cells in four groups of co-culture system of cancer cells
2.7与MSCs共培养体系中癌细胞p-JAK2和p-STAT3表达的变化 4种癌细胞单独培养或与2种MSCs共培养72 h后,以免疫印迹法检测癌细胞中p-JAK2和p-STAT3的表达情况(图2)。如图2所示,与hBMSCs共培养时,4种癌细胞的p-JAK2和p-STAT3表达明显上调,而与hUCMSCs共培养时2种蛋白表达明显下调。
2.8补骨脂定对共培养体系中癌细胞p-JAK2和p-STAT3表达的影响 在MSCs与癌细胞的Transwell共培养体系中,用10 μmol·L-1补骨脂定处理72 h,免疫印迹法检测培养下室中4种癌细胞的p-JAK2和p-STAT3表达情况(图3)。如图3所示,相对于二甲亚砜对照组,10 μmol·L-1补骨脂定能明显抑制与hBMSCs共培养癌细胞中p-JAK2和p-STAT3的表达,但在hUCMSCs共培养下,经补骨脂定处理后,4种癌细胞中p-JAK2和p-STAT3的表达变化均较小。
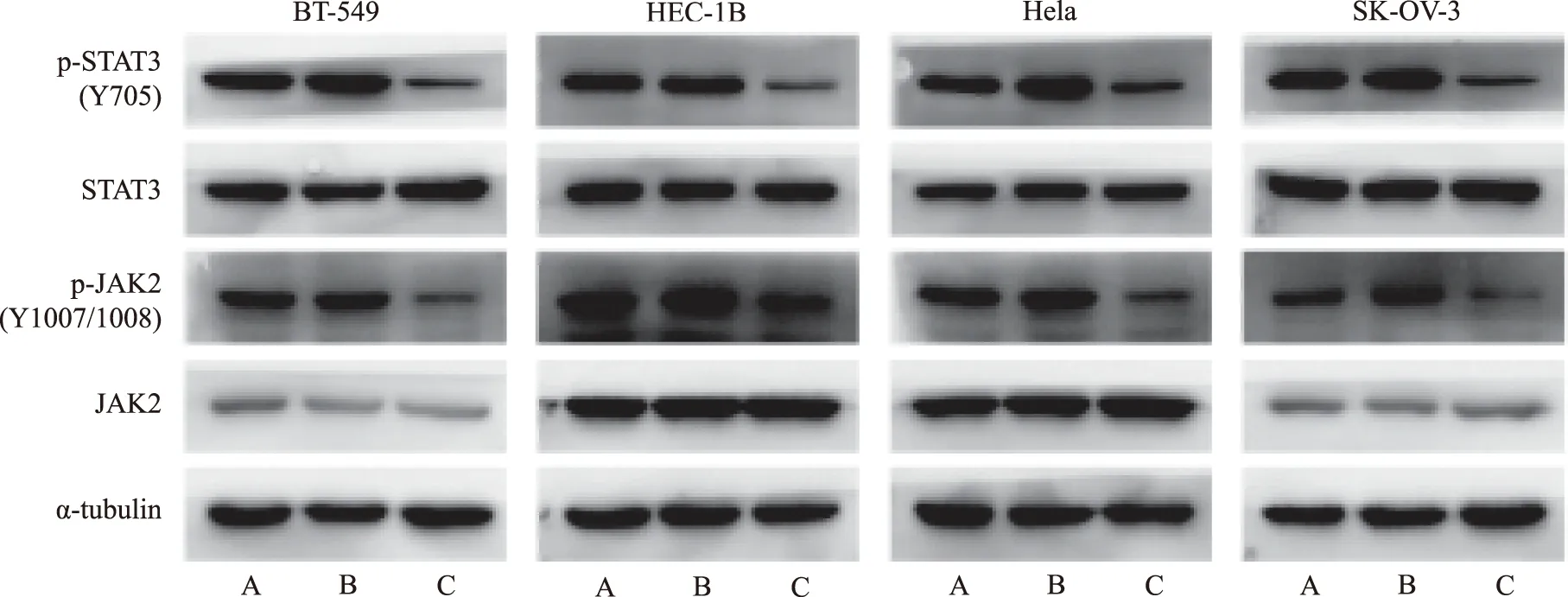
A.单独培养;B.与hBMSCs共培养;C.与hUCMSCs共培养。图2 与MSCs共培养体系中癌细胞p-JAK2和p-STAT3表达的变化 A.single cultivation;B.co-culture with hBMSCs;C.co-culture with hUCMSCs.Fig.2 Protein expression of p-JAK2 and p-STAT3 in cancer cells in co-culture system with MSCs
3 讨论
hBMSCs和hUCMSCs分别与4种女性特发恶性肿瘤细胞Transwell共培养体系显示,hBMSCs能促进癌细胞的增殖,而hUCMSCs则抑制癌细胞的增殖;相对应的是,4种癌细胞均能促进hBMSCs高表达α-SMA,但并不诱导hUCMSCs中α-SMA的表达。在临床观察及实验研究中,表达α-SMA被认为是成纤维细胞、肌成纤维细胞及周细胞的标志,在MSCs中不表达或表达量很低,同时也不在MSCs分化所得的成骨细胞中表达,可作为CAFs的蛋白标志物之一[5-6,14-16]。因此,本研究结果显示,hBMSCs在肿瘤细胞的诱导下向CAFs分化,并同时促进了癌细胞的恶性增殖,而hUCMSCs对肿瘤的抑制作用则可能与其不能被驯化成CAFs相关。
分化成CAFs的MSCs细胞可以通过分泌多种细胞因子,如碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、白细胞介素(IL)-6、转化生长因子(transforming growth factor,TGF-)等,直接或间接促进癌细胞的恶性表型[3];其中,白血病抑制因子(leukemia inhibitory factor,LIF)被认为是CAFs细胞促进癌细胞化疗耐受的关键[4],而上述细胞因子在作用于癌细胞的相应受体后,常共同激活JAK2/STAT3信号通路,进而激活上调与肿瘤恶性表型相关的基因,促进了肿瘤的各种恶性表型特征的出现[17]。因此,笔者观察了共培养体系中能反映癌细胞JAK2/STAT3信号通路激活水平的p-JAK2和p-STAT3表达情况。结果显示,与hBMSCs共培养的4种癌细胞中,p-JAK2和p-STAT3的表达水平均显著升高,而与hUCMSCs共培养的癌细胞中,p-JAK2和p-STAT3的表达水平变化较小,表明朝CAFs方向分化的hBMSCs能通过分泌因子来激活癌细胞中的JAK2/STAT3信号通路,而hUCMSCs则不能有效激活共培养的癌细胞中JAK2/STAT3信号通路。
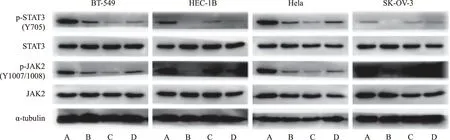
A.二甲亚砜+hBMSCs组;B.补骨脂定+hBMSCs组;C.二甲亚砜+hUCMSCs组;D.补骨脂定+hUCMSCs组。图3 补骨脂定对共培养体系中癌细胞p-JAK2和p-STAT3表达的影响 A.DMSO +hBMSCs group;B.psoralidin +hBMSCs group;C.DMSO +hUCMSCs group;D.psoralidin +hUCMSCs group.Fig.3 Effect of psoralidin on the expression of p-JAK2 and p-STAT3 in cancer cells in co-culture system with MSCs
此外,本研究还检测了补骨脂定对hBMSCs和hUCMSCs的活性影响情况,观察到补骨脂定不影响单独培养的MSCs及共培养的hUCMSCs中α-SMA的表达,但能显著抑制与4种癌细胞共培养的hBMSCs表达α-SMA;与此对应的是,10 μmol·L-1补骨脂定对4种癌细胞增殖活性的抑制作用并不明显(<10%),但能显著抑制与hBMSCs共培养的癌细胞活性,以及癌细胞中p-JAK2和p-STAT3的表达水平。这表明补骨脂定能抑制癌细胞对hBMSCs的驯化,降低癌细胞中JAK2/STAT3信号通路的活性,抑制癌细胞的恶性增殖。
虽然本研究结果是通过hBMSCs和hUCMSCs与癌细胞体外的Transwell共培养体系进行实验和检测的,但依然体现出不同MSCs在不同微环境状态下具有不同的功能,表明MSCs在临床应用中值得进一步观察和研究。补骨脂定能进一步降低hUCMSCs对癌细胞增殖活性的抑制,但其是否能加强hUCMSCs的抗癌作用及其机制仍需进一步研究。
