叶酸修饰壳聚糖在肿瘤靶向制剂中的研究进展*
2021-12-29冯自立孙茜陈旺胡代花白瑜朱志斌
冯自立,孙茜,陈旺,胡代花,白瑜,朱志斌
(1.秦巴生物资源与生态环境省部共建国家重点实验室,汉中 723001;2.陕西理工大学生物科学与工程学院,汉中 723001;3.陕西理工大学维生素D生理与应用研究所,汉中 723001)
癌症是全球第二大死亡原因,2018年全球癌症新发病例约有1810万例,因癌症死亡960万例,相比于其他国家,我国癌症发病率、死亡率居全球第一[1]。目前,癌症治疗最常见的方法是化学治疗(化疗),但其毒副作用大,易产生多药耐药性,对身体其他非癌变部位损伤严重。聚合物纳米粒子作为药物载体的靶向递送系统在肿瘤治疗和诊断具有里程碑意义[2]。利用肿瘤组织中特异性过表达的分子标记物可以实现肿瘤靶向药物递送,如整合素[3]、叶酸受体[4]、抗体[5]、细胞黏附分子[6]等。
1 壳聚糖及衍生物的性质和修饰
1.1壳聚糖 几丁质(图1)又称甲壳素,是由N-乙酰-2-脱氧-2-氨基-D-葡萄糖以β-l,4-糖苷键连接而成的多糖,广泛存在于虾蟹等海洋甲壳类动物的外壳和真菌、藻类的细胞壁等[7]。壳聚糖是甲壳素的脱乙酰化产物,是自然界中唯一的天然阳离子多糖。壳聚糖不溶于水和碱性溶液,可缓慢溶于稀酸溶液,形成黏稠透明的胶体溶液;其脱乙酰程度越高、相对分子质量越小,越易溶于水和稀酸溶液中[8]。壳聚糖具有良好的生物相容性、黏附性、可降解性、成膜性,且无毒性[9],是一种优良的药物载体,广泛用于制备微米和纳米递药载体粒子[10]。壳聚糖在水中可自组装成纳米尺寸的微球,因此被用作不同药物的潜在载体,例如小分子药物、多肽、蛋白质、DNA和肠胃外用药等[11]。壳聚糖微粒包载的药物理化性质更加稳定;对于水溶性差的药物,壳聚糖包载可以提高其溶出速率和利用率。
1.2羧甲基壳聚糖 壳聚糖的C-2氨基和C-6羟基可作为活性位点进行化学修饰,这些基团可以很容易被不同种类的配体、官能团进行修饰形成各种衍生物[12],从而更广泛地扩展壳聚糖的应用领域,例如:季铵化、羧甲基化、硫醇化、烷基化、酯化等。壳聚糖的化学改性使其具有可控的溶解性、离子特性和亲水性等。羧甲基壳聚糖(carboxymethyl chitosan,CMC)是壳聚糖的羧甲基衍生物[13],见图1。在壳聚糖结构中引入羧甲基能显著提高壳聚糖在中性和碱性pH值下的溶解度。由于形成羧酸盐、破坏壳聚糖的二级结构,降低了结晶度,使得CMC具有更好的水溶性。羧甲基壳聚糖在不同pH值环境下的水溶性受羧甲基化程度的控制,因此羧甲基壳聚糖具有较好的pH值敏感性。羧甲基壳聚糖会在羟基或氨基上发生取代[14],主要结构如图1所示,当取代度<1时,羧甲基的取代主要是在羟基上;当取代度接近1和高于1时,才会同时在氨基上发生羧甲基取代,形成O,N-羧甲基壳聚糖。羧甲基壳聚糖在水性介质中具有自组装特性[15],使其在水中很容易形成纳米颗粒,因此在药物递送、生物成像和基因治疗应用方面显示出巨大的潜力[14]。
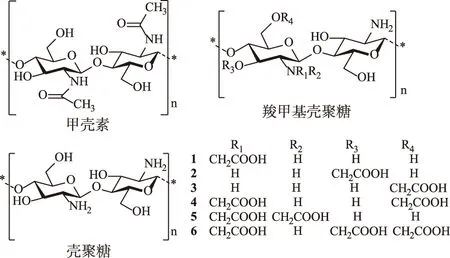
图1 甲壳素、壳聚糖、羧甲基壳聚糖结构式 Fig.1 Structure of chitin,chitosan and carboxymethyl chitosan
1.3壳聚糖及其衍生物的修饰策略 壳聚糖由于其无毒、生物相容性、可降解性、生物黏附性和阳离子特性,是一种极具潜力的药物载体。然而,壳聚糖在生理pH值(pH值>6)下的不良溶解度及靶向特异性较低,使得其在生物医学中的单独应用受到限制[16]。对壳聚糖进行化学修饰可以改变壳聚糖的物理化学性质,从而达到改善壳聚糖的溶解度、亲水性、亲脂性、靶向性,改变纳米粒子的粒径和Zeta电位等,使得壳聚糖衍生物具有更加广阔的应用空间。
1.3.1叶酸修饰的壳聚糖衍生物 解决壳聚糖靶向性不足最直接的策略是将具有靶向效应的分子化学键合到壳聚糖骨架上,例如抗体、激素、叶酸[17]。由于叶酸受体在肿瘤细胞表面过表达[18],叶酸可通过受体介导的细胞内吞作用靶向进入肿瘤细胞,利用叶酸作为靶向配体可以将多种药物有效载荷传递到叶酸受体阳性细胞,从而增强细胞对药物的摄取[19]。
叶酸可通过羧基与壳聚糖的C-2位氨基进行共价结合,从而在壳聚糖骨架引入叶酸。叶酸修饰的壳聚糖可以在水中形成平均粒径为50~400 nm、带有正电荷的纳米颗粒,可作为靶向载体将药物[20]、基因[21]等靶向递送到肿瘤组织,用于肿瘤的治疗或检测[22]。相对于传统剂型和单独的壳聚糖纳米粒子,叶酸-壳聚糖可以显著增强肿瘤细胞对药物的摄取、增加药物在肿瘤组织中的浓度,克服耐药性,减少药物的用量、降低药物不良反应。类似地,叶酸修饰的羧甲基壳聚糖除了叶酸-壳聚糖具有的性质外,还具有一定的pH值敏感性[23]和控释性[24]。
1.3.2功能基团修饰的叶酸-壳聚糖衍生物 在叶酸修饰的壳聚糖衍生物中,叶酸的取代度一般<10%,因此壳聚糖的C-2氨基和C-6羟基依然可作为活性位点进行化学修饰,从而对叶酸-壳聚糖衍生物进行进一步的改性(图2)。这些功能基团可以是亲水基团、疏水基团、磁性材料基团,可以是单一修饰也可以是组合修饰,不同的功能基团给予壳聚糖不同的性质,见表1。

表1 功能基团修饰的叶酸-壳聚糖 Tab.1 Functional group modified folate-chitosan
叶酸-壳聚糖衍生物经过功能基团的进一步修饰后,可以提高载药量、改变纳米粒子的粒径分布、赋予材料磁响应、温度敏感等特性,其结构修饰策略见图2。聚乙二醇修饰是增加叶酸-壳聚糖衍生物亲水性最常用的策略,聚乙二醇的修饰使得材料具有更好的溶解性和生物相容性,能更好地负载药物[25]或者基因[26],提高肿瘤靶向传递效率。胆酸类、脂肪酸类通过羧基与C-6羟基进行共价结合,可提高叶酸-壳聚糖衍生物的疏水性;从而使材料在水中形成具有疏水内核的纳米粒子,可以更好地负载水溶性较差的药物,提高载药量。类似地,磁性材料、温敏材料、光敏材料、碳纳米管等功能基团均可通过化学键与叶酸-壳聚糖衍生物进行耦联,从而赋予壳聚糖磁响应、温敏、光敏、荧光等特性。
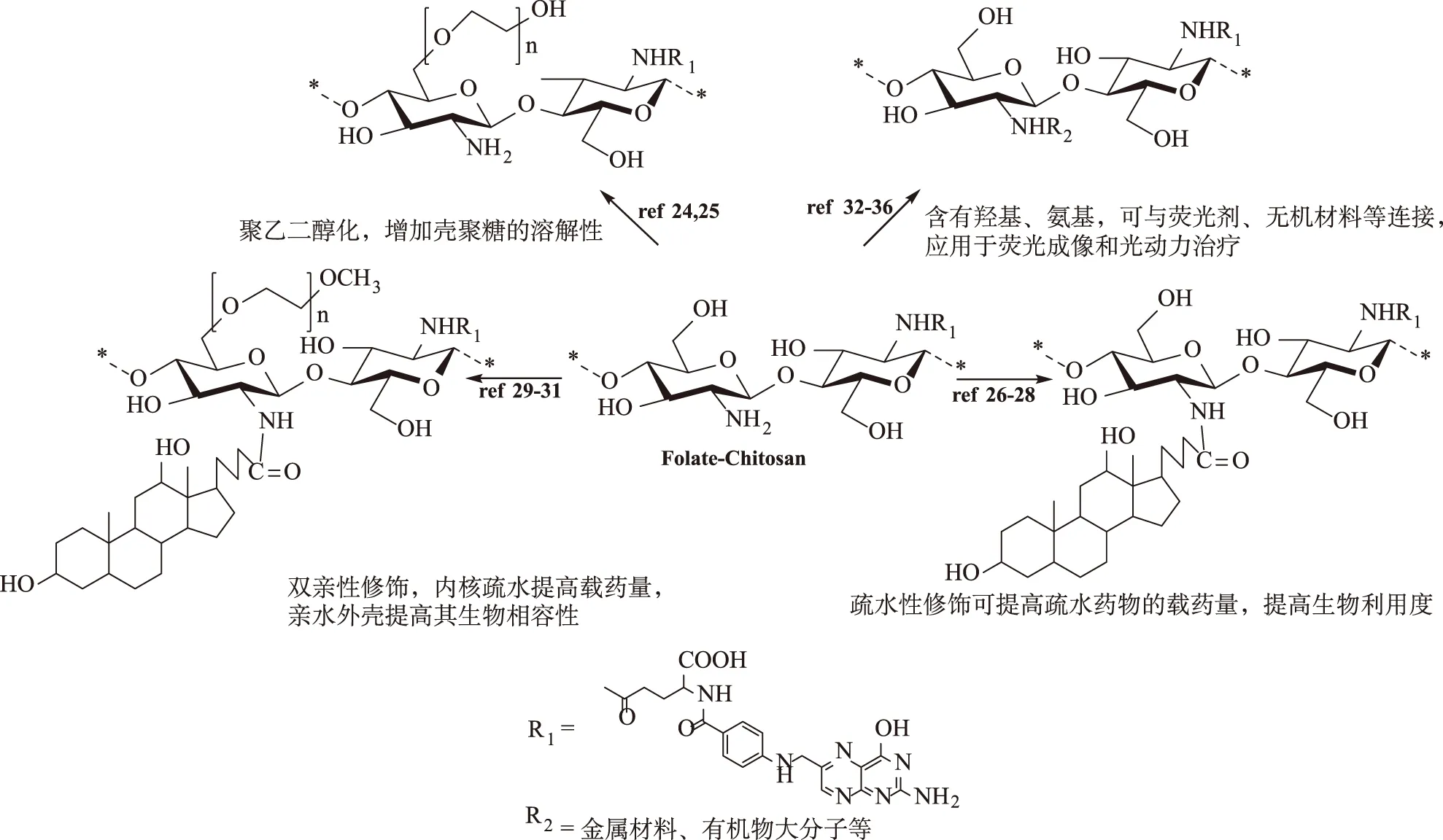
图2 功能基团修饰叶酸-壳聚糖的策略 Fig.2 Strategy of functional group modified folic acid-chitosan
2 肿瘤靶向制剂应用
靶向制剂也被称为靶向给药系统,是近年来生物医学研究的重点。靶向制剂利用载体、配体和抗体等靶向特异性材料将药物专一性地导向于靶器官、靶组织,而对非靶组织几乎没有相互作用。靶向制剂可以减少药物的使用量,增加其生物利用度,降低药物毒副作用。按其作用机制,可以将其分为主动靶向制剂、被动靶向制剂和响应性靶向制剂。
2.1主动靶向递送系统 叶酸-壳聚糖衍生物利用受体和配体的亲和作用直接靶向癌细胞,叶酸发挥“弹头”作用,将载有药物的纳米粒子靶向递送到特定细胞或组织,可以提高特定部位的药物浓度[17]。与普通纳米载体相比,使用叶酸耦联的壳聚糖纳米粒子,可以显著增加癌细胞的药物摄入量,并能降低抗肿瘤药物在体内的循环浓度,从而减轻不良反应[26]。
BEIDOKHTI等[20]制备了叶酸修饰的壳聚糖载甲氨蝶呤纳米颗粒(FA-CS-MTX NPs),体外活性评价表明相对于单纯的甲氨蝶呤,FA-CS-MTX NPs对Hela细胞具有更强的细胞毒活性。叶酸-壳聚糖的靶向性使药物在肿瘤组织局部形成较高浓度,而在其他组织中含量较低,即使包载大剂量的甲氨蝶呤,也可预防神经系统毒性。
YAN等[24]报道了叶酸修饰羧甲基壳聚糖(CMCS-FA)作为外壳封装肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-associated apoptosis induced ligand,TRAIL)和牛血清白蛋白包裹的藤黄酸颗粒,形成TRAIL/藤黄酸共传递纳米颗粒。在正常组织中CMCS-FA纳米颗粒可以保护TRAIL不被释放和吸收;而在酸性肿瘤组织中TRAIL释放并与质膜上的细胞凋亡受体结合,促进藤黄酸的定点、快速释放,CMCS-FA形成的药物载体可以增强藤黄酸的抗肿瘤效果并减少不良反应。
功能基团修饰的叶酸-壳聚糖衍生物具有更加优良的特性,可广泛用于抗肿瘤药物靶向传递、肿瘤成像系统等方面。具体见表1。
2.2被动靶向递送系统 被动靶向是增强实体瘤的通透性和滞留效应[39](enhanced permeability and retention effect,EPR)间接靶向肿瘤部位[40]。纳米颗粒在体内的分布主要取决于微粒的粒径大小,叶酸修饰的壳聚糖纳米粒子粒径为50~400 nm,可以较好地实现滞留效应。但在药物被动递送过程中,仍会存在一些问题,一是递药过程中,有大量的微颗粒进入正常组织器官,对正常细胞产生毒副作用;再者载药微粒在体内的释放不受控制,主要依靠载体材料自身降解进而发挥药物疗效;最后并非所有的肿瘤均存在EPR效应,例如血液类肿瘤不能以此方法进行治疗[41]。
2.3响应性递送系统 响应性药物递送系统的刺激主要分为两类:体外物理刺激和体内生物环境刺激[29,42]。体外物理刺激主要包括磁响应、光热刺激响应;体内生物环境刺激主要包括温度、pH值变化等。这些刺激会导致纳米粒子大小、Zeta电位、疏水性或载体材料发生变化,有利于药物的释放或者细胞的内吞作用,从而实现更有效的肿瘤细胞靶向。
类似地,叶酸-壳聚糖也可以包裹或者共价结合光敏系统,形成生物相容性的光敏纳米粒子,光响应系统通过外部光照射触发药物释放[48]或进行荧光成像[49]。MANIVASAGAN等[48]用叶酸-壳寡糖包裹负载有多柔比星的金纳米棒(FA-COS-TGA-GNRs-DOX)作为一种新的光热剂,用于药物的肿瘤靶向传递。FA-COS-TGA-GNRs-DOX具有良好的生物相容性和肿瘤细胞选择性,并对近红外区光有较强吸收,光热转换效率高,在808 nm激光照射下温度升高,引起多柔比星快速释放,有效杀伤肿瘤细胞。此外,磁性纳米颗粒与壳聚糖衍生物共价结合也能形成具有磁响应性的肿瘤靶向药物传递系统[36]。
由于肿瘤微环境的复杂性,很多时候仅一种外界环境的刺激,不能达到治疗的效果[50]。因此,现在很多研究学者开发出主被动结合、多刺激响应的纳米材料,MAHMOUD 等[51]设计可同时响应氧化应激和pH值的纳米颗粒,从而加速、定时释放封装蛋白。
3 结束语
壳聚糖是天然存在且含量丰富的多糖,具有较高的生物相容性、可降解性、pH响应性和良好的溶解性。壳聚糖的黏膜粘附性质能够改善药物吸收和生物利用度。壳聚糖由于伯氨基而具有阳离子特征,可以控制药物释放、黏膜粘附、转染、渗透增强等,可广泛用于不同药物的潜在载体。
叶酸改性壳聚糖在抗肿瘤药物靶向制剂中具有较好的应用前景。叶酸受体在肿瘤细胞大量存在,叶酸成为癌症治疗最重要的靶向基团之一。与其他靶向配体相比,叶酸具有稳定性好、价格低廉、易与聚合物骨架耦联、无免疫原性等优点。叶酸与壳聚糖共价结合不影响其与叶酸受体结合能力和细胞内吞过程。由于叶酸受体的高亲和力,叶酸耦联壳聚糖纳米粒可以在非常低的浓度下给药。叶酸壳聚糖衍生物纳米粒可以提高药物的溶解度和稳定性、控制药物释放、提高药物疗效、生物利用度、降低药物不良反应,在肿瘤特异性抗癌药物递送、基因治疗以及影像学诊断方面具有良好的应用潜力。
