中药饮片耐热微生物研究
2021-12-27张学博郁爱萍陆春胜
张学博 ,郁爱萍,陆春胜
(上海市崇明食品药品检验所,上海202150)
中药饮片系指中药材经过炮制后可直接用于中医临床或制剂生产使用的处方药品[1]。中药炮制是按照中医药理论,根据药材自身性质,以及调剂、制剂和临床应用的需要,采取的一项独特制药技术。炮制方法一般可分为三大类:净制切制、炮炙(例如炒制、酒炙、蜜炙、制炭、煅、蒸、煮、炖等)和其他(燀、制霜、水飞等)[2]。中药饮片多为天然植物药材经净选、切制或其他炮制方法炮制,不经高温处理过程,其微生物污染量一般较大;经炮炙的中药饮片一般均经过高温处理,其微生物污染量会有所降低。
耐热微生物是指对高温具有较强抵抗力的一类微生物[3-5]。《中华人民共和国药典》2020年版征求意见稿的耐热菌是指供试品经100℃保温30 min后存活的微生物。中药饮片煎煮服用是中医的特色,经煎煮,一部分微生物被高温杀灭,但部分耐热微生物继续存活。本研究通过对中药饮片中污染的耐热菌进行培养计数,并对中药饮片原材料和耐热菌培养物进行16Sr DNA基因高通量测序[6-7],分析中药饮片中耐热微生物的污染数量和组成,分析潜在的生物危害因子,为中药饮片微生物的污染风险评估及标准制定提供参考依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 样品信息 麻黄(去节)、桂枝(去皮)、甘草(炙)、杏仁(去皮尖)、白芍药、大黄(酒洗)、厚朴(炙,去皮)、枳实(大者,炙)、泽泻、白术,含种子、果实、全草、茎枝、根及根茎类植物药,基本覆盖了中药饮片中较重要的药用部位。
原料中药饮片合计30批次,每份样品不少于100 g,均为市售。编号后缀为“-1”为直接抽提核酸后高通量基因测序用试验样品;“-2”为常规培养法试验样品,培养物进行扩增后后缀改为“-N”(见表1、表4)。
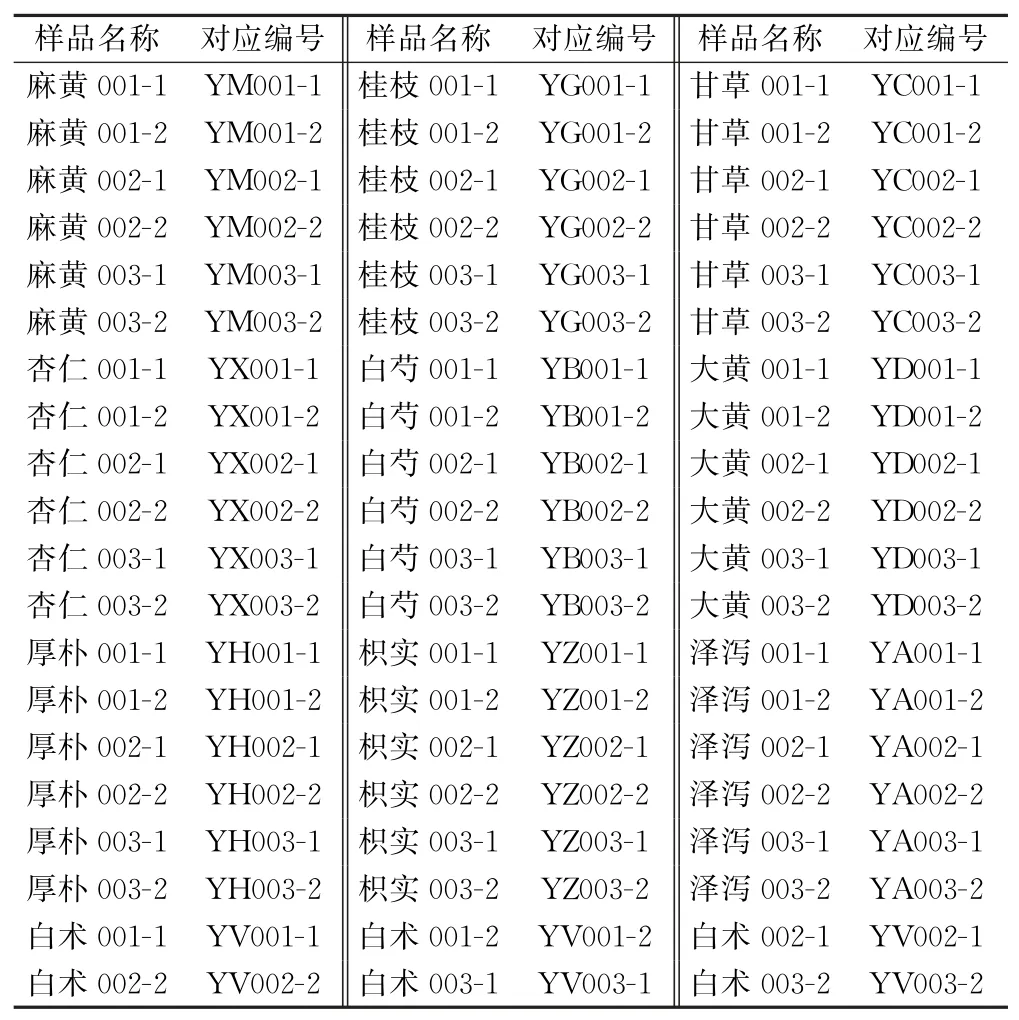
表1 样品信息
1.1.2 培养基与试剂 胰酪大豆胨琼脂培养基(TSA)、沙氏葡萄糖琼脂培养基(SDA)、p H=7.0无菌氯化钠-蛋白胨缓冲液均由北京陆桥技术股份有限公司提供;0.9%无菌氯化钠溶液自配。Phusion超保真DNA聚合酶(NEB公司);DNA Marker(DL9000欣百诺;DL2000Takara);SRBR Premix Ex Taq TM(2×)、细菌基因组DNA小量纯化试剂盒(Takara公司),MiSeq Reagent Kits v3(Illumina公司)。
1.1.3 主要仪器 AC2-6S1型生物安全柜(ESCO新加坡),电泳仪和凝胶成像仪(Bio Rad美国),ABI9700智能梯度PCR仪(ABI美国),Axygen凝胶回收试剂盒(Axygen美国),FTC-3000TM real-time PCR(枫岭上海),Miseq测序仪(Illumina美国)。
2.1 试验方法
2.2.1 常规培养法 原料中药饮片的微生物检测试验方法参照《中华人民共和国药典》2020年版《中药饮片微生物限度检查法(增订草案)》操作。
(1)供试液制备。称取已混合均匀的样品约25 g,置于含250 mL p H=7.0氯化钠蛋白胨缓冲液的已灭菌密盖容器中,充分荡洗不少于20min,取其液体作为供试液(1∶10)。
(2)耐热菌计数。耐热菌计数:取10 m L上述供试液,100℃水浴30 min处理后迅速冷却,此供试液及其连续10倍稀释级的供试液采用胰酪大豆胨琼脂培养基平板倾注法(1m L/皿),每个稀释级至少制备2个平板。在30~35℃培养3~5 d。
耐热菌鉴定:将收集到耐热菌的培养物采用高通量基因测序试验法(16Sr DNA测序)进行鉴定。
阴性对照试验:以p H=7.0氯化钠蛋白胨缓冲液代替供试液进行阴性对照试验,阴性对照试验应无菌生长。
2.2.2 高通量基因测序试验法 原料中药饮片、耐热菌培养物参考《中华人民共和国药典》2020年版《9204微生物鉴定指导原则(第一次征求意见稿)》和《细菌DNA特征序列鉴定法(第一次征求意见稿)》进行试验。
(1)样品抽提核酸前处理。原料中药饮片:取6 g加无菌PBS浸没的供试品,超声(42 k Hz)1 min,重复2次,将液体倒入无菌4mL离心管中,高速离心(12 000 r/min)5min,弃去上清液,富集物加入2m L无菌PBS,混匀后即为供试液。
培养物样本:采用0.9%无菌氯化钠溶液进行平板清洗后收集洗脱液35 m L于灭菌的40 m L离心管中,高速离心(12 000 r/min)5 min,弃去上清液,富集物加入4 m L无菌PBS,混匀后即为供试液。
(2)样品PCR扩增和产物纯化方法。对“2.2.2(1)”项下提取的供试液,采用TAKARA细菌基因组试剂盒提取DNA,作为测序模板。采用两步PCR扩增方法进行文库构建。将纯化的DNA作为模板,利用16Sr DNAV4-V5区通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和926R(5'-CCGTCAATTCMTTTGAGTTT-3')且含有部分Miseq测序引物的融合引物进行1次20个循环PCR扩增,并用1.2%琼脂糖凝胶电泳检测,检测效果较好的样本于2%琼脂糖凝胶电泳切胶回收,以回收产物为模板进行1次8循环的PCR扩增,将Illumina平台测序所需的接头、测序引物、标签序列添加到目的片段两端。全部PCR产物采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)进行回收,并用FTC-3000TM Real-Time PCR仪进行荧光定量,均一化混匀后完成文库构建,在Illumina MiSeq 2 x 300 bp平台上完成测序。PCR扩增体系见表2,PCR扩增参数见表3。
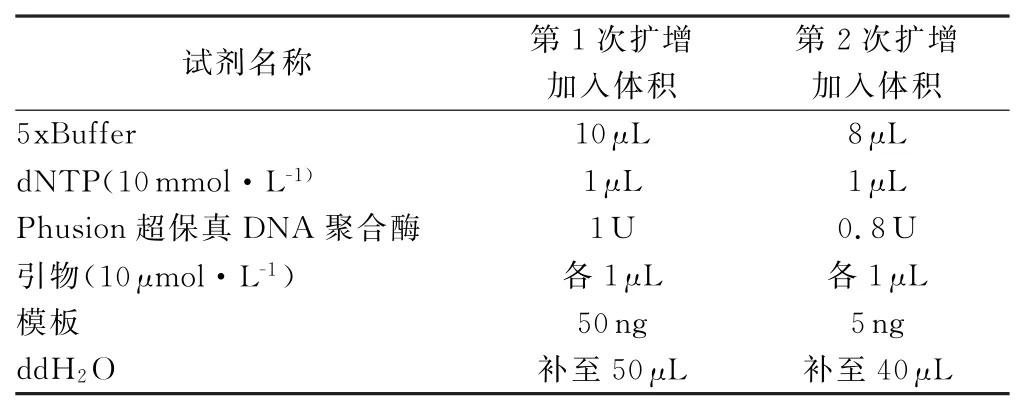
表2 PCR扩增体系

表3 PCR扩增参数
(3)测序结果生物信息分析。对测得的原始数据通过barcode分配样品reads,得到每个样本的有效序列,采用Trimmomatic软件,将测序结果末端低质量的序列去掉,根据PE reads之间的overlap关系,采用flash软件将成对的reads拼接成一条序列,同时采用mothur软件对序列质量进行质控和过滤,将模糊碱基(ambiguous)、单碱基高重复区(homologous)、过长和过短的序列,以及PCR过程中产生的一些嵌合体去除,从而得到优化序列,之后进行OTU(Operational taxonomic units)聚类(UPARSE software),OTU代表序列与silva 128数据库比对进行物种信息注释。基于分类学信息,在门、纲、目、科、属、种分类水平上进行群落结构统计分析。利用mothur(Version 1.33.3)进行Alpha多样性分析(Chao、Ace等物种丰富度统计,Shannon、Simpson等物种多样性统计)、VENN图,Beta多样性分析((un)Weighted UniFrac分 析),利 用R语 言(Version 3.2.3)进行Heatmap分析、PCA分析,CCA/RDA分析则采用CANOCO(Version 4.54)。
3 结果与分析
3.1 常规培养法耐热菌计数结果
本次试验除大黄(酒)001(YD001)和厚朴(炙)001(YH003)的耐热菌未检出外,其余28批次中药饮片均检出了耐热菌,检出比例为93%。经统计可知,大多数样品的耐热菌污染程度介于101~103CFU/g之间(见图1)。

图1 不同中药饮片样品中污染的耐热菌计数比较分析
3.2 高通量基因测序试验法结果
分析方法:采用OTU分析方法,相似性在97%以上归为一个OTU,进行生物信息统计分析。见图2。
图2 测序数量和OUT数量关系
除了第一批大黄(酒)(YD001)和第三批厚朴(炙)(YH003)的耐热菌(YD001-N、YH003-N)用常规培养法未检出,以及原料中药饮片全部批次的麻黄(YM001、YM002、YM003)直接抽提核酸扩增失败外,其余25批次中药饮片与其耐热菌培养物均做了溯源情况分析。
YA002-1与YA002-N(泽泻002)、YC002-1与YC002-N(甘草002)两对未能建立对应关系,其余23对均可实现原料中药材直接提取的微生物DNA与常规培养法的耐热菌培养物抽提的耐热菌DNA一一对应的溯源关系(见表4)。
在YA002-N中耐热菌经鉴定为环状芽孢杆菌和芽孢杆菌属微生物占相对丰度比高达0.97,但在YA002-1无对应的溯源关系微生物DNA,在YA002-1的相对丰度比最高的DNA序列是哈氏幽门螺杆菌(Acinetobacter harbinensis)。YC002-N中耐热菌经鉴定为芽孢杆菌属微生物占相对丰度比高达0.91,但在YC002-1无对应的溯源关系微生物DNA,在YC002-1的相对丰度比最高的DNA序列是成团泛菌(Pantoeaagglomerans)。
参与本次溯源分析的25批饮片的耐热菌基本均属芽孢杆菌属,且在原饮片包含的微生物中基本均可发现,只是相对丰度差异较大,因耐热菌为饮片中含有的微生物经加热处理后经培养所得,其一般芽孢杆菌属的相对丰度比高达0.90以上,而原料中药饮片直接抽提的微生物DNA中尚包含其他所有的微生物基因,故两者之间的相对丰度比已不具备可比性。
除了芽孢杆菌属外,在YA001-1与YA001-N(泽泻001)、YA003-1与YA003-N(泽泻003)、YB002-1与YB002-N(白芍002)、YH001-1与YH001-N(厚朴001)四对中相互匹配的是产氮假单胞菌(Pseudomonas azotoformans),尤其是泽泻001和003只有该微生物形成匹配关系;在YD002-1与YD002-N(大黄002)中相互匹配的只有叶杆菌属(Phyllobacterium)和Aliihoeflea(根瘤菌属)这2种微生物。
在这25批次直接抽提的原料中药饮片中,3批的白术(YV001-1、YV002-1、YV003-1)微生物基因中芽孢杆菌属的相对丰度比均达0.47~0.55,3批枳实(YZ001-1、YZ002-1、YZ003-1)微生物基因中芽孢杆菌属的相对丰度比为0.05~0.34。这种情况较为少见,说明耐热性极好的芽孢杆菌属对原料中药饮片的污染情况在部分品种中十分严重(见表4)。

表4 中药饮片直接提取与耐热菌培养物污染微生物属水平相对丰度
3.3 原料中药饮片微生物间关联性分析
分析本研究的10种中药饮片的耐热菌数污染情况后,发现不同种类的中药饮片污染的耐热菌量有显著性差异。桂枝和杏仁中的耐热菌数量远高于其他饮片品种,其平均污染量大于103CFU/g;麻黄、白术、大黄、厚朴的耐热菌数量较低,可以看出炮炙类加热型的炮制工艺杀灭微生物作用很好;原料中药饮片若本身具有抑制微生物生长功效的各种化学成分,亦可大幅度减少微生物污染种类及数量。
同一种类饮片的不同批次或来源的样品,耐热菌数量也存在较大差异。在枳实(炙)和杏仁中,不同批次样品的耐热菌污染量差异较大,最低污染量<10 CFU/g,而最高可达103CFU/g。这说明微生物的污染量与中药饮片的种类没有绝对联系,而取决于微生物污染的种类、方式与机制。
3.4 原料中药饮片微生物DNA直接抽提情况
原料中药饮片中3批麻黄微生物DNA直接提取全部失败。可能原因是本身基质干扰,麻黄自身化学成分对PCR扩增可能有抑制作用,其特殊的植物基因组DNA降低了16Sr DNA的扩增效率和特异性。
4 结论
16SrDNA基因高通量测序技术具有较高的灵敏度,可以分析复杂样本,无需经过微生物分离纯化的步骤即可进行鉴定,可较好地应用于中药饮片耐热微生物的鉴定[8]。但由于测序长度限制,部分微生物仅能鉴定到属水平,若要进一步确定则须借助其他方法。
中药饮片污染耐热菌的情况普遍存在,主要为芽孢杆菌属,这些耐热菌经高温煎煮也无法杀灭。目前,中药饮片包装一般非常简陋,贮存和运输过程中无法隔绝微生物再次污染。尽管暂未发现高致病性微生物,但当中药饮片中耐热菌污染量达到一定量级后将成为明显的安全隐患[9-11]。因此,必须进一步完善中药饮片的微生物限度标准,严格控制产品中的致病菌,加强生产、流通和使用等环节的监管,以确保用药安全。
