雌孕激素调节水通道蛋白9表达并通过细胞外调节蛋白激酶通路影响囊胚着床的研究*
2021-12-23陈登榜米永杰代吕霞
刘 敏,陈登榜△,米永杰,代吕霞,代 娟,何 煦
1.成都医学院 临床医学国家级实验教学示范中心(成都 610500);2.成都医学院 检验医学院(成都 610500)
着床是指囊胚通过与子宫内膜相互作用逐渐植入子宫内膜的动态过程。在胚胎着床时,胚胎滋养外胚层细胞表现出与恶性肿瘤细胞相似的侵袭行为,且比肿瘤细胞具有更强的侵袭力[1]。近年来,研究[2-5]发现,水通道蛋白(aquaporins,AQPs)在恶性肿瘤细胞数量增加、细胞形态变化及细胞运动中均起到重要作用,而这些因素与肿瘤细胞的侵袭力密切相关。
AQPs是介导水转运的6次跨膜蛋白,其广泛存在于动物及植物中,在维持机体内环境的动态平衡中发挥重要的生理作用[6]。AQPs根据功能分为水通道蛋白和甘油水通道蛋白。该蛋白不仅可以介导自由水的跨细胞膜转运,还可介导小分子物质如甘油的转运[7],AQP9属于该亚族成员。Chen等[8]研究发现,前列腺癌细胞的AQP9可促进水和甘油的运输,并调节癌细胞的增殖和迁移,当低表达前列腺癌细胞AQP9时,可抑制癌细胞迁移。因此,AQP9介导的水和甘油的转运在细胞转移和侵袭中发挥着关键作用。通过免疫荧光和原位杂交技术发现,AQP9在着床前的囊胚滋养外胚层细胞中表达丰富[9],鉴于囊胚滋养外胚层细胞与肿瘤细胞生物学行为相似,均具有较强的侵袭性,故推测卵巢激素可调节囊胚AQP9表达,AQP9参与了囊胚对子宫内膜的粘附和侵袭,对胚胎的着床发挥了重要作用。本研究旨在探讨卵巢雌孕激素对囊胚滋养外胚层细胞AQP9表达的调节,以及AQP9在囊胚对子宫内膜的粘附和着床中发挥的作用。
1 材料与方法
1.1 小鼠胚胎的获取
所有实验均使用7~9周龄美国癌症研究所(institute of cancer research,ICR)小鼠,小鼠购于成都达硕实验动物股份有限公司。小鼠胚胎的获取按照以下方法[10 ]进行:雌性ICR小鼠经腹腔注入10 IU的孕马血清促性腺激素(pregnant horse sera gonadotropin,PMSG),48 h后注射10 IU的人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)。雄性和雌性小鼠按1∶2合笼,次日晨检查雌性小鼠阴栓,以查见阴栓为孕第1天,在孕4 d上午处死小鼠,取出小鼠双侧子宫角,使用M2液冲洗宫腔获得囊胚。本研究通过成都医学院医学伦理委员会批准,实验操作符合关于善待实验动物指导性的意见要求。
1.2 建立小鼠胚胎的体外着床模型
将子宫内膜上皮细胞株Ishikawa接种于24孔板中,培养24 h,待细胞贴壁后,将处理后的囊胚移入培养有Ishikawa上皮细胞的培养孔中,培养12 h后,将培养板置于倒置显微镜观察囊胚的粘附情况。轻轻摇动培养板20 s,若囊胚没发生位置改变则记为粘附囊胚,计算各组囊胚的粘附率。
1.3 siRNA干扰
按riboFectTMCP Transfection Kit(166T) 说明书进行转染。用Buffer(v1)稀释siRNA-AQP9(si-AQP9)储存液,室温放置5 min;加入riboFectTMCP Reagent,室温孵育15 min;向含有囊胚的培养孔中加入si-AQP9与riboFectTMCP Reagent的复合物,使si-AQP9的终浓度为100 nmol/L。转染24 h后,收集囊胚用于后续实验。
1.4 RT-PCR 检测囊胚细胞AQP9的mRNA表达
收集小鼠囊胚,按照Trizol试剂说明书提取总RNA,紫外分光光度计确定浓度,OD260与OD280比值在1.8~2.1,用于后续实验。参照逆转录试剂盒说明书构建逆转录体系,反转录合成cDNA。荧光定量PCR仪上进行扩增反应,反应体系为:以 95 ℃、30 s, 95 ℃、5 s, 55 ℃、30 s,72 ℃、30 s,变性和退火进行了45个循环。采用MUS β-actin作为内参基因,利用SDS软件进行数据分析样本的Ct值,计算mRNA表达水平。利用Primer 6.0软件设计合成引物序列:MUS AQP9上游引物:5′-CCC AGGCTCTTCACTGCTCT-3′, 下游引物:5′-GGG GTTCGAGTGATGCATTT-3′;β-actin上游引物:5′-TCAGGAGGAGCAATGATC TTG-3′,下游引物:5′-TCCTCCCTGGAGAAGAG CTA-3′。
1.5 蛋白质印迹技术
采用蛋白质印迹技术检测小鼠囊胚滋养外胚层细胞磷酸化细胞外调节蛋白激酶1和2(Phospho-extracellular regulated protein kinases 1/2,p-ERK1/2)蛋白表达。在收集的囊胚样品中加入RIPA裂解液,将收集的裂解液置于4 ℃、12 000 r/min、离心半径6.215 cm、离心10 min,取上清,BCA试剂盒测定蛋白浓度;在样品中加入5×Loding buffer,沸水变性15 min,随后12 000 r/min、离心半径6.215 cm、离心3 min,收集上清液备用;浓缩胶起始电压100 V进行电泳15 min,分离胶180 V电泳,到达凝胶底部时终止电泳。采用“三明治”湿法,把凝胶上的蛋白条带转移至PVDF膜上,将PVDF膜置于37 ℃、用5%脱脂奶粉封闭2 h。PVDF膜采用一抗(p-ERK1/2 1∶1 000、β-actin 1∶5 000)在4 ℃过夜孵育,加入二抗(1∶5 000)37 ℃孵育2 h;采用ECL化学发光试剂进行检测,凝胶成像系统进行曝光。以产物蛋白条带强度与内标强度的比值来反应检测蛋白的表达水平。
1.6 统计学方法

2 结果
2.1 雌孕激素对囊胚细胞AQP9表达的调节
将收集的小鼠孕第4天的囊胚分为4个实验组,分别为空白对照组(Ctrl组),加入0.01 μmol/L雌二醇的E2组,加入1 μmol/L孕激素的P4组,以及加入0.01 μmol/L E2和1 μmol/L P4的E2+P4联合处理组,在处理24 h后收集各组囊胚,采用 RT-PCR检测结果发现,与Ctrl组相比较,E2+P4联合处理组AQP9在囊胚细胞中的表达升高,且与E2组、P4组比较,差异有统计学意义(P<0.05),表明AQP9的表达受到E2+P4激素的联合调节(图1)。
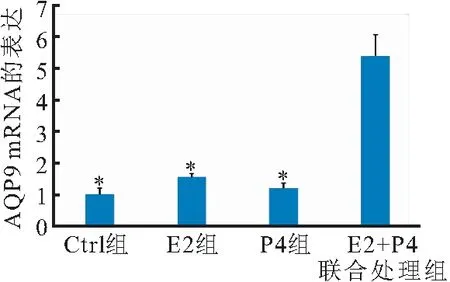
图1 雌孕激素对囊胚滋养外胚层细胞AQP9表达的调节
2.2 雌孕激素对囊胚粘附的影响
在体外培养的囊胚中加入E2+P4激素,以及小干扰si-AQP9 100 nmol/L低表达囊胚滋养外胚层细胞中AQP9,作用24 h后收集囊胚,将囊胚与子宫内膜上皮株Ishikawa联合培养12 h后,采用倒置显微镜观察发现,与Ctrl组囊胚粘附率(73.33±12.28)%比较,si-AQP9干扰组囊胚的粘附率(33.33±5.17)%明显下降(P<0.05)(图2)。

图2 囊胚在子宫内膜上皮细胞的粘附率
2.3 雌孕激素对囊胚细胞AQP9表达的影响
2.3.1 检测囊胚AQP9 mRNA和p-ERK1/2表达 在培养的囊胚中,加入E2+P4激素以及小干扰si-AQP9 100 nmol/L低表达囊胚滋养外胚层细胞中AQP9,作用24 h后收集囊胚,采用RT-PCR检测。结果显示,与Ctrl组相比较,si-AQP9组囊胚滋养外胚层细胞中AQP9 mRNA表达下降(图3A)。收集的囊胚采用蛋白质印迹技术检测发现,si-AQP9组囊胚滋养外胚层细胞p-ERK1/2蛋白的表达也较Ctrl组明显降低(图3B)。
2.3.2 检测囊胚AQP9 mRNA表达 在培养的囊胚中加入E2+P4激素及ERK1/2的抑制剂U0126 20 mmol/L,以抑制囊胚滋养外胚层细胞中ERK1/2活性,24 h后收集囊胚。RT-PCR结果显示,U0126组囊胚滋养外胚层细胞中AQP9 mRNA表达与Ctrl组比较,差异无统计学意义(P>0.05)(图3C)。
2.3.3 观察囊胚在子宫内膜上皮细胞的粘附率 在培养的囊胚中加入E2+P4激素及ERK1/2的抑制剂U0126 20 mmol/L,以抑制囊胚滋养外胚层细胞中ERK1/2活性,24 h后收集囊胚,再将囊胚和子宫内膜上皮联合培养12 h后,采用倒置显微镜观察发现,与Ctrl组囊胚的粘附率(76.92±9.01)%比较, U0126组粘附率(27.27±6.36)%明显降低(图3D)。
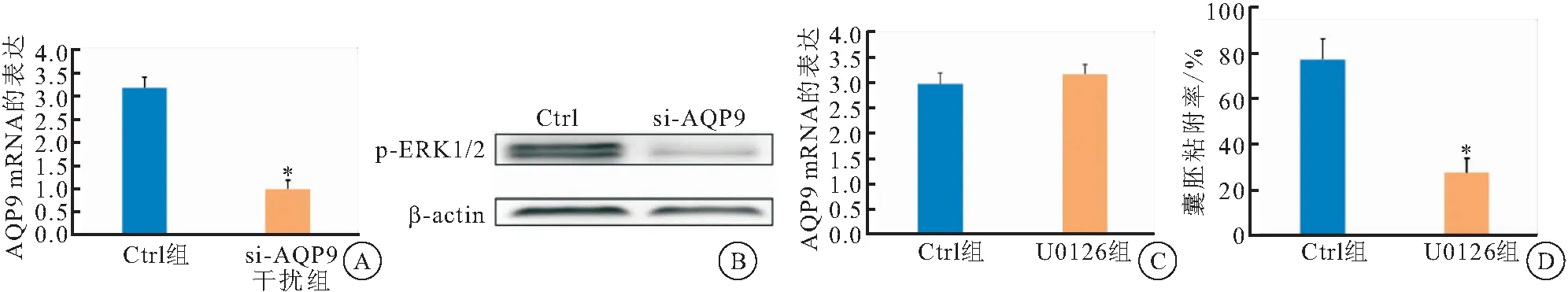
图3 雌孕激素对囊胚细胞AQP9表达影响并通过ERK信号通路对囊胚粘附的影响
3 讨论
AQP9为甘油水通道蛋白亚家族成员,可以介导自由水的跨细胞膜转运,还可介导甘油的转运,从而参与肿瘤的生成、侵袭和转移[11-13]。研究[14]发现,卵巢雌激素可通过上调AQP9 mRNA,使输卵管上皮AQP9蛋白的表达增加,表明AQP9的表达受到卵巢激素的调节。故推测卵巢激素调节了囊胚的AQP9表达。在体外培养的孕4 d的囊胚中,分别加入E2、P4以及E2+P4,结果发现E2+P4组囊胚细胞中的AQP9表达升高,这表明囊胚AQP9的表达受到E2+P4激素的联合调节。
近年来,通过免疫荧光和原位杂交技术研究[9,15]发现,AQP9在着床前、小鼠孕4 d的囊胚滋养外胚层细胞中表达丰富,而囊胚滋养外胚层细胞比肿瘤细胞更具有侵袭性。因此,考虑AQP9是否参与了囊胚对子宫内膜上皮的粘附和侵袭,从而在早期胚胎的着床中起到了关键作用。为了验证这一假设,将si-AQP9小干扰加入培养的孕鼠囊胚细胞中,低表达囊胚滋养外胚层细胞中AQP9,再将小干扰处理后囊胚与子宫内膜上皮细胞株Ishikawa细胞进行联合培养12 h后,采用倒置显微镜观察发现,与Ctrl组囊胚粘附率相比较,si-AQP9干扰组囊胚在子宫内膜上皮细胞的粘附率下降,这提示囊胚AQP9参与了囊胚对子宫内膜上皮细胞的粘附。
进一步探讨AQP9参与囊胚对子宫内膜上皮细胞粘附作用的机制。研究[8]发现,前列腺癌PC-3细胞的AQP9可促进ERK1/2的磷酸化,使ERK1/2被激活,从而介导前列腺癌细胞的迁移和侵袭。ERK是丝/苏氨酸蛋白激酶,为MAPK家族成员之一,定位于胞浆;ERK磷酸化后被激活,转位至胞核,调节转录因子活性,参与各类细胞的生长、发育以及分裂[16]。并且磷酸化后激活的ERK1/2还可以参与维持细胞形态、细胞增殖与分化以及肿瘤侵袭、转移[11-13]。此外,在着床前早期,囊胚滋养外胚层细胞中也发现ERK的表达[15],而囊胚滋养外胚层细胞与肿瘤细胞生物特性相似。因此,推测在胚胎着床前期,卵巢雌孕激素可上调早期囊胚细胞AQP9表达,并通过ERK通路参与了早期囊胚滋养外胚层细胞对子宫内膜细胞的粘附和侵袭。在培养的囊胚中,加入E2+P4激素以及si-AQP9低表达滋养外胚层细胞中AQP9,检测了囊胚细胞中p-ERK1/2的表达情况,发现与Ctrl组比较,si-AQP9组的p-ERK1/2表达降低,这表明卵巢雌孕激素通过上调囊胚AQP9表达而激活ERK通路。而在培养的囊胚中,加入ERK1/2的抑制剂U0126,以抑制囊胚滋养外胚层细胞中ERK1/2活性,结果发现U0126组囊胚滋养外胚层细胞中AQP9 mRNA表达与Ctrl组比较,差异无统计学意义(P>0.05),提示囊胚AQP9为ERK1/2信号通路的上游分子。进一步在体外培养囊胚中雌、孕激素作用后,加入ERK1/2抑制剂U0126抑制囊胚滋养外胚层细胞中ERK1/2活性,再将囊胚和子宫内膜上皮联合培养12 h后,采用倒置显微镜观察发现,U0126组囊胚在子宫内膜上皮细胞的粘附率降低,表明雌孕激素通过ERK通路影响囊胚粘附。
综上所述,在胚胎着床前期,卵巢雌孕激素可上调胚胎细胞AQP9表达,并通过ERK通路参与早期囊胚滋养外胚层细胞对子宫内膜细胞的粘附和侵袭,在胚胎着床中发挥了重要作用。本研究从一个新的视角探讨了影响囊胚粘附、侵入和着床的机制,为临床上不孕症的诊断提供新的生物学标志物,并为不孕症的预防和治疗提供一个新思路。
