组蛋白去乙酰化酶4抑制肌细胞增强因子2C介导的肺动脉高压小鼠肺血管重构研究*
2021-12-23周夏飞
曾 军,周夏飞,张 维
成都医学院第一附属医院 呼吸与危重症医学科(成都 610500)
肺动脉高压(pulmonary arterial hypertension,PAH)的主要病理学改变是由于肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)过度增殖和迁移导致的肺血管重构,表现为细小动脉肌化、闭塞,中膜增厚,丛状损害以及坏死性动脉炎[1],目前其发病机制尚不清楚,治疗手段有限。肌细胞增强因子2(myocyte enhancer factor 2,MEF2)是一种特定的转录因子,具有DNA 结合能力,与相关基因结合调控肌肉细胞、干细胞、神经细胞、淋巴细胞的增殖和分化,受表观遗传学机制调控。MEF2 基因家族由MEF2A、MEF2B、MEF2C和MEF2D4个成员组成。其中,MEF2C 在肌肉细胞的发育、分化、表型改变及增殖等方面发挥作用,可能参与PAH的发生、发展,但目前未阐明其具体机制[2-3]。有研究[4-7]表明,组蛋白去乙酰化酶4(histone deacetylase 4,HDAC4)可通过上调MEF2C,调节骨骼肌分化、增殖表型改变、心血管和神经系统发育,并与血管内膜畸形增殖有关。因此,推测HDAC4可调控MEF2C介导的肺动脉平滑肌细胞增殖。本研究通过干预小鼠肺动脉平滑肌细胞的HDAC4蛋白功能,检测HDAC4、MEF2C表达水平变化,并观察小鼠肺动脉病理改变,以期为PAH分子机制提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 动物及分组 健康雄性BALB/C小鼠32只,8周龄,体重20~25 g,由北京维通利华实验动物技术公司提供。随机分为:阴性对照组(NC组)、PAH组、HDAC4抑制剂(HDAC4 inhibitor,HDAC4i)组、PAH+HDAC4i组,每组8只。
1.1.2 主要设备 Powerlab生理记录仪、Millar微压力导管(SPR-835),均来自美国AD instruments公司。
1.1.3 主要试剂 MEF2C兔单克隆抗体(5030S, 美国CST)、α-平滑肌肌动蛋白(α-SMA)兔单克隆抗体(19245S, 美国CST)、骨桥蛋白(OPN)兔多克隆抗体(ab8448,英国Abcam)、HDAC4兔单克隆抗体(ab12172, 英国Abcam)、GAPDH兔单克隆抗体(ab181602,英国Abcam)、TB Green®Fast qPCR Mix试剂盒(RR430A,日本Takara)、HDAC4 inhibitor(S7617,美国Selleck)、野百合碱(B10942,上海士峰)、HDAC4i(美国 Selleck,商品名:Tasquinimod)。
1.2 动物模型建立方法
PAH组给予野百合碱60 mg/kg腹腔注射,HDAC4i组使用HDAC4i 30 mg/kg隔日灌胃(半衰期39 h),PAH+HDAC4i组给予野百合碱60 mg/kg腹腔注射后,HDAC4i 30 mg/kg隔日灌胃,NC组经腹腔注射等量生理盐水。模型建立成功后第2周、第4周分批处死动物。小鼠断头法处死,留取肺组织及心脏组织样本,生理盐水清洗,右肺组织采用液氮保存,左肺组织采用中性福尔马林固定。
1.3 检测指标
1.3.1 血流动力学指标 乙醚吸入法麻醉小鼠并经气管插管通气后,自下颌骨下方至胸骨上缘做颈正中部切口,充分暴露小鼠右侧颈外静脉,插入Millar微压力导管,连接Powerlab 多通道生物信号记录系统,经颈外静脉插管,右心导管法测定小鼠右心室压力。测定右心室收缩压(RVSP)、右心室舒张压(RVDP)及右心室压力升降最大速率(dp/dtmax)。测定连续10个心动周期压力值,取均值作为实验数据进行分析。
1.3.2 右心室肥厚指数 小鼠右心室压力测定后立即取出心脏,盐水冲净淤血,沿房室环剪去左右心房,沿室间隔边缘分离右心室(RV)和左心室+室间隔(LV+S),滤纸吸干心室上水分后立即称重,RV/(LV+S)即右心室肥厚指数。
1.3.3 荧光定量PCR检测MEF2CmRNA表达 1)引物设计:MEF2C正义链5′-CGGGATC CACTATGGGGAGAAAAAAGATTCAG-3′,反义链5′-CCGCTCGAGTGTTGCCCATCCTTCAG AGA-3′;β-actin正义链5′-CTGGCCGGGACCTG ACAGACT-3′,反义链5′-AGAAAGGGTGTAAA ACGCAGCTCA-3′。2)总RNA提取:取100 mg液氮冻存的小鼠右肺组织,立即放入预先装有500 μL Trizol裂解液的1.5 mL PE管中,置于冰上,并用组织匀浆器快速破碎肺组织;常规使用氯仿-异丙醇抽提RNA。分光光度计测定RNA浓度、A260/A230、A260/A280。本研究中1.9≤A260/A280≥2.0时才考虑进行后续实验。3)反转录PCR反应及琼脂糖凝胶电泳:取总RNA 1 μL,利用PrimeScriptTMRT reagent Kit试剂盒(日本Takara)合成cDNA第一链。反转录反应参数:37 ℃ 15 min(反转录反应),85 ℃ 5 s(反转录酶的失活反应);4 ℃存储。以反转录PCR 反应的 cDNA为模板,添加量不超过 PCR 反应液总体积的10%,取50 ng cDNA按照TB Green®Fast qPCR Mix(日本 Takara)说明书进行操作。荧光定量PCR总反应体系20 μL,反应条件:95 ℃、预变性30 s,95 ℃、变性5 s,60 ℃、退火10 s,40个循环。扩增完成后,取10 μL PCR产物加入1.5%琼脂糖凝胶进行电泳鉴定,Bio-Rad凝胶成像系统分析仪进行图片扫描。
1.3.4 蛋白质印迹技术检测MEF2C蛋白表达 40 mg冻存肺组织,加入400 μL RIPA裂解液,超声破碎,随后用移液器将裂解液移至1.5 mL离心管中,于95 ℃水中煮5 min,然后在4 ℃下,12 000 r/min,离心5 min(离心半径6 cm),取上清分装于0.5 mL离心管中,并置于-20 ℃保存。取5 μL样本使用BSA方法测定蛋白浓度。取50 μg总蛋白上样进行常规12% SDS-PAGE电泳,电泳开始时,恒压模式下用80 V的电压电泳,随后将蛋白质电转至PVDF 膜(恒流400 mA、转膜时间75 min),TBST洗涤后加5%脱脂牛奶-TBST,37 ℃封闭1 h,分别加入MEF2C兔抗鼠单克隆抗体稀释液(1∶500)和GAPDH兔抗鼠单克隆抗体稀释液(1∶1 000),4 ℃摇床过夜,室温下TBST洗涤3次,10 min/次。将MEF2C膜放入含有HRP标记的山羊抗兔IgG(1∶4 000)稀释液,室温孵育2 h,TBST洗涤3次,10 min/次,ECL发光试剂显影。MEF2C蛋白相对含量用MEF2C/GAPDH灰度比值表示。
1.3.5 肺组织病理分析 福尔马林固定肺组织,常规梯度乙醇脱水,石蜡包埋,5 μm厚度切片,苏木精-伊红(HE)染色,高倍光学显微镜下观察肺动脉病理变化。每只小鼠均取5张切片,石蜡切片室温放置1 h后常规脱蜡,微波法进行抗原修复,3%过氧化氢阻断内源性过氧化物酶,分别滴加α-SMA兔单克隆抗体稀释液(1∶400)、OPN兔多克隆抗体稀释液(1∶200)、HDAC4兔单克隆抗体稀释液(1∶400),于4 ℃湿盒中孵育过夜。使用SP法进行免疫组化染色,染色步骤严格按照试剂盒说明书进行。DAB显色3 min,Mayer HE染色复染1 min,梯度酒精逐渐脱水,中性树胶封片,显微镜下观察拍照,棕黄色细颗粒状即为阳性产物。
1.4 统计学方法
2 结果
2.1 RVSP 及RV/(LV+S)的变化
血流动力学监测数据显示,第2周PAH组、PAH+HDAC4i组及HDAC4i组RVSP分别为(24.785±1.289)、(27.983±1.215)、(24.332±0.964)mm Hg,高于NC组的(19.387±1.109)mm Hg(P<0.05)。第4周PAH组、PAH+HDAC4i组及HDAC4i组小鼠RVSP分别为(30.766±0.812)、(33.131±1.124)、(30.283±0.985)mm Hg,均高于NC组的(19.252±1.323)mm Hg(P<0.05)。在第2周PAH组、PAH+HDAC4i组及HDAC4i组小鼠的RV/(LV+S)分别为(0.297±0.011)、(0.330±0.016)、(0.291±0.005),高于NC组的(0.250±0.011)(P<0.05);第4周PAH组、PAH+HDAC4i组及HDAC4i组小鼠的RV/(LV+S)分别为(0.329±0.012)、(0.367±0.018)、(0.323±0.006),均高于NC组的(0.245±0.006)(P<0.05)(表1)。

表1 各组RVSP及RV/(LV+S)比较
2.2 MEF2C mRNA及蛋白在小鼠肺组织中的表达
与NC组相比,第2周荧光定量PCR检测显示,PAH组、PAH+HDAC4i组MEF2CmRNA表达量均明显升高,差异有统计学意义(P<0.05);与NC组相比,第4周荧光定量PCR检测显示,PAH组、PAH+HDAC4i组及HDAC4i组MEF2CmRNA表达量均明显升高,差异有统计学意义(P<0.05)。免疫印迹实验检测结果显示,在第2周、第4周,PAH组、PAH+HDAC4i组及HDAC4i组肺组织MEF2C蛋白表达量较NC组升高,且PAH+HDAC4i组肺组织MEF2C蛋白升高最明显(表2~3、图2)。

表2 第2周及第4周MEF2C mRNA相对表达量

表3 第2周及第4周MEF2C蛋白表达相对灰度值
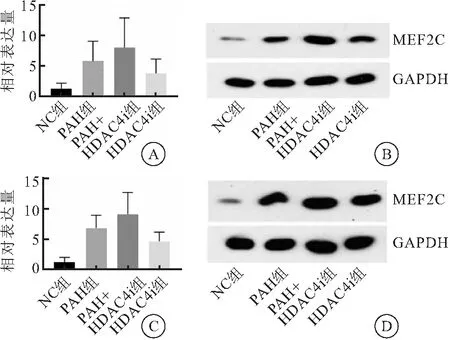
图2 小鼠肺组织MEF2C mRNA及蛋白表达量变化检测结果
2.3 肺血管病理学改变及OPN、α-SMA、HDAC4蛋白在肺组织中定位表达
第4周PAH组、PAH+HDAC4i组及HDAC4i组小鼠肺动脉平滑肌细胞增殖、肥厚、排列紊乱;PAH+HDAC4i组肺动脉平滑肌细胞增殖肥厚更加明显,排列紊乱,血管管腔不对称狭窄,并出现小动脉明显肌化致管腔严重狭窄。OPN免疫组化显示:PAH组、PAH+HDAC4i组及HDAC4i组主要在肺动脉平滑肌细胞可见胞浆黄染,且分布广泛,而NC组肺动脉平滑肌细胞上分布浅淡。α-SMA免疫组化显示:NC组肺动脉平滑肌细胞可见黄染颗粒,且分布广泛,而PAH组、PAH+HDAC4i组及HDAC4i组肺动脉平滑肌细胞无黄染颗粒。HDAC4免疫组化显示:NC组肺动脉平滑肌细胞及肺泡上皮细胞可见染色较深,而PAH组、PAH+HDAC4i组及HDAC4i组肺动脉平滑肌细胞或肺泡上皮细胞染色明显变淡(图3)。

图3 小鼠肺组织HE染色及免疫组化检测OPN、α-SMA、HDAC4表达变化(×200)
3 讨论
随着对表观遗传学研究的深入,越来越多的研究[8]证明,PAH的发生、发展与表观遗传学有关,DNA 甲基化、组蛋白修饰可以选择性调控细胞生长、增殖或凋亡。Kim 等[1]发现,一种组织特异性超氧化物歧化酶的表观遗传学改变导致肺动脉平滑肌细胞内氧化还原信号异常,下调钾离子通道的表达降低细胞内钙离子水平,抑制肺动脉平滑肌细胞的增殖。这为表观遗传学改变在PAH的发生发展中的作用提供有力支持。
Paulin等[3]研究提示,MEF2C可能参与PAH的发生、发展,但未能阐明其具体机制。研究[9]报道,MEF2C调控血管平滑肌增殖的作用是通过转导细胞外信号,与辅助因子相互作用实现,组蛋白去乙酰化酶(histone deacetylase,HDAC)在这种细胞外信号的转导中扮演重要角色。HDAC是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要作用。一般情况下,组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离,核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA结合位点特异性结合,激活基因的转录。目前有研究[10]表明,HDAC4可通过对MEF2C的直接调控,调节骨骼肌分化、表型改变、心肌电活动、心血管系统和神经系统发育。在心肌电活动方面,ROS-HDAC4-MEF2C信号通路激活可诱发病窦综合征。在神经系统疾病的研究[11]中发现,HDAC4可以抑制MEF2C活性,导致神经细胞死亡。关于软骨成骨研究[4]发现,MEF2C的转录活性受HDAC4直接调控,HDAC4缺失可能导致MEF2C转录活性抑制失控从而出现过量成骨,在MEF2C基因敲除小鼠中证明了MEF2C在HDAC4软骨成骨调节中的关键性作用。在骨骼肌细胞、心肌细胞及平滑肌细胞中,HDAC4均可调控MEF2C表达,最终影响平滑肌细胞增殖。这种作用是通过HDAC4的泛素化及磷酸化调节来实现的[6, 12]。在基因共转染研究[5]中也发现,当MEF2C与HDAC4表达载体共同表达时,MEF2C的转录活性被明显抑制,说明HDAC4抑制MEF2C介导的平滑肌增殖调控作用。有关肺血管研究[6]发现,HDAC4的活性也与MEF2C相关。
本研究显示,PAH组、PAH+HDAC4i组及HDAC4i组小鼠RVSP与RV/(LV+S)均高于NC组。免疫印迹实验结果表明,PAH组、PAH+HDAC4i组及HDAC4i组与NC组比较,MEF2C蛋白表达量升高,差异均有统计学意义(P<0.05)。免疫组化显示,与NC组比较,PAH组、PAH+HDAC4i组及HDAC4i组小鼠肺动脉平滑肌细胞OPN表达水平上升,而α-SMA与HDAC4表达水平明显下降。同时,HE染色显示,PAH组、PAH+HDAC4i组及HDAC4i组小鼠肺动脉平滑肌细胞增殖肥厚、排列紊乱;PAH+HDAC4i组肺动脉平滑肌细胞增殖肥厚更加明显,并出现小动脉明显肌化致管腔严重狭窄。
综上所述,本研究进一步证明,HDAC4/MEF2C信号通路促进PAH肺血管平滑肌细胞增殖,并再次证明MEF2C在PASMCs增殖中的关键性地位,此结果可为PAH的治疗提供潜在理论依据。但本研究未在细胞水平证明HDAC4对MEF2C的具体调控机制,未来还需通过细胞实验来进一步验证本研究假说。〗
