螺虫乙酯及其代谢物和氯虫苯甲酰胺在龙眼上的残留动态
2021-12-23刘艳萍王潇楠顾燕萍孙海滨王思威
刘艳萍, 王潇楠, 常 虹, 顾燕萍, 孙海滨, 王思威
(广东省农业科学院 植物保护研究所/广东省植物保护新技术重点实验室,广州 510640)
龙眼Dimocarpus longanLour. 是典型亚热带树种,荔枝蒂蛀虫是危害龙眼的主要害虫之一,严重影响龙眼的产量和质量。生产中对荔枝蒂蛀虫主要采用氯虫苯甲酰胺、阿维菌素、螺虫乙酯等药剂进行防治[1-2]。近年来中国虽加快了小作物农药登记及其最大残留限量 (MRL) 标准制定工作,但目前在龙眼上登记的杀虫剂仅有毒死蜱和氯氰菊酯[3],登记农药不能满足实际生产,生产中违规使用未登记农药的现象时有发生。
螺虫乙酯 (spirotetramat,图式1) 是新型季酮酸类杀虫剂,农药残留专家联席会议 (JMPR) 定义其残留物为螺虫乙酯及其代谢产物螺虫乙酯-烯醇(B-enol)、螺虫乙酯-单羟基 (B-mono)、螺虫乙酯-酮-羟基 (B-keto) 和螺虫乙酯-烯醇-糖苷 (B-glu) 之和,以螺虫乙酯表示[4]。氯虫苯甲酰胺 (chlorantraniliprole,图式1) 是邻甲酰胺基苯甲酰胺类杀虫剂,JMPR 定义其残留物为氯虫苯甲酰胺[5]。
目前中国[6]、国际食品法典委员会 (CAC)[7]、欧盟[8]、日本[9]均尚未制定螺虫乙酯在龙眼上的最大残留限量 (MRL)值,美国规定螺虫乙酯在龙眼上的MRL 值为13 mg/kg[10]。中国规定螺虫乙酯在荔枝上的MRL 值为15 mg/kg[6],CAC 规定为15 mg/kg[7],欧盟为13 mg/kg[8],美国为15 mg/kg[10]。中国、CAC、美国和日本尚未制定氯虫苯甲酰胺在龙眼上的MRL 值,欧盟对皮不可食小型果中的氯虫苯甲酰胺采用“一律限量”,限量值为0.01 mg/kg[8]。中国已制定氯虫苯甲酰胺MRL 值的水果品种有:柑橘类 (0.5 mg/kg)、仁果类 (苹果除外) (0.4 mg/kg)、苹果 (2 mg/kg)、核果类 (1 mg/kg)、浆果 (1 mg/kg) 、其他小型水果 (0.4 mg/kg)、石榴 (0.3 mg/kg)及瓜果类水果 (黄瓜除外) (0.2 mg/kg)。
目前,虽然关于这两种杀虫剂残留的研究报道较多[11-14],但尚未见采用高效液相色谱-串联质谱法 (HPLC-MS/MS) 检测螺虫乙酯和氯虫苯甲酰胺在龙眼上的残留量并进行安全评价的报道。鉴于此,本研究拟采用HPLC-MS/MS,建立螺虫乙酯及其代谢物和氯虫苯甲酰胺在龙眼上残留量的检测方法,并以此方法测定22.4%螺虫乙酯悬浮剂和5%氯虫苯甲酰胺悬浮剂在龙眼上施用后的最终残留量,旨在为这两种农药在龙眼上的科学合理使用以及制定其MRL 值提供依据。
1 材料与方法
1.1 供试药剂及主要仪器
99.0%螺虫乙酯 (spirotetramat) 和99.7% Benol 标准品,国家农药质量监督检验中心 (沈阳);94.86% B-glu、94.03% B-keto、99.48% B-mono 和97.8%氯虫苯甲酰胺 (chlorantraniliprole) 标准品,Dr. Ehrenstorfer GmbH 公司。
22.4%螺虫乙酯悬浮剂 (SC),拜耳股份公司;5%氯虫苯甲酰胺SC,上海绿泽生物科技有限责任公司;甲醇和乙腈均为色谱纯,氯化钠和无水硫酸钠等试剂均为分析纯;N-丙基乙二胺吸附剂(PSA),上海安谱实验科技股份有限公司。
高效液相色谱-质谱联用仪 (质谱为LCMS-8045,液相为LC-20AT),日本岛津公司;GTR22-1离心机,北京时代北利离心机有限公司;OA-SYS氮吹仪,美国Organomation Associates 公司;XW-80A 涡旋仪,上海精科有限公司;ULTRATURRAXT 25 匀浆机,德国IKA 公司;Y-4 水浴恒温振荡器,江苏金坛金城国胜试验仪器厂;NEVAP24 氮吹仪,美国Organomation 仪器有限公司。
1.2 田间试验
试验于2018 年6 至9 月分别在广东广州和茂名、广西、海南、福建以及云南6 地进行。供试龙眼Dimocarpus longanLour. 品种分别为储良、石硖、储良、石硖、凤梨穗和古山2 号。按照《农作物中农药残留试验准则》[15]和《农药登记残留田间试验标准操作规程》[16],将22.4%螺虫乙酯SC、5%氯虫苯甲酰胺SC 按要求加水稀释后,采用背负电动式喷雾器均匀喷施于龙眼树上,喷液量为900 L/hm2。
最终残留试验:小区按顺序排列,分别设处理区及空白对照区,每小区4 株龙眼树,于幼果期开始喷雾施药,施药间隔期7~10 d。其中,22.4% 螺虫乙酯SC 按有效成分60 mg/kg 施用2 次,采收间隔期为14、21 及28 d。5%氯虫苯甲酰胺SC 按有效成分50 mg/kg 施用2 次,采收间隔期为7、14 及21 d。按间隔期采样,每个处理小区至少采集2 个独立样品。按对照区、处理区的次序进行采集,随机采集不少于2 kg 生长正常、无病害的龙眼个体。全果样品:取出果核并称重,将果皮和果肉切碎、混匀,四分法缩分留样100 g;果肉样品:剥去果皮,取出果肉和果核,将果肉切碎、混匀,四分法缩分留样100 g。所有样品均于 −20 ℃保存,待分析。
1.3 分析方法
1.3.1 样品前处理 称取匀浆后的龙眼样品 (全果或果肉) 10.0 g 于50 mL 离心管中,加入20 mL 乙腈涡旋1 min,再加入5 g 氯化钠剧烈振荡涡旋1 min,于5 000 r/min 下离心2 min;取乙腈层2 mL;氮吹至近干后用V(甲醇) :V(水) = 60 :40 溶液定容至1 mL;加入0.1 g PSA,涡旋1 min,于10 000 r/min下离心2 min;取上清液,过0.22 μm 有机滤膜,待测。
1.3.2 检测条件 氯虫苯甲酰胺色谱条件:Shimpack GIST-HP C18色谱柱(100 mm × 2.1 mm,3 μm);流动相为V(0.1%甲酸水,含2 mmol/L乙酸铵) :V(乙腈)=25 : 75,运行3 min;流速0.3 mL/min;柱温25 ℃;进样量1 μL。
螺虫乙酯及代谢物色谱条件:Agilent Extend C18色谱柱(150 mm × 4.6 mm,5 μm);流动相A为0.1% 甲酸水(含2 mmol/L 乙酸铵),B 为乙腈。梯度洗脱程序:0~1 min,60% A+40% B;>1 min~7 min,20% A+80% B;>7 min~14 min,5% A+95% B;运行14 min;流速0.3 mL/min;柱温35 ℃;进样量1 μL。
质谱条件:正离子电离 (ESI+),多反应监测模式,离子源温度300 ℃,毛细管电压4 000 V。其他相关参数见表1。
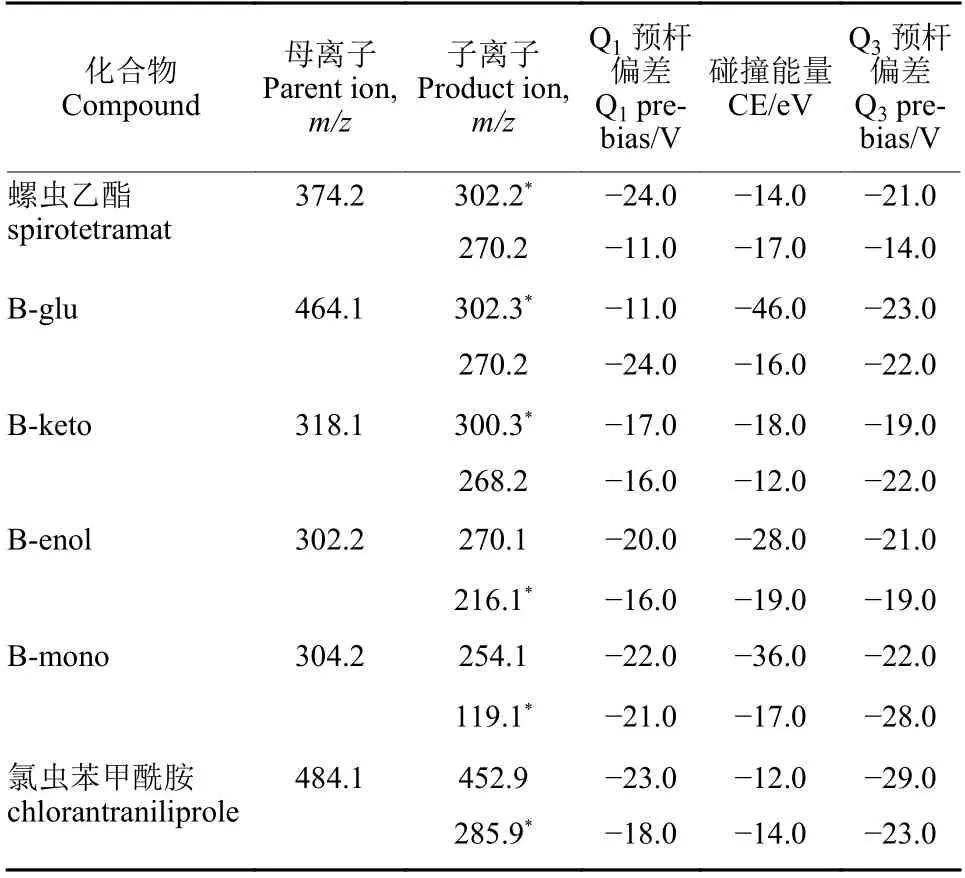
表1 螺虫乙酯及其代谢物和氯虫苯甲酰胺的质谱参数Table 1 The mass spectrometry parameters of spirotetramat and its metabolites and chlorantraniliprole
1.3.3 标准溶液的配制及基质标准曲线绘制 准确称取10 mg (精确到0.1 mg) 螺虫乙酯及代谢物B-glu、B-keto、B-enol 和B-mono,以及氯虫苯甲酰胺标准品,用甲醇溶解并定容于10 mL 容量瓶中,配成质量浓度约为1 000 mg/L 的标准储备液,再分别稀释配制成10 mg/L 的标准工作液。
分别用空白龙眼全果和果肉样品的提取液稀释上述标准工作液,配成质量浓度分别为1、0.5、0.1、0.05 和0.01 mg/L 的螺虫乙酯及其代谢物基质匹配混合标准工作溶液以及氯虫苯甲酰胺基质匹配标准工作溶液,按1.3.2 节条件测定,外标法定量。以进样质量浓度 (x) 为横坐标,相应的峰面积 (y) 为纵坐标,绘制基质标准曲线。
1.3.4 添加回收试验 准确称取空白龙眼样品 (全果、果肉) 10.0 g,分别进行0.01、0.1 和1.0 mg/kg 3 个水平的螺虫乙酯及代谢物B-glu、B-keto、Benol 和B-mono 以及氯虫苯甲酰胺在龙眼全果和果肉上的添加回收试验,每个水平重复5 次。分别按1.3.1 节和1.3.2 节的方法及条件进行提取、净化和测定,计算平均回收率和相对标准偏差 (RSD)。
2 结果与分析
2.1 方法准确度、精密度及检出限
添加回收试验结果表明:螺虫乙酯及其代谢物和氯虫苯甲酰胺在龙眼全果和果肉中的平均回收率分别为83%~103%和87%~92%,RSD 分别为2.3%~8.7%和3.3%~6.3%,定量限均为0.01 mg/kg,符合残留分析检测要求[15]。典型色谱图见图1和图2。
2.2 螺虫乙酯和氯虫苯甲酰胺在龙眼上的最终残留量
结果 (表2) 表明:22.4% 螺虫乙酯SC 按60 mg/kg 施用2 次,距末次施药后14、21 和28 d,在龙眼全果中,螺虫乙酯母体、B-enol、B-keto及B-glu 均有检出,B-mono 低于0.01 mg/kg,果肉中螺虫乙酯及代谢物均低于0.01 mg/kg。
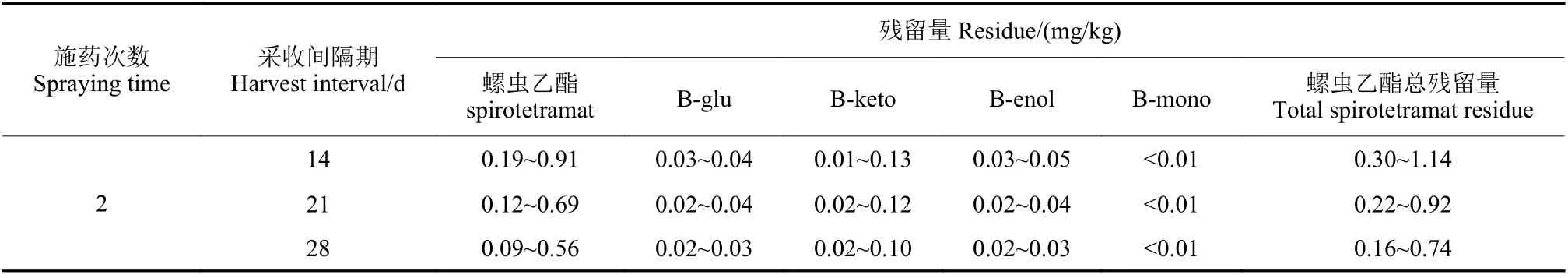
表2 螺虫乙酯及其代谢物在龙眼全果中的最终残留量Table 2 The terminal residues of spirotetramat and its metablolites in whole longan
根据螺虫乙酯残留定义[4,17],螺虫乙酯总量 =螺虫乙酯 + B-glu × 0.806 + B-keto × 1.177 + B-enol ×1.239 + B-mono × 1.231。
已有的研究结果表明,螺虫乙酯在植物中的一级代谢产物为B-enol > B-keto,其中B-enol 能进一步去甲基化、还原或氧化,得到产物B-keto、B-glu、B-mono 和B-desmsthyl-enol,螺虫乙酯在不同作物中降解速率不同,而且不同作物中残留代谢物种类及含量分布也有所不同[11-12]。
结果 (表3) 表明:5% 氯虫苯甲酰胺SC 按50 mg/kg 施用2 次,距末次施药后7、14 和21 d,氯虫苯甲酰胺在龙眼全果中亦均有检出,而在龙眼果肉中的残留量均低于0.01 mg/kg。

表3 氯虫苯甲酰胺在龙眼全果中的最终残留量Table 3 The terminal residues of chlorantraniliprole in whole longan
龙眼果实由果皮、果肉 (假果皮)、种子构成。依据《农作物中农药残留试验准则》[15]和《食品中农药最大残留限量》[6]的规定,以及JMPR制定的氯氰菊酯在龙眼上的残留限量[18],龙眼属皮不可食小型果,检测部位为去果核后的整个果实和果肉,但整个果实的残留量计算包括果核。陈秀萍等[19]研究了中国福建、广东、广西、四川以及泰国、越南来源的龙眼,结果表明,种子占果实的质量比为13.6%~19.4%。果核占全果的质量比因品种和采收时间不同而不同,本研究针对每一批次的样品测得果核占全果的质量比为10%~20%,测定后一一对应进行折算,因此折算后的残留量比实际测得的残留量低。
3 结论与讨论
本研究采用乙腈提取,PSA 吸附剂净化,HPLC-MS/MS 检测分析,建立了螺虫乙酯及其代谢物和氯虫苯甲酰胺在龙眼中残留量的检测方法,并依据此方法对22.4%螺虫乙酯SC、5%氯虫苯甲酰胺SC 在龙眼上的最终残留样品进行了检测。结果表明,末次施药后14 d,螺虫乙酯和氯虫苯甲酰胺在龙眼全果中的残留量分别为0.30~1.14 和0.06~0.29 mg/kg,在果肉中的残留量分别为 <0.05 和 <0.01 mg/kg。全果中的残留量为果肉中的6~30 倍,表明螺虫乙酯和氯虫苯甲酰胺主要残存在果皮中。这可能是由于果皮为直接着药部位,因此在龙眼干的加工过程中应注意去除果皮上残留的农药。
中国尚未制定这两种农药在龙眼上的MRL值。特色小宗作物登记农药品种短缺与其病虫害防控农药需求之间的矛盾,给各地农业主管部门在农药经营和使用环节的监督管理造成困难。由于缺少相关的药效、残留等试验,生产中违规使用容易造成药害、残留超标等问题,直接影响农产品质量安全。因此,加快推进特色小宗作物用药登记,解决特色小宗作物用药短缺问题,有利于进一步强化农药监管,保障农药使用安全,保障农产品质量安全。
