果蔬中螺虫乙酯的检测技术及消解动态研究进展
2017-03-23叶玉凤朱丽莎焦必宁JI
叶玉凤 - 周 杰 刘 炎 敖 艳 朱丽莎 - 张 静 焦必宁JI -
(1. 西南大学柑桔研究所,重庆 400712;2. 西南大学食品科学学院,重庆 400715)
螺虫乙酯(spirotetramat),化学名称为4-(乙氧基羰基氧基)-8-甲氧基-3-(2,5-二甲苯基)-1-氮杂螺[4,5]-癸-3-烯-2-酮,是德国拜耳公司开发的一种新型螺环季酮酸类杀虫杀螨剂,具有双向内吸传导性能,通过抑制乙酰辅酶A羧化酶活性,干扰脂肪生物合成,阻断害虫正常的能量代谢,最终致死亡,持效期长,可有效防治各种刺吸口器类害虫和害螨,如蚜虫、蓟马、木虱、粉蚧、粉虱和介壳虫等[1-3]。研究[4-7]表明,螺虫乙酯对人的皮肤有致敏性,对眼睛有刺激性,对一些非靶标陆地节肢动物有潜在风险,特别对水生生物有中到高的毒性。此外,螺虫乙酯进入动、植物体后会生成代谢物BYI08330-enol、BYI08330-ketohydroxy、BYI08330-enol-glucoside、BYI08330-mono-hydroxy(见图1),现有研究[8]初步表明,代谢物B-keto和B-mono的毒性均低于母体螺虫乙酯,但代谢物B-enol的毒性与母体相当,且能引起雄性大鼠生殖毒性,而代谢物B-glu的毒性尚不清楚。
调查发现市售果蔬及其制品中螺虫乙酯的残留量较低,Priyadarshini等[9]2014~2015年对印度安得拉邦和泰伦加纳市咖喱叶中的螺虫乙酯残留情况进行调查,仅在2015年的极少数咖喱叶中检测到螺虫乙酯,含量约为0.056 mg/kg。美国FDA的2014年农残检测报告[10]显示,螺虫乙酯在初级农产品及其加工食品中的检出率低于2%,且残留量均低于美国规定的MRLs值,该结果与往年对螺虫乙酯的监测结果相同。本实验室2016年检测了中国多个省份采集的柑橘类水果和枇杷样品,发现少量柑橘和枇杷中有螺虫乙酯检出,但值得关注的是该药并没有在中国枇杷上登记使用。因此,随着螺虫乙酯使用量增大,应考虑将其列入中国农药残留监测计划体系。本文从登记情况、限量标准、检测技术、消解动态和残留现状等方面综述螺虫乙酯的研究状况,以期为果蔬中螺虫乙酯的限量标准制订、残留监控、安全性评价和合理使用等提供参考。
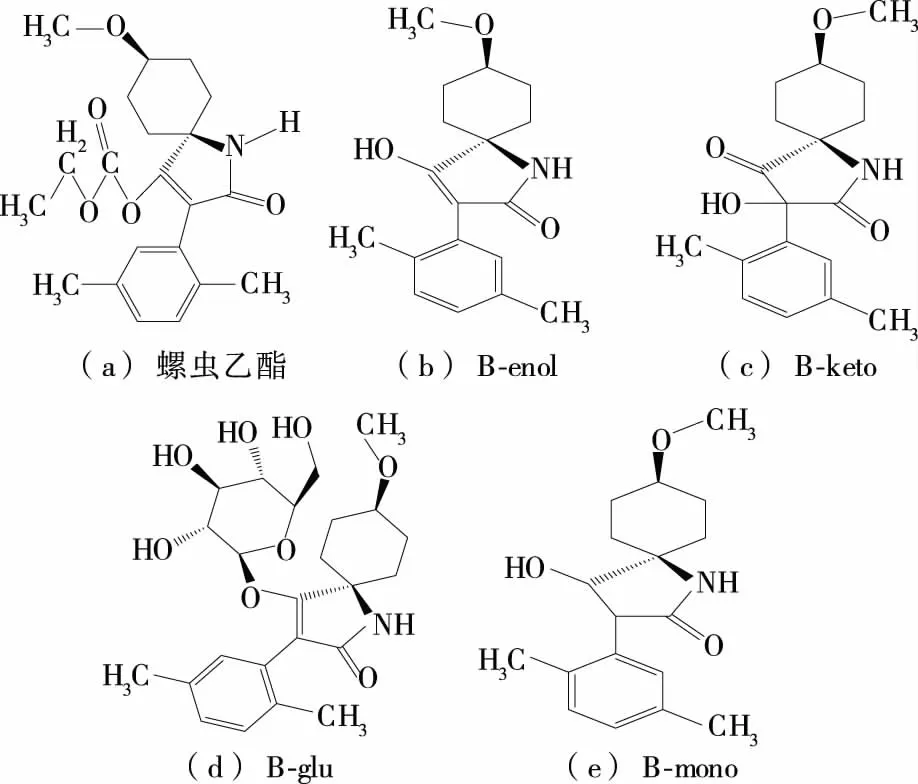
图1 螺虫乙酯及其代谢物的结构式Figure 1 Chemical structure of spirotetramat and its metabolites
1 螺虫乙酯的登记情况
螺虫乙酯于2007年获全球首次登记,之后市场扩张迅速,现已在美国、中国、新西兰、奥地利等70多个国家登记上市,应用作物包括大豆、柑橘、苹果、热带果树、坚果、葡萄、土豆和蔬菜等[11]。截至2018年3月,中国已有19家农药企业登记螺虫乙酯,批准登记的21个产品中,原药10个,制剂11个(复配剂9个,单剂2个),其中9个为悬浮剂,仅2个水分散粒剂[12]。登记作物及防治对象主要为甘兰蚜虫、番茄烟粉虱、黄瓜烟粉虱、辣椒烟粉虱、苹果树棉蚜、梨树梨木虱、柑橘树红蜘蛛、木虱、红蜡蚧和介壳虫[12]。但与国外相比,螺虫乙酯在中国的登记种类少、范围窄。
2 果蔬中螺虫乙酯的限量标准
目前,中国并没有对苹果树、梨树和黄瓜上登记使用的螺虫乙酯规定相应限量,这必将导致中国农产品质量监控缺乏依据。而且,在已规定限量的登记作物中(如柑橘),由于检测方法标准缺失,限量标准对农产品质量安全的规范作用也大打折扣。同时,与国际食品法典委员会(CAC)[13]、欧盟[14]、美国[15]、日本[16]等主要国际组织和国家的果蔬中螺虫乙酯限量标准对比,发现中国GB 2763—2016标准存在以下问题:
(1) 总体数量偏少。中国在果蔬上规定的螺虫乙酯最大残留限量有21项,略低于CAC的24项,但与欧盟的101项、美国的52项、日本的87项相比,差距明显。
(2) 表述过于笼统。例如,中国标准对仁果类水果仅制定了1个笼统的限量指标,欧盟则分别为苹果、梨、榅桲、枸杞、枇杷和其它仁果类水果制定了6个。
(3) 限量要求与CAC和欧盟标准基本一致,超70%的限量完全相同,但大多数较美国和日本标准严格,约60%表现偏严。
(4) 定义不够全面。中国规定螺虫乙酯的残留为螺虫乙酯及其烯醇类代谢物之和,而CAC和日本则明确规定烯醇类代谢物为B-enol;与欧盟和美国相比,中国未将主要代谢物B-keto、B-glu和B-mono列入检测项[17]。
3 螺虫乙酯的残留检测技术
国内外螺虫乙酯残留检测以色谱法为主,其它农残检测方法目前尚未有报道。色谱法主要有:高效液相色谱法(HPLC-UV、HPLC-PDA)和色谱—质谱法(GC-MS、HPLC-MS、HPLC-MS/MS),但GC-MS报道很少。
3.1 高效液相色谱法
高效液相色谱法是在经典液相色谱法的基础上,引入气相色谱的理论发展起来的分析方法,能对热稳定性差、难挥发、极性强的农药进行检测[18]。HPLC常与紫外吸收(UV)和光电二极管阵列(PDA)检测器配合,广泛用于检测多种果蔬中螺虫乙酯的残留。
柱层析、固相萃取(SPE)和分散液-液微萃取(DLLME)法是HPLC分析中常用的前处理方法[19]。王珏[20]16采用振荡提取—弗罗里硅土层析柱净化法结合HPLC测定番茄及其叶片中螺虫乙酯残留,方法回收率为86.6%~121.4%,LOD为0.02~0.025 mg/kg。杜芳[21]25用NH2固相萃取柱净化,HPLC-UV法检测大豆植株、青豆、成熟大豆中的螺虫乙酯,平均回收率82.6%~88.9%,LOQ为0.02 mg/kg。Singh等[22]采用DLLME-HPLC-PDA法检测秋葵、红/绿辣椒、土壤、茄子及其叶片中的螺虫乙酯和代谢物B-enol,方法回收率82%~97%,LOQ为0.03 mg/kg。但柱层析和SPE法存在溶剂用量大、操作繁琐、耗时长、重现性差等缺点,DLLME操作简单,却难以适合基质复杂的果蔬样品[23]。Wu等[24]利用QuEChERS提取,HPLC法检测蘑菇等7种果蔬中螺虫乙酯残留,方法回收率为76.9%~106.7%,定量限为0.05~0.10 mg/kg。QuEChERS具有快速、简单、廉价、安全、可靠等优点,但净化效果不如SPE等方法,而HPLC对前处理的要求较高,需将基质中的干扰成分尽量除去,否则影响定性、定量,出现假阳性和假阴性结果[25-26]。此外,螺虫乙酯及其多种代谢物间结构、物化性质相似[27],且在果蔬中含量较低[28],而HPLC的检测器灵敏度不高[29],因此HPLC法难以同时检测多种螺虫乙酯代谢物。
3.2 色谱-质谱联用法
质谱在定性方面有着不可比拟的优势。色谱-质谱联用法能同时发挥色谱法的高分离和质谱法的高鉴别能力,其不仅能依据保留时间定性,更重要是能通过分析物裂解的离子碎片所提供的分子结构信息对定性予以确认,减少了假阳性和假阴性发生的概率[30-32]。目前螺虫乙酯的主要代谢物已成为常规检测指标,而质谱联用技术(MS),尤其是串联质谱技术(MS/MS)在多农药残留组分同时检测方面应用较多,包括气-质联用(GC-MS)和液-质联用(LC-MS)。
郭庆龙等[33]利用GC-MS技术检测了黄瓜、洋葱和苹果中的螺虫乙酯残留,方法LOQ为2.51 μg/kg,回收率为79.8%~101.0%。引入质谱技术后可以简化前处理程序,QuEChERS前处理技术常与液相色谱-质谱联用法相结合[34]。Aldanamadrid等[35]利用QuEChERS结合HPLC-MS法测定葡萄和葡萄叶中的螺虫乙酯和B-enol残留,方法回收率为89%~109%,LOQ为0.002 mg/kg。孟志远等[36]采用优化的QuEChERS净化菠菜、水体、土壤等复杂基质, HPLC-MS/MS测定螺虫乙酯及其代谢物,方法回收率为81%~103%,LOQ为0.000 3~0.001 mg/kg。Zhu等[37]利用QuEChERS-UPLC-MS/MS法同时检测6种果蔬中的螺虫乙酯及其4种代谢物,方法回收率为82%~110%,定量限达0.3~9.0 μg/kg,分离速度较HPLC更快速。根据已有文献[38-40]表明,液-质联用法比GC-MS灵敏度更高、适用范围更广;与HPLC相比,液-质联用法结果更可靠、灵敏度更高,且对复杂基质的检测效果更好。QuEChERS-液相色谱-质谱联用技术将成为螺虫乙酯残留检测的主流手段,但仪器价格昂贵,一般实验室普及较困难。
4 螺虫乙酯的消解动态
4.1 果蔬田间试验中螺虫乙酯的消解动态
螺虫乙酯在果蔬中属易降解农药,但不同果蔬中降解速度不同,大豆[21]30、芒果[41]、辣椒[42-45]、茄子[46-47]、荷兰芹[48]、莳萝[48]、萝卜[48]中较快(农药消解半衰期T1/2≤5 d),黄瓜[49]、柑橘[50]、葡萄[37,51]中属中等(5 d 如今,农药的代谢产物已成为农药残留安全性评价的关注热点之一。而螺虫乙酯在果蔬中的代谢物B-enol、B-keto、B-mono、B-glu也有研究报道,不同作物中残留代谢物的种类和含量分布有所不同。 Li等[44]试验发现,药后2 h,北京地区辣椒中螺虫乙酯及其代谢物B-keto、B-glu、B-enol的初始沉积量分别为0.166,0.03,0.03,≤ 0.001 mg/kg,随时间推移,螺虫乙酯快速降解,半衰期1.21 d;B-keto先增后减,药后3 d升至最大,药后28 d低于定量限;B-glu的含量一直保持在0.03 mg/kg左右;而B-enol始终低于0.001 mg/kg。说明一级代谢物B-enol 能在辣椒中迅速转化为其它次级代谢物。Biju等[42]和Chahil等[45]的试验也证实了该结论,不同剂量处理青辣椒或红辣椒,样品中始终未检测到代谢物B-enol。21.6%噻虫啉·螺虫乙酯按推荐用量和1.5倍推荐用量喷施2~3次,收获辣椒中螺虫乙酯的最终残留量(螺虫乙酯+B-enol+B-keto+B-glu)低于中国农药残留限量值MRL(2 mg/kg)[44]。 吴文铸等[50]的试验结果显示,喷药2 h后,重庆柑橘中检测到代谢物B-enol > B-keto > B-glu,而福州和苏州两地柑橘中仅检测到代谢物B-enol > B-keto。螺虫乙酯的最终残留量为果肉 < 全果 < 果皮 < 1.0 mg/kg(中国柑橘MRL),其中,全果和果肉中以螺虫乙酯和B-enol残留居多,而果皮中B-keto含量也很高。说明B-enol和B-keto是柑橘中螺虫乙酯的常见代谢物,果肉中以B-enol为主,果皮中以B-keto为主,而B-glu的存在与否受环境影响大。 Chen Xiaojun等[52]研究发现,推荐和加倍推荐用量处理菠菜,药后2 h,菠菜叶内检出4种成分,且螺虫乙酯>B-enol>B-keto>B-glu,而菠菜茎内检出3种,且螺虫乙酯>B-enol>B-glu,菠菜根内检出2种,为螺虫乙酯>B-enol,总残留水平表现为菠菜叶>茎>根;之后,这些物质在菠菜叶、茎和根中的残留量仍按上述顺序分布,并逐渐降低;药后28 d,所有物质含量低于检出限。表明同一作物的不同部位上,螺虫乙酯的代谢方式存在差异,菠菜叶上螺虫乙酯先降解为B-enol和B-keto,随后B-enol进一步转化为B-glu;茎上螺虫乙酯先仅降解为B-enol,B-enol进而再转化为B-glu;根上最终仅有B-enol生成。ozowicka等[48]同样发现,大棚栽培条件下,螺虫乙酯进入荷兰芹、莳萝和萝卜嫩叶中能生成3种代谢物,其含量B-enol>B-keto>B-glu,而根中仅有代谢物B-enol生成,并且,螺虫乙酯在这3种作物的嫩叶和根中的降解途径分别与菠菜叶和根中相同。 代谢物B-mono在果蔬中并不常见,Faraji等[53]检测发现,施药后2 h,开心果中母体螺虫乙酯的含量最高,其次是代谢物B-mono和B-glu,B-keto有少量检出;施药后14 d,B-mono 略有降低,B-keto仍仅有少量检出,而螺虫乙酯含量明显减少,转而B-glu变为最高。螺虫乙酯在果蔬中的降解一般慢于土壤中,而其在土壤上的降解速度和代谢行为受施药浓度影响较小,受土壤自身性质(如pH、微生物含量)影响较大[20]22[54]。其它试验[48,50,52]表明,种植菠菜、荷兰芹、萝卜和莳萝的土壤中检出螺虫乙酯代谢物主要为B-keto和B-mono,药后28 d两者含量低于定量限,而在种植柑橘的土壤中也能检出B-glu,但降解较快。 大多数加工工艺有助于螺虫乙酯及其代谢物残留量的减少,清洗和去皮是去除残留最有效的方式,而杀菌等受温度影响的加工过程会提高某些物质的残留水平,甚至改变性质。 Liu等[55]研究了家庭制作柑橘果酱过程中螺虫乙酯及其代谢物B-enol、B-glu、B-keto的变化,结果表明,清洗使鲜果中螺虫乙酯、B-enol、B-keto残留下降41.2%~83.1%,B-glu 仅降低15.0%。这些物质大多存在果皮中,而果皮脱苦对B-enol和果皮浸糖对B-glu的去除效果均不明显。但经一系列工艺后,果酱产品中仅检测到B-keto,可能是熬制升温导致螺虫乙酯或其它代谢物向B-keto转化,且其残留量仅为0.010 mg/kg,远低于柑橘中螺虫乙酯的最大残留限量(1 mg/kg)。Han等[56]研究发现,苹果酒加工过程中,螺虫乙酯及其代谢物B-enol的残留均显著降低,其中削皮和去核对二者的去除率高达76.4%,超高温瞬时杀菌却使B-enol增加了33.4%。有报道[8]指出,灭菌能使螺虫乙酯和B-glu大量降解生成B-enol,使B-keto降解生成代谢物spirotetramat-MA-amide。 上述螺虫乙酯残留消解动态的研究结果表明:螺虫乙酯属易降解农药,降解速度主要与果蔬品种、农药剂型以及气温等环境因素有关,受用药量影响小;B-enol、B-keto和B-glu是果蔬中常见的螺虫乙酯代谢物,但3种代谢物的残留比例和降解趋势取决于果蔬品种,甚至同一果蔬的不同部位上也不同;B-keto和B-mono是土壤中常见的螺虫乙酯代谢物;收获果蔬及其土壤中螺虫乙酯的最终残留水平很低,低于国家相关MRL标准;果蔬加工能进一步减少产品中螺虫乙酯及其代谢物的含量。 螺虫乙酯因低毒、低残留特性必将在未来杀虫剂市场中占据重要位置。近年来,国内外越来越注重研究螺虫乙酯及其4种代谢物B-enol、B-keto、B-glu、B-mono在作物中的残留水平,这能为螺虫乙酯的膳食风险评估提供更准确的农药残留数据。但仍需加强对母体螺虫乙酯及其代谢物对人和动物及其它有益生物的单一毒性及联合毒性研究,如体外毒性试验和体内毒性试验,以期提供有关螺虫乙酯更科学的毒理学数据。此外,为更有效地避免由螺虫乙酯残留引发的人体危害和环境污染问题发生,文章针对螺虫乙酯各方面的残留研究现状,提出了以下几点建议:① 尽快完善中国果蔬螺虫乙酯最大残留限量标准体系,使之适应质量安全监管、生产指导和出口贸易的要求;② 不断提高螺虫乙酯残留检测技术水平,尤其是加强快速检测技术的建设;③ 引导果农科学、合理用药,强化果蔬生产中螺虫乙酯的安全使用;④ 加强果蔬生产过程中螺虫乙酯的残留监控及流通领域的监督抽查力度;⑤ 重视开展收获后果蔬中螺虫乙酯残留的消解及生物、化学等去除手段的研究。 [1] 王雪丽, 卢少华, 刘明杨, 等. 螺虫乙酯及其在刺吸式害虫防治中的研究进展[J]. 华中昆虫研究, 2014, 10(12): 162-168. [2] LÜMMEN P, KHAJEHALI J, LUTHER K, et al. The cyclic keto-enol insecticide spirotetramat inhibits insect and spider mite acetyl-CoA carboxylases by interfering with the carboxyltransferase partial reaction[J]. Insect Biochemistry & Molecular Biology, 2014, 55: 1-8. [3] BRÜCK E, ELBER A, FISCHER R, et al. Movento®, an innovative ambimobile insecticide for sucking insect pest control in agriculture: Biological profile and field performance[J]. Crop Protection, 2009, 28(10): 838-844. [4] ZHANG Qing-ming, ZHANG Guo-li, YIN Pei-jun, et al. Toxicological effects of soil contaminated with spirotetramat to the earthworm Eiseniafetida[J]. Chemosphere, 2015, 139: 138-145. [5] YIN Xiao-hui, JIANG Sheng-ju, YU Jun, et al. Effects of spirotetramat on the acute toxicity, oxidative stress, and lipid peroxidation in Chinese toad (Bufobufogargarizans) tadpoles[J]. Environmental Toxicology & Pharmacology, 2014, 37(3): 1 229-1 235. [6] 毛晨蕾, 王珏, 江盛菊, 等. 螺虫乙酯对雌性斑马鱼的毒性及氧化应激效应[J]. 农药学学报, 2014, 16(3): 300-306. [7] 吴慧明, 魏方林, 朱国念, 等. 螺虫乙酯在染毒雄性大鼠体内的分布与代谢[J]. 农药学学报, 2012, 14(4): 417-422. [8] AUTHORITY E F S. Conclusion on the peer review of the pesticide risk assessment of the active substance spirotetramat[J]. Efsa Journal, 2013, 11(6): 2 343-2 378. [9] PRIYADARSHINI G, VEMURI S, REDDY N. Determination ofpesticide residues in curry leaf in different markets of Andhra pradesh and Telangana, India[J]. IJEAB: Open Access Bi-Monthly International Journal: Infogain Publication, 2017, 2(1): 101-105. [10] U.S. Food & Drug Administration. Pesticide residue monitoring program[EB/OL]. (2017-03-10) [2018-03-04]. https://www.fda.gov/food/foodborneillnesscontaminants/pesticides/ucm200 6797.htm. [11] 叶萱. 具新颖作用机制杀虫杀螨剂——螺虫乙酯[J]. 世界农药, 2011, 33(5): 54-55. [12] 中国农药信息网农业部农药检定所. 中国农药信息网农药登记数据查询系统[DB/OL]. (2018-01-28) [2018-03-04]. http://www.chinapesticide.gov.cn/hysj/index.jhtml. [13] Codex Alimentarius Commission. Codex pesticide residues in food online database[DB/OL]. (2017-08-02) [2018-03-04]. http://www.fao.org/fao-who-codexalimentarius/standards/pestres/en. [14] European Commission. EU Pesticide Database[DB/OL]. (2017-01-19) [2018-03-04]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.re-sidue.selection&language=EN. [15] Electronic Code of Federal Regulations. Tolerances for residues of pesticides in food[DB/OL]. (2017-06-15) [2018-03-04]. https://www.ecfr.gov/cgi-bin/retrieveECFR?gp=&SID=070b23976846e6a17f6cbfdb3849a38c&mc=true&n=pt40.26.180&r=PART&ty=HTML. [16] The Japan Food Chemical Research Foundation. Maximum residue limits (MRLs) list of agricultural chemicals in foods[DB/OL]. (2018-02-01) [2018-03-04]. http://www.m5.ws001.squarestart.ne.jp/foundation/search.html. [17] Authority E F S. Modification of the existing maximum residue levels for spirotetramat in various crops[J]. Efsa Journal, 2016, 14(3): 4 429-4 434. [18] MOHAPATRAS S, DEEPA M, JAGADISH G K. An efficient analytical method for analysis of spirotetramat and its metabolite spirotetramat-enol by HPLC[J]. Bulletin of Environmental Contamination & Toxicology, 2012, 88(2): 124-128. [19] 田宏哲, 杜芳, 苑馨方, 等. 高效液相色谱法测定蔬菜中螺虫乙酯的残留[J]. 农药, 2015(4): 289-291. [20] 王珏. 螺虫乙酯在番茄植株及土壤中的降解行为规律[D]. 杭州: 浙江农林大学, 2014. [21] 杜芳. 螺虫乙酯在大豆和土壤中的消解动态及最终残留研究[D]. 沈阳: 沈阳农业大学, 2016. [22] SINGH B, MANDAL K, SAHOO S K, et al. Development and validation of an HPLC method for determination of spirotetramat and spirotetramatcis enol in various vegetables and soil[J]. Journal of Aoac International, 2013, 96(3): 670-675. [23] PASTORBELDA M, GARRIDO I, CAMPILLO N, et al. Determination of spirocyclictetronic/tetramic acid derivatives and neonicotinoid insecticides in fruits and vegetables by liquid chromatography and mass spectrometry after dispersive liquid-liquid microextraction[J]. Food Chemistry, 2016, 202: 389-395. [24] WU Jun-xue, WANG Cheng-ju, WANG Kai, et al. Determination of spirotetramat in complex matrices combining QuEChERs and solid phase extraction followed by high performance liquid chromatography[J]. Asian Journal of Chemistry, 2015, 27(8): 2 779-2 782. [25] SUN Da-li, PANG Jun-xiao, JIAO Bi-ning, et al. Multiresidue method for the simultaneous determination of 16 acaricides by modified quick, easy, cheap, effective, rugged, and safe extraction and ultra-high performance liquid chromatography coupled with tandem mass spectrometry in citrus[J]. Journal of Separation Science, 2015, 38(22): 3 845-3 851. [26] 张亚佳, 李忠海. 果蔬中有机磷农药残留检测方法研究进展[J]. 食品与机械, 2016, 32(2): 173-177. [27] 李菊颖, 吴文铸, 孔德洋, 等. 超高效液相色谱-质谱法测定柑橘和土壤中螺虫乙酯及4种代谢产物[J]. 农药, 2016(1): 45-47. [28] 刘炎, 欧阳迪庆, 王成秋, 等. QuEChERS结合超高效液相色谱-串联质谱法同时测定番茄中噻虫嗪, 噻虫胺, 螺虫乙酯及其代谢物残留[J]. 分析测试学报, 2017, 36(12): 1 431-1 438. [29] 严会会, 胡斌, 刘惠民, 等. 高效液相色谱串联质谱法分析烟草中15种农药残留[J]. 烟草科技, 2011(7): 43-47. [30] 陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283-289. [31] BURRIS V, GORICA V, ŽARKO I, et al. Development and validation of new multiresidue method for the determination of multiclass pesticide residue using LC-MS/MS in onions[C]// International Symposium on Analytical and Environmental Problems. Szeged: University of Szeged, 2016: 94-98. [32] 王海凤, 王俊斌, 刘海学, 等. 气质联用法同时测定果蔬中多种有机磷农药残留[J]. 食品与机械, 2013, 29(1): 92-94. [33] 郭庆龙, 管旭芳, 赵勇, 等. 气相色谱-质谱法测定蔬菜和水果中螺虫乙酯的残留量[J]. 理化检验: 化学分册, 2017, 53(8): 885. [34] 刘满满, 康澍, 姚成. QuEChERS方法在农药多残留检测中的应用研究进展[J]. 农药学学报, 2013, 15(1): 8-22. [35] ALDANAMADRID M L. Dissipation of spirotetramat and spirotetramat-enol in leaf and fruit of Grape variety red globe (Vitis Vinifera L.)[J]. Journal of Progressive Research in Biology, 2015, 2(1): 60-65. [36] 孟志远, 任莉, 宋玥颐, 等. 液相色谱-串联质谱法同时测定菠菜, 土壤及水体中螺虫乙酯及 4 种代谢物残留[J]. 农药学学报, 2017, 19(4): 482-490. [37] ZHU Yu-long, LIU Xin-gang, XU Jun, et al. Simultaneous determination of spirotetramat and its four metabolites in fruits and vegetables using a modified quick, easy, cheap, effective, rugged, and safe method and liquid chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1 299(14): 71-77. [38] 韩丙军, 林冰, 黄海珠, 等. 超高效液相色谱-串联质谱法测定动物源食品中螺虫乙酯及其代谢物残留[J]. 食品科技, 2017, 42(12): 297-302. [39] 施雅, 张小刚, 王霞, 等. UPLC—MS/MS法测定四种果蔬中螺虫乙酯残留量[J]. 食品与机械, 2014, 30(5): 93-96. [40] 袁文悦, 庄慧生. 高效液相色谱-串联质谱法测定土壤中螺虫乙酯及其4种代谢产物[J]. 世界农药, 2017, 39(4): 59. [41] MOHAPATRAS S, DEEPA M, LEKHA S, et al. Residue dynamics of spirotetramat and imidacloprid in/on mango and soil[J]. Bulletin of Environmental Contamination & Toxicology, 2012, 89(4): 862-867. [42] BIJU M T, NASEEMA B S, THOMAS G, et al. Persistence and dissipation of combination-mix (Spirotetramat+Imidacloprid) on chilli (CapsicumannumL.)[J]. Pesticide Research Journal, 2012, 24(2): 151-154. [43] VINOTHKUMAR B, KUTTALAM S, CHANDRASEKAR-AN S. Dissipation pattern of spirotetramat in/on green chillies[J]. Pesticide Research Journal, 2012, 24(1): 96-100. [44] LI Sha-sha, LIU Xin-gang, DONG Feng-shou, et al. Chemometric-assisted QuEChERS extraction method for the residual analysis of thiacloprid, spirotetramat and spirotetramat’s four metabolites in pepper: Application of their dissipation patterns[J]. Food Chemistry, 2016, 192: 893-899. [45] CHAHIL G S, MANDAL K, SAHOO S K, et al. Risk assessment of mixture formulation of spirotetramat and imidacloprid in chilli fruits[J]. Environmental Monitoring & Assessment, 2015, 187(1): 1-8. [46] PAUL A, BEEVI S N, MATHEW T B, et al. Dissipation of spirotetramat 150 OD on brinjal (Solanummelongena L)[C]//AMBILY Paul. National Symposium on Agrochemicals Research and Education in Indian: Appraisal and Road Map for Future. India: Division of Agricultural Chemicals, 2016: 15-17. [47] BHARDWAJ U, JYOT G, MANDAL K, et al. Residues of spirotetramat and imidacloprid in brinjal (SolanummelongenaL.) and their risk assessment [J]. Pesticide Research Journal, 2016, 28(1): 35-41. [49] 吴育佳, 杨仁斌, 聂红英. 螺虫乙酯在黄瓜及其土壤中残留量检测方法及残留规律研究[J]. 中国农学通报, 2015(35): 110-115. [50] 吴文铸, 李菊颖, 何健, 等. 螺虫乙酯在柑橘中的残留消减动态[J]. 生态与农村环境学报, 2016, 32(6): 1 003-1 007. [51] MOHAPATRA S, KUMAR S, PRAKASH G S. Residue evaluation of imidacloprid, spirotetramat, and spirotetramat-enol in/on grapes (Vitisvinifera, L.) and soil[J]. Environmental Monitoring & Assessment, 2015, 187(10): 1-12. [52] CHEN Xiao-jun, MENG Zhi-yuan, ZHANG Yan-yan, et al. Degradation kinetics and pathways of spirotetramat in different parts of spinach plant and in the soil[J]. Environmental Science & Pollution Research, 2016, 23(15): 1-10. [53] FARAJI M, NOORBAKHSH R, SHAFIEYAN H, et al. Determination of acetamiprid, imidacloprid, and spirotetramat and their relevant metabolites in pistachio using modified QuEChERS combined with liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2017, 240: 634-641. [54] PANDISELVI V, SANTHIYANARAYANAN S, RAMESH A. Dissipation of spirotetramat and imidacloprid in four different tropical soils-confirmation of residues by electrospray tandem mass spectrometry[J]. Pesticide Research Journal, 2011, 23(1): 45-51. [55] LIU Yan-yu, SU Xue-su, JIAN Qiu, et al. Behaviour of spirotetramat residues and its four metabolites in citrus marmalade during home processing[J]. Food Additives & Contaminants Part A, 2016, 36(7): 699-704. [56] HAN Yong-tao, XU Jun, DONG Feng-shou, et al. The fate of spirotetramat and its metabolite spirotetramat-enol in apple samples during apple cider processing[J]. Food Control, 2013, 34(2): 283-290.4.2 果蔬加工中螺虫乙酯的消解动态
5 展望
