lncRNA NCRNA00173靶向miR-765对骨肉瘤细胞增殖、迁移和侵袭的影响的实验研究
2021-12-20吴昌强郑一鸣林正坚
吴昌强,韦 敏,郑一鸣,林正坚
(海南省海口市第三人民医院骨科,海口 571100)
骨肉瘤(osteosarcoma)是儿童和青少年中发病率最高的恶性骨肿瘤,临床上定位于长骨的干骺端。骨肉瘤常见于早期转移和肺转移,是导致骨肉瘤患者死亡的主要原因[1]。尽管数十年来研究者付出了很多努力,但骨肉瘤患者的五年生存率仍然不能令人满意。由于骨肉瘤的早期症状是非特异性的,且治疗有限[2]。因此,确定骨肉瘤的新诊断标志物和治疗靶标至关重要。长非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200 个核苷酸的非编码RNA分子,在多种生物学过程中具有重要功能,例如淋巴结的转移、细胞凋亡和细胞周期控制、细胞发育和分化、转录和翻译调控以及中枢代谢[3-5]。越来越多的证据证实,lncRNA 的表达失调通常与人类许多疾病有关,包括骨肉瘤在内的多种类型的癌症[6-7]。最近,发现一种新的lncRNA NCRNA00173 在肝癌中表达失调[8]。徐绘华等[9]通过lncRNA 芯片及实验发现,NCRNA00173 在骨肉瘤组织中表达下调,且其低表达与肿瘤分化、远处转移以及疾病分期密切相关。然而,NCRNA00173在骨肉瘤中的作用及潜在的分子机制知之甚少。本项研究旨在探讨lncRNA NCRNA00173对骨肉瘤细胞的增殖、迁移和侵袭的影响,并探究其可能的作用机制,以期为骨肉瘤的靶向治疗提供实验依据。
1 材料与方法
1.1 细胞和主要试剂 骨肉瘤细胞株U2-OS、Saos-2、SJSA-1 和SOSP-9607 购于美国ATCC;人成骨细胞hFOB1.19 购于中国科学院上海细胞库;DMEM培养基购于美国Gibco;脂质体Lipofectamine 2000转染试剂购于美国Invitrogen;胎牛血清和胰蛋白酶购于美国HyClone;总RNA 提取试剂盒、逆转录试剂盒和实时荧光定量PCR(qPCR)检测试剂盒购于赛默飞世尔科技有限公司;miR-765 mimics及mimics control购于广州市锐博生物科技有限公司;双荧光素酶报告基因检测试剂盒购于美国Promega;含miR-765结合位点NCRNA00173野生型荧光素酶重组报告质粒(NCRNA00173-Wt)和含miR-765 结合位点NCRNA00173 突变型荧光素酶重组报告质粒(NCRNA00173-Mut)购于上海吉玛制药技术有限公司;实验所用引物、pcDNA3.1 载体和pcDNANCRNA00173 重组载体质粒购于上海生工生物工程有限公司;Transwell 小室购于美国Coming Costar;Matrigel 基质胶购于BD Biosciences;增殖细胞核抗原(PCNA)、基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)单克隆抗体和二抗购于美国CST;ECL化学发光试剂、细胞裂解液、BCA蛋白浓度测定试剂盒购于赛默飞世尔。
1.2 细胞培养 将骨肉瘤细胞U2-OS、Saos-2、SJSA-1、SOSP-9607 和人成骨细胞hFOB1.19 置于含5%CO2、37 ℃恒温培养箱中,并采用含10%胎牛血清、100 U/mL 青-链霉素的DMEM 培养基进行培养。使用显微镜及时观察细胞生长情况,每隔1 d更换1 次培养液,待细胞达85%汇合时进行传代培养。
1.3 细胞转染 对数生长期的U2-OS 细胞种植于6孔板中,于37 ℃恒温培养箱过夜培养,待细胞生长融合度至60%左右时,使用Lipofectamine 2000转染试剂将pcDNA-NCRNA00173质粒或空载质粒转染至U2-OS细胞,具体操作参照转染试剂说明书。其中转染pcDNA-NCRNA00173 质粒的细胞作为NCRNA00173组,转染空载质粒的细胞作为pcDNA组,未行转染的细胞作为空白对照即Con 组。转染后各组U2-OS 细胞于37 ℃培养箱持续培养48 h,收集各组细胞进行后续相关指标检测。
1.4 qPCR 实验检测细胞中NCRNA00173 和miR-765 的表达 使用总RNA 提取试剂盒分别提取待测细胞中总RNA,测定RNA 的浓度,选取合格的RNA 利用逆转录试剂盒将RNA 逆转录成cDNA。采用cDNA 为模板,以GAPDH 和U6 为内参,使用qPCR 检测试剂盒分别检测NCRNA00173 和miR-765的相对表达量,扩增条件为:95 ℃预变性5 min;设40个循环,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s。实验数据采用2-ΔΔCt法计算。实验所需引物如下:NCRNA00173,F:5’-ACCTAGTCTTCCTTGGCACATC-3’,R:5’-GGGATATTGATCTGAAGGGTGA-3’。GAPDH,F:5’-CGCTCTCTGCTCCTCCTGTTC-3’,R:5’-ATCCGTTGACTCCGACCTTCAC-3’;miR-765,F:5’-GCCTGGAGGAGAAGGAA-3’,R:5’-GTGCAGGGTCCGAGGT-3’;U6,F:5’-CGCTAGCACATATCGGCTA-3’,R:5’-TTCTGCGACGAATTTGTCAT-3’。
1.5 双荧光素酶报告实验检测NCRNA00173 和miR-765的靶向关系 对数期的U2-OS细胞种植到6 孔板上,于37 ℃恒温培养箱培养,待细胞贴壁后,将NCRNA00173-Wt 和NCRNA00173-Mut 荧光素酶重组载体质粒分别和miR-765 mimics 或mimics control共转染U2-OS细胞,具体转染步骤参照Lipofectamine 2000转染试剂使用说明,转染后的U2-OS细胞37 ℃恒温培养箱继续培养48 h 后,收集细胞,使用双荧光素酶报告基因检测试剂盒测定细胞的相对荧光素酶活性。
1.6 噻唑蓝(MTT)实验检测细胞增殖能力 U2-OS 细胞以3×103个/孔种植于96 孔板上,于37 ℃恒温培养箱培养,待细胞贴壁后进行转染(参考上述1.3项),分别在转染24 h、48 h和72 h时向每孔细胞中添加100 μL MTT 溶液,37 ℃恒温培养箱继续孵育4 h,去上清培养液,再向每孔细胞中添加150 μL二甲基亚砜,待沉淀完全溶解后,使用酶标仪在450 nm 波长处测定每孔细胞的吸光度(OD)值,以OD值反映细胞增殖能力。
1.7 克隆形成实验检测细胞克隆形成能力 U2-OS 细胞按照上述1.3 分组处理,24 h 后以胰蛋白酶消化各组U2-OS 细胞,收集并计数,向每个培养皿中接种300 个细胞,于37 ℃培养箱培养,换液1 次/3 d,培养约2周后出现细胞克隆(肉眼可见)时终止培养,以PBS洗涤2次,采用4%多聚甲醛染色20 min,GIMSA染色液染10 min,观察并计数各组U2-OS细胞克隆形成数(>50 个细胞克隆记为1 个细胞克隆)。
1.8 划痕实验检测细胞迁移能力 U2-OS 细胞按照上述1.3 项分组处理24 h 后,以胰蛋白酶消化各组U2-OS细胞,以3×105个/孔接种到6孔板(背面画有直线)中,待细胞铺满底部时,使用枪头垂直6 孔板背面直线进行划线,以PBS洗涤3次,再加入培养液2 mL,拍照,此时记为0 h,将6 孔板放置在37 ℃培养箱培养24 h,拍照此时记为24 h,采用Image J软件计算U2-OS细胞划痕愈合率。
1.9 Transwell 实验检测细胞侵袭和迁移能力 以0.25%胰蛋白酶消化并收集转染48 h后各组U2-OS细胞,以PBS洗涤3次,使用不含血清的培养液悬浮细胞,调整细胞密度至5×105/mL。在Transwell小室的下室加入含10%胎牛血清的培养液500 μL,在上室(小室的上室未以Matrigel 基质胶包被的为细胞迁移实验,上室以Matrigel 胶包被的为细胞侵袭实验)加入200 μL 细胞悬液,将小室放置在37 ℃恒温培养箱继续培养48 h,取出Transwell 小室,用干净的棉签拭去上室未穿过膜的细胞,用多聚甲醛固定,随后使用0.1%的结晶紫染色10 min,使用倒置显微镜随机选取6 个视野拍照并计数,以穿膜细胞数反映U2-OS细胞的迁移或侵袭能力。
1.10 蛋白质印迹(Western blotting)实验检测细胞中PCNA、MMP-2和MMP-9的表达 以0.25%胰蛋白酶消化并收集转染48 h后各组U2-OS细胞,以适量RIPA裂解液在冰上裂解细胞,抽提总蛋白,BCA法测定蛋白浓度,制备SDS-PAGE,行电泳分离蛋白,使用半干法将蛋白电转至PVDF 膜上,在5%脱脂奶粉中封闭2 h,将膜放置在含一抗的溶液中进行杂交,其中PCNA、MMP-2和MMP-9一抗均为1∶500稀释,4 ℃冰箱摇床孵育过夜,洗膜后将膜放置1∶3 000稀释的二抗溶液中,室温孵育2 h,通过ECL发光显影,采集图像,分析各条带灰度值,分别计算细胞中PCNA、MMP-2和MMP-9的表达水平。
1.11 统计学方法 采用SPSS 21.0 统计软件分析实验数据,以上实验至少重复3 次,计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 NCRNA00173 和miR-765 在骨肉瘤细胞中的表达 与成骨细胞hFOB1.19 相比,骨肉瘤细胞株U2-OS、Saos-2、SJSA-1 和SOSP-9607 中NCRNA 00173 的表达明显下调(P<0.05),而miR-765 的表达明显上调(P<0.05),见表1。由于NCRNA00173在U2-OS 细胞中下调最明显,因此后续实验以U2-OS细胞为实验细胞株。
表1 NCRNA00173和miR-765在各细胞株中的表达水平比较

表1 NCRNA00173和miR-765在各细胞株中的表达水平比较
与hFOB1.19细胞比较,*P<0.05。
2.2 检测NCRNA00173 过表达转染效果 与Con组和pcDNA 组比较,NCRNA00173 组U2-OS 细胞中NCRNA00173 的表达水平显著升高(P<0.05);与Con组相比,pcDNA组中NCRNA00173的表达水平无明显改变(P>0.05),见表2。
表2 各组U2-OS 细胞中NCRNA00173 和miR-765 表达水平比较

表2 各组U2-OS 细胞中NCRNA00173 和miR-765 表达水平比较
与Con组比较,*P<0.05;与pcDNA组比较,&P<0.05。
2.3 NCRNA00173 和miR-765 靶向关系验证 生物信息学软件Starbase 预测结果发现,NCRNA 00173和miR-765间具有特异性互补结合位点;双荧光素酶报告基因实验结果发现,与miR-NC组相比,miR-765 组NCRNA00173-Wt 细胞的相对荧光素酶活性显著降低(P<0.05),而NCRNA00173-Mut 细胞的相对荧光素酶活性无显著变化(P>0.05),见图1和表3。
表3 双荧光素酶报告基因实验检测细胞的相对荧光素酶活性
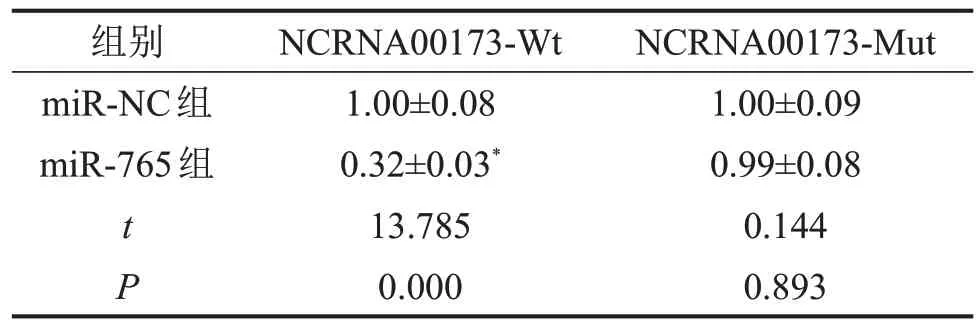
表3 双荧光素酶报告基因实验检测细胞的相对荧光素酶活性
与miR-NC组比较,*P<0.05。
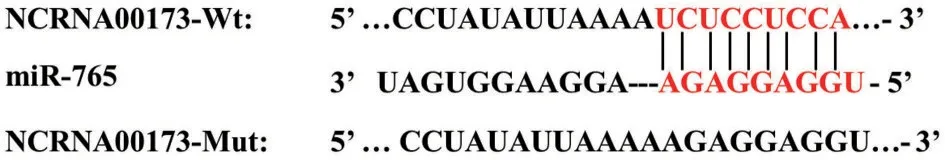
图1 生物信息学预测NCRNA00173 和miR-765 的结合位点示意图
2.4 过表达NCRNA00173 对U2-OS 细胞增殖的影响 与Con 组和pcDNA 组相比,NCRNA00173 组U2-OS 细胞OD 值从48 h 开始显著降低(P<0.05),克隆形成细胞数明显减少(P<0.05);与Con 组相比,pcDNA组克隆形成细胞数及细胞OD值在24 h、48 h 和72 h 时均无明显改变(P>0.05),见表4 和图2。
表4 各组U2-OS细胞增殖能力(OD值)和克隆形成能力比较

表4 各组U2-OS细胞增殖能力(OD值)和克隆形成能力比较
与Con组比较,*P<0.05;与pcDNA组比较,&P<0.05。
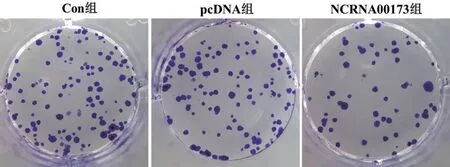
图2 克隆形成实验检测24 h各组U2-OS细胞克隆形成能力
2.5 过表达NCRNA00173 对U2-OS 细胞迁移和侵袭的影响 与Con 组和pcDNA 组相比,NCRNA 00173组U2-OS细胞迁移和侵袭数均显著减少(P<0.05),划痕愈合率明显降低(P<0.05);与Con 组相比,pcDNA组划痕愈合率迁移和侵袭细胞数均无明显改变(P>0.05),见图3和表5。

图3 各组细胞迁移和侵袭能力
表5 各组U2-OS细胞迁移和侵袭细胞数比较
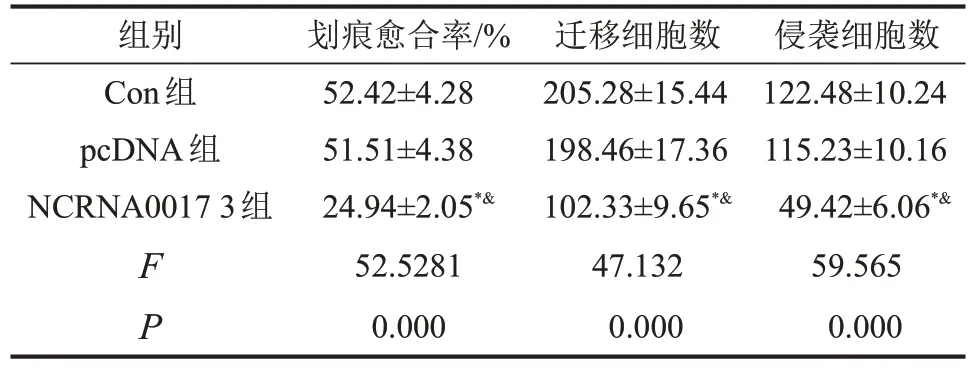
表5 各组U2-OS细胞迁移和侵袭细胞数比较
与Con组比较,*P<0.05;与pcDNA组比较,&P<0.05。
2.5 过表达NCRNA00173对U2-OS细胞中PCNA、MMP-2和MMP-9表达的影响 与Con组和pcDNA组相 比,NCRNA00173 组U2-OS 细胞中PCNA、MMP-2 和MMP-9 的表达水平均显著降低(P<0.05);与Con 组相比,pcDNA 组PCNA、MMP-2 和MMP-9的表达均无明显改变(P>0.05),见图4和表6。
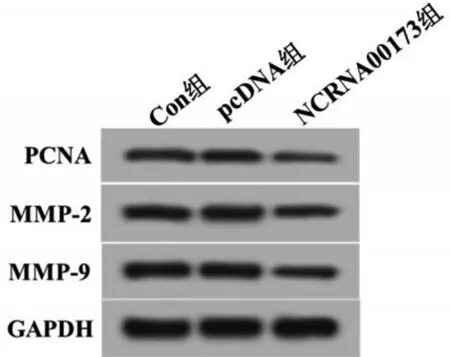
图4 各组U2-OS细胞中PCNA、MMP-2和MMP-9的表达
表6 各组U2-OS 细胞中PCNA、MMP-2 和MMP-9 的表达水平比较

表6 各组U2-OS 细胞中PCNA、MMP-2 和MMP-9 的表达水平比较
与Con组比较,*P<0.05;与pcDNA组比较,&P<0.05。
3 讨论
越来越多的研究表明,lncRNA 在调节癌症生长和迁移中起着关键作用,这增加了我们对几种疾病,尤其是恶性肿瘤的生物学行为的了解[10-11]。先前的证据表明lncRNA是包括骨肉瘤在内的多种肿瘤治疗靶标和有价值的生物标志物。例如,lncRNA CBR3-AS1 在调节骨肉瘤细胞的增殖、迁移、侵袭和凋亡中起着致癌作用,并且是骨肉瘤患者的一个独立的不良预后因素[12]。lncRNA HIF2PUT 的过表达通过下调HIF-2α 抑制骨肉瘤干细胞的球形形成,并且显著抑制了骨肉瘤干细胞的增殖、迁移和侵袭能力,这些发现表明,lncRNA HIF2PUT可能是治疗骨肉瘤的新靶点[13]。lncRNA HIF1A-AS2 在骨肉瘤中表达上调,且其过表达可通过调节miR-129-5p促进骨肉瘤细胞的增殖、细胞周期进程和侵袭,这些结果表明,HIF1A-AS2 可能是骨肉瘤的潜在治疗靶标[14]。NCRNA00173 作为一种新的lncRNA,在肝癌中表达下调,提示包括NCRNA00173在内的lncRNA 可能提供新颖的分子生物标志物,并为对抗肝癌病例的转移提供新的基础[8]。近期研究显示,NCRNA00173 在骨肉瘤组织中表达下调,且与患者的肿瘤分期、远处转移等密切相关[9]。但是,骨肉瘤和NCRNA00173之间的关系尚未见相关报道。本实验首次对NCRNA00173 在骨肉瘤中的功能进行了探究。本研究中首先检测了NCRNA 00173在骨肉瘤细胞中的表达情况,结果显示,与成骨细胞hFOB1.19 相比,骨肉瘤细胞中NCRNA 00173的表达下调(P<0.05),提示NCRNA00173在骨肉瘤中可能发挥调控作用。
先前的研究表明,lncRNA 通过充当miRNA 的“海绵”而在调节生物细胞过程中发挥关键作用[15-16]。为探究NCRNA00173在骨肉瘤细胞中的功能,本研究初步证实NCRNA00173可靶向结合miR-765。已发现miR-765 在人类某些癌症中具有不同的作用。miR-765对舌鳞状细胞癌的细胞增殖和侵袭具有抑制作用[17]。相反,miR-765 通过抑制人肝癌中的INPP4B促进细胞增殖[18]。近期Lv等[19]研究显示,miR-765 的表达在骨肉瘤组织中显著增加,miR-765 的上调促进了骨肉瘤中的细胞增殖、迁移和侵袭。Linc00511 过表达通过下调miR-765 促进了骨肉瘤MG-63 细胞的增殖、集落形成和迁移[20]。本研究中观察到miR-765在骨肉瘤细胞中表达上调(P<0.05),提示NCRNA00173 可能通过负向调控miR-765的表达而参与骨肉瘤发生及发展过程。
随后本实验进一步研究了其在骨肉瘤细胞系中的功能。功能实验显示,外源性高表达NCRNA 00173 抑制了骨肉瘤细胞的增殖、迁移和侵袭(P<0.05)。此外,本研究结果显示,过表达NCRNA 00173 能够有效抑制增殖相关蛋白PCNA 的表达(P<0.05)。PCNA 参与DNA 代谢的各种过程,包括DNA复制和修复,染色质组织和转录以及姐妹染色单体凝聚。另外,PCNA参与细胞存活,是细胞处于增殖状态的标志分子。MMP-2和MMP-9参与正常生理过程以及疾病过程(例如癌症转移)中细胞外基质的分解。本研究结果发现,过表达NCRNA 00173抑制MMP-2和MMP-9的表达(P<0.05)。以上这些结果提示,过表达NCRNA00173可能通过抑制PCNA、MMP-2 和MMP-9 的表达阻碍骨肉瘤细胞的增殖、侵袭和迁移。在临床环境中,抑制NCRNA00173 表达可能是治愈骨肉瘤的一种治疗策略。但需要更多的研究来解释NCRNA 00173 在骨肉瘤发展中的分子机制。
综上,下调表达的NCRNA00173在骨肉瘤中起抑癌基因的作用,并通过调节miR-765 的表达抑制骨肉瘤的发生,这表明NCRNA00173可能是骨肉瘤的潜在治疗靶点。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- miR-508-3p靶向AFF4/TGFβ1信号通路调控人牙髓细胞分化的机制研究*
- 腹壁剖宫产瘢痕子宫内膜异位症恶变为透明细胞癌1例*
- 急性心肌梗死与2型糖尿病相关差异基因的GEO芯片分析*
- Effect of curcumin on palmitic acid-induced apoptosis and steroid production of ovarian granulosa cells by inhibiting HMGB1-mediated autophagy
- 白藜芦醇对人甲状腺乳头状癌细胞IHH4细胞恶性生物学特征及PI3K/Akt信号通路影响*
- 金丝桃苷对糖尿病肾病大鼠TGF-β1/smad通路及肾上皮间质转化的影响*
