癌痛消方对肝癌大鼠癌痛的调控作用机制研究*
2021-12-20杜宝昌肖芳芳武振明齐秀恒
刘 军,杜宝昌,郭 茜,肖芳芳,武振明,齐秀恒
(河北中石油中心医院肿瘤科,廊坊 065000)
临床中晚期癌症患者最常见的症状之一为癌痛,超过半数的癌症患者存在无法忍受和控制的剧烈疼痛,虽然吗啡等阿片类药物能够有效缓解癌痛,但是长期使用阿片类药物可能会出现胃肠道反应和伴随成瘾性等副作用,因此如何缓解疼痛成为了临床研究的一个难题[1-2]。癌痛为与神经病理性疼痛机制和炎症痛相关的慢性疼痛,因此对其展开研究以适当的动物模型入手是十分合适的。癌痛消方是以传统的“膈下逐瘀汤”为基础,加用半枝莲、元胡、白花蛇舌草、绞股蓝、黄芪、莪术、三棱等药物制备而来,可化瘀解散、清热解毒、行气止痛、健脾益气,且经济实惠,便于携带和使用[3-4]。抑制NF-kB蛋白的表达能够缓解神经损伤所致的疼痛和炎症反应,这在既往研究中已有报道,有学者指出NF-kB 蛋白能够减少癌痛大鼠的痛觉过敏,抑制脊髓小胶质细胞激活[5]。而在已经发现的TLRs 中,TLR2和TLR4所识别的配体最多,不仅能够与相关配体结合,还能够与负责特异区别配体的内源性巨噬细胞蛋白结合,增加配体结合靶位,介导和活化相关因子,介导疼痛通路。SIGIRR 蛋白激活可对TLR4-NF-kB 转导信负调控,进而调节该信号通路终端NF-kB水平,缓解镇痛。因此,本研究选取NFkB、SIGIRR、TLR2、TLR4 作为检测指标,就癌痛消方对大鼠癌痛的调控作用机制进行了研究,以期为今后临床干预提供参考。
1 材料与方法
1.1 实验动物
采用肝脏左叶表面注射walker256 细胞成功构造原发性肝癌SD 大鼠模型。SD 大鼠雌雄各半,均为4~5 周龄,体质量为13~17 g,平均(15.72±1.21)g。所有大鼠均购自中国医学科学院医学实验动物研究所,许可证号:SYXK(京)2020-1134。所有大鼠均标准饲养,设置温度(21±2)℃,湿度为40%~60%,每12 h光暗交替,每5 min换气通风1次。
1.2 药品、主要试剂及仪器
超净工作台(上海净化设备厂产品),TGL-16M台式高速冷冻离心机(济南博鑫生物技术有限公司),负80度超低温冰箱(北京天地精仪科技有限公司),半自动石錯切片机(leikacm3050s 德国),包埋机(LS-100+沈阳市龙首电子仪器有限公司),高速冷冻离心机(GL21M 上虞市博盛生物科技有限公司),普通光学显微镜(SZ51奥林巴斯日本),日立全自动生化分析仪(LABOSPECT008日本)。
NF-kB 蛋白、SIGIRR 蛋白、TLR2、TLR4mRNA试剂盒由武汉博士得生物公司购入;鼠兔通用一抗试剂盒、二抗试剂盒、二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色试剂盒、无水乙醇、甘氨酸、冰乙酸、甲醇、10 μl/200 μl/1 000 μl 进口吸头AXYGEN、离心管(盒)、PCR管盒、乳胶手套、PE手套,一次性滴管、烧杯均由南宁市博仁实验用品经营部购入。
1.3 动物分组及造模
参照文献[6]的方法进行造模,造模前大鼠禁食禁水12 h,依据2.3 mg/kg 的剂量给予2%戊巴比妥钠腹腔注射麻醉,成功麻醉后取仰卧位,使用橡皮筋将四肢和上肢固定在实验手术板上。采用沐浴露混合液润湿皮毛,将部分体毛使用剃须刀刮取,暴露腹部,对手术区域进行常规消毒,将腹部正中线0.5右侧旁逐层剪开2 cm,暴露腹腔,将肝左外叶托出,注射walker256 细胞悬液,注射后观察若无活动性出血则轻送肝脏还纳腹腔,确认无异物残留后,使用无菌可吸收线逐层缝合关腹。
采用肝脏左叶表面注射walker256 细胞成功构造60只原发性肝癌SD大鼠模型,分为3组,癌痛消方低剂量组(0.5 g/mL),癌痛消方中剂量组(1g/mL)和癌痛消方高剂量组(2 g/mL),每组20只。并选取20只健康SD大鼠作为对照组(Control组)。Control组每日1次使用2 mL蒸馏水灌胃,剂量组大鼠每日1次给予2 mL浓度为0.5 g/mL、1 g/mL、2 g/mL的癌痛消方灌胃。
1.4 癌痛消方
癌痛消方:30 g 白花蛇舌草,30 g 赤芍药,20 g黄芪,15 g半枝莲,12 g绞股蓝,10 g延胡索,10 g三棱,10 g香附,10 g莪术,10 g乌药,10 g甘草,6 g红花。由广西中医药大学附属百年乐药厂制备,每包15 g。
1.5 Western blotting实验检测NF-kB、SIGIRR蛋白的表达水平
采用断头法处死大鼠,取脊髓L4~L6 段称重,并加入80 g/L的裂解液,使用液氮研磨,加入PMSF蛋白酶抑制剂,冰上裂解。使用匀浆机匀浆20 s,静置30 min,以12 000 r/min 的速率离心20 min(半径15 cm,温度4 ℃),取上清液,加入EP管内,-20 ℃保存待测。采用Western blotting 印迹法对NF-kB、SIGIRR蛋白表达进行检测。
1.6 RT-PCT 实验检测TLR2、TLR4 mRNA 的表达量
采用断头法处死大鼠,取0.1 g脊髓L4~L6段,加入1 mL 的Trizol Reagent,采用电动匀浆机高速低温匀浆20 s,静置后,于1 mL的Trizol试剂内加入0.2 mL的氯仿,剧烈振荡摇匀后,室温下静置2 min,以12 000 r/min的速率离心15 min(半径15 cm,温度4 ℃),取400 μL 移至EP 管内,加入等体积异丙醇,摇匀冰浴15 min,以12 000 r/min的速率离心10 min(半径15 cm,温度4 ℃),弃上清液,倒置在消毒滤纸上,将异丙醇吸干,使用75%乙醇洗涤沉淀,以 7 500 r/min的速率离心5 min(半径15 cm,温度4 ℃),弃上清液,风干5 min 后溶于DEPC 水备用。使用RT-PCT 半定量检测TLR2 和TLR4 mRNA 表达情况。
1.7 流式细胞仪检测细胞周期和凋亡情况
取1 000 mg 新鲜癌灶组织,置于平皿内,加少量PBS,剪为匀浆,加少量PBS,使用吸管吸取匀浆,以尼龙网(100 目)过滤,以1 500 r/min 的速率离心3 min(半径10 cm),PBS洗3次,以500 r/min的速率离心3 min(半径10 cm),去除细胞碎片,以尼龙网(300目)过滤细胞团块,分置两管内,调整细胞浓度为1×106/mL,置于4 ℃冰箱内保存待测。采用Annexin V/PI 双染色法染色细胞,用上流式细胞仪检测,CellQuest软件分析,计算细胞周期和凋亡率。
1.8 统计学方法
采用SPSS 18.0 统计软件进行数据分析,计量资料以均数±标准差()表示,两组均数比较采用t检验,多重比较采用dunnett’st检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠不同时刻的NF-kB、SIGIRR 蛋白表达水平比较
Western blotting 实验结果显示,不同时刻(5 d、10 d、15 d)不同浓度(0.5 g/mL、1.0 g/mL、2.0 g/mL)组NF-kB 蛋白的表达水平均低于Control 组(P<0.05),且癌痛消方的浓度越大,NF-kB 蛋白的表达水平越低,见图1A;不同时刻(5 d、10 d、15 d)不同浓度(0.5 g/mL、1.0 g/mL、2.0 g/mL)组SIGIRR蛋白的表达水平均高于Control 组(P<0.05),且癌痛消方的浓度越大,SIGIRR 蛋白的表达水平越高,见图1B。
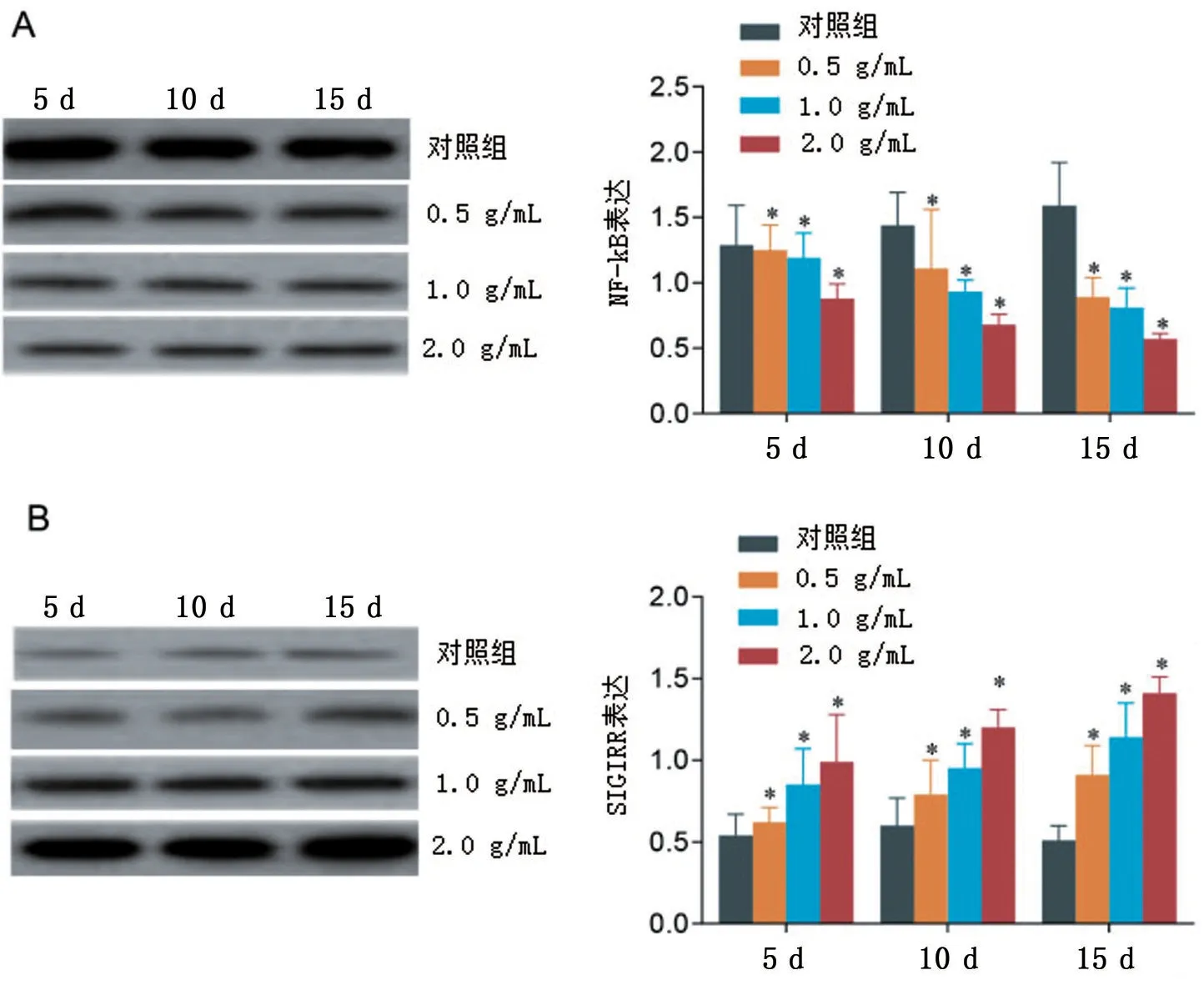
图1 各组大鼠不同时刻的NF-kB和SIGIRR蛋白表达水平比较
2.2 各组大鼠不同时刻的TLR2、TLR4 mRNA表达水平比较
RT-PCT 实验结果显示,不同时刻(5 d、10 d、15 d)不同浓度(0.5 g/mL、1.0 g/mL、2.0 g/mL)组TLR2、TLR4mRNA 的表达水平均低于Control 组(P<0.05),且癌痛消方的浓度越大,TLR2、TLR4 mRNA的表达水平越低,见图2。

图2 各组大鼠不同时刻的TLR2和TLR4 mRNA表达水平比较
2.3 各组大鼠不同时刻的细胞周期比较
流式细胞仪检测结果显示,不同时刻(5 d、10 d、15 d)不同浓度(0.5 g/mL、1.0 g/mL、2.0 g/mL)组G0/G1 期细胞比例均高于Control 组(P<0.05),且癌痛消方的浓度越大,G0/G1期细胞比例越高,见图3A;但S期、G2期细胞比例均低于Control组(P<0.05),癌痛消方的浓度越大,S期、G2期细胞比例越低,见图3B-C。
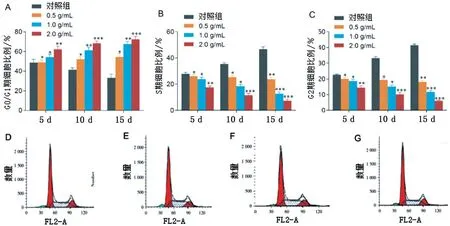
图3 各组大鼠不同时刻的细胞周期比较
2.4 各组大鼠不同时刻的细胞凋亡率比较
流式细胞仪检测结果显示,不同时刻(5 d、10 d、15 d)不同浓度(0.5 g/mL、1.0 g/mL、2.0 g/mL)组细胞凋亡率均高于对照组(P<0.05),且癌痛消方的浓度越大,细胞凋亡率越高,见图4。

表4 各组大鼠不同时刻的细胞凋亡率比较
3 讨论
癌症患者病情进展中最常见的症状之一为癌性疼痛,简称癌痛,癌痛为癌症患者普遍存在的症状,部分患者为间断性疼痛,多数患者为持续性疼痛,且持续时间长达每日12 h以上,约2/3的癌痛患者为内脏痛,近一半的患者为混合型疼痛,新发癌症患者癌痛发生率约25%,晚期和复诊患者则可高达80%[7]。虽然临床中对于癌痛的护理和治疗在逐步完善,但仍有50%~80%的癌痛患者无法得到晚期缓解,对患者的心理状况常有严重影响,影响治疗依从性和临床疗效[8]。
目前临床上癌痛的药物治疗以“非甾体类”和”阿片类”药物及神经阻滞镇痛治疗等方法为主[9-10]。且在既往对癌症患者的研究中可发现,随着癌细胞活化,各类致炎细胞因子释放量增加,有学者指出致炎细胞因子在癌痛的发展中也有重要作用[11]。本研究中发现癌痛消方可通过抑制SIGIRR 进而对TLR-NF-kB 途径产生抑制作用,降低了NF-kB、TLR2和TLR4的表达,进而激活转录因子NF-kB的转录,以达到抑制趋化因子、致炎因子、细胞因子等多种炎症介质释放的效果,而炎症因子会影响和放大脊髓对伤害性刺激的感受,造成痛觉过敏,诱发患者出现癌痛症状,因此NF-kB、TLR2 和TLR4 表达的降低,说明癌痛消方可通过改善炎症反应,缓解癌痛。提示癌痛消方能够抑制急性期蛋白的产生,抑制B 细胞和T 细胞的分化,影响适应性免疫,减少巨噬细胞急性期蛋白的产生,抑制局部炎症反应,激活内皮细胞,减少各类因子与神经元上相应受体的结合,抑制神经元的激活,进而缓解外周神经的痛觉敏化[12]。同时,本研究结果显示,癌痛消方可使癌细胞停留于细胞周期的G0/G1期,阻止其进入S 期,抑制和阻断脱氧核糖核酸(deoxyribonucleic acid,DNA)的合成,达到促进凋亡的目的,缓解癌痛的发生。
分析本文结果产生的原因,主要是由于使用率癌痛消方,方中白花蛇舌草归胃、大肠、肝、小肠经,可消散痈肿、清热解毒、利湿通淋,主治内痈腹痛、疮疡肿毒等[13];党参性甘平,可补中益气、养血生津,是临床常用的治疗脾肺气虚之证的药物[14];半枝莲味辛苦,性寒,可清热解毒、活血化瘀、利水消肿,可治热毒疮痈、大腹水肿等[15];莪术味辛散苦泄,性温通,可破血行气、消积止痛,三棱味苦辛,性平,破血之力强,二者常用于治疗血瘀气滞或癥瘕积聚所致腹痛、腹胀[16-17];绞股蓝味苦甘性寒,可健脾益气、理气除湿、活血生津、清热解毒,主治脾虚痰浊阻络热毒之证[18];赤芍味苦性寒,可清热解毒、祛瘀止痛、清泻肝火,主治癥瘕积聚、血热之斑疹[19];延胡索味辛散苦泄,性温通,可活血行气止痛,能治血瘀气滞诸痛[20];乌药味辛性温通,可疏离胸腹之气,主治寒凝气滞、阳虚腹痛之证[21];黄芪味甘性温,可升举阳气、补益脾肺之气[22];香附味辛甘微苦,性平,可疏肝理气、调和气血、调经止痛,主治肝郁气滞诸痛[23];枳实味辛苦,性微寒,可补中益气、行滞降泄,可治食积气滞,脘腹痞满证;甘草味甘性平,可补脾润肺、解毒缓急[24]。因此,癌痛消方全方配伍精当,组方严谨,可健脾益气、抗癌解毒、化瘀散结,可通过抑制可能与TLR-NF-kB 通道,促进肝癌细胞的凋亡,抑制炎症反应,发挥较佳的癌痛控制效果[25]。
综上所述,癌痛消方能够促使肝癌细胞凋亡,降低炎症介质释放,控制癌痛,且以中、高剂量作用明显,随着用药时间的延长,疗效也有一定增强,其机理可能与TLR-NF-kB通道的抑制有关。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- miR-508-3p靶向AFF4/TGFβ1信号通路调控人牙髓细胞分化的机制研究*
- 腹壁剖宫产瘢痕子宫内膜异位症恶变为透明细胞癌1例*
- 急性心肌梗死与2型糖尿病相关差异基因的GEO芯片分析*
- Effect of curcumin on palmitic acid-induced apoptosis and steroid production of ovarian granulosa cells by inhibiting HMGB1-mediated autophagy
- 白藜芦醇对人甲状腺乳头状癌细胞IHH4细胞恶性生物学特征及PI3K/Akt信号通路影响*
- 金丝桃苷对糖尿病肾病大鼠TGF-β1/smad通路及肾上皮间质转化的影响*
