Aroclor1254对雄性大鼠的生殖毒性效应
2021-12-17陈潞萍邢晖冮岩赵建文邹鹏贾晓宇
陈潞萍 邢晖 冮岩 赵建文 邹鹏 贾晓宇
多氯联苯是一类被广泛应用于生活及工业生产的雌激素环类环境污染物,能通过皮肤、呼吸道等多种途径进入人或动物体内[1],对免疫系统[2]、内分泌系统[3]、神经系统[4]、生殖系统[5]等造成危害。本研究选择对动物具有生殖毒性的典型多氯联苯类化合物Aroclor1254为研究对象,探讨不同剂量Aroclor1254对大鼠的生殖毒性效应,为Aroclor1254的生殖毒理研究提供依据,现报告如下。
1 实验动物和材料
1.1 实验动物 40只健康SPF级成年雄性SD大鼠(体质量250~300 g,日龄90 d)购自沈阳医学院实验动物中心〔动物许可证号SCXK(辽)2020-0001,实验单位使用许可证号SYXK(辽)2019-0005〕。购回后适应性饲养7 d,大鼠自由摄食和饮水,昼夜交替周期为12 h/12 h,控制环境温度为20~25 ℃。本研究符合动物福利与伦理学标准,并经本校实验动物伦理委员会审批(审批号:SYYXY2021022101)。
1.2 试剂 Aroclor1254购自美国Supleco公司,包埋剂OCT购自日本SAKURA公司,苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒购自上海碧云天生物技术公司。
2 实验方法
2.1 动物分组及给药 将大鼠随机分为溶剂对照组、Aroclor1254低、中、高剂量(1、3、5 mg/kg)组,每组8只。将Aroclor1254溶于1 mL玉米油,采用腹腔注射给药方式,Aroclor1254处理组大鼠连续给药30 d,溶剂对照组给予等体积玉米油。
2.2 检测指标及方法
2.2.1 体质量、睾丸和附睾质量 给药30 d后麻醉处死所有大鼠,记录大鼠体质量,提取睾丸和附睾组织,使用分析天平分别称质量。
2.2.2 睾丸及附睾器官系数 根据测定的大鼠体质量、睾丸和附睾质量计算睾丸及附睾器官系数,器官系数=(器官湿质量/体质量)×100%。
2.2.3 精子计数 剥离大鼠双侧附睾4 mm×4 mm组织,置于2 mL磷酸盐缓冲液(phosphate buffered saline,PBS)内摇床孵育30 min,70 μL滤膜过滤,加入1 mL PBS冲洗,混匀备用。取上述精液10 μL滴至细胞计数板,再滴10 μL伊红溶液,加盖玻片于显微镜下观察计数,每份样品计数3次,取平均值。
2.2.4 睾丸组织病理学观察 剥离睾丸组织并迅速放入提前准备好的液氮中冷冻3 min,用冰盒迅速转移至-80 ℃冰箱保存备用。打开冰冻切片机,预先制冷-20 ℃,取出冷冻的睾丸组织行OCT包埋,固定于样品装载区,设置切片机切片厚度为10 μm,切片,并将组织吸附于专用的组织切片载玻片上。行HE染色,并在显微镜下观察。
2.3 统计学分析 所有实验均重复3~4次,使用不同批次的SD大鼠。采用SPSS 16.0统计学软件处理数据,符合正态分布的计量资料以均数±标准差(±s)表示,进行单因素方差分析、t检验或Dunett's检验。P<0.05为差异有统计学意义。
3 结果
3.1 Aroclor1254对大鼠体质量、睾丸和附睾质量的影响 与溶剂对照组比较,给药后Aroclor1254低剂量组大鼠体质量、睾丸和附睾质量均无显著变化(均P>0.05)。Aroclor1254中、高剂量组大鼠体质量、睾丸和附睾质量均较溶剂对照组明显降低(均P<0.05)。见表1。
表1 Aroclor1254各剂量组和溶剂对照组大鼠给药后体质量、睾丸和附睾质量比较(±s)
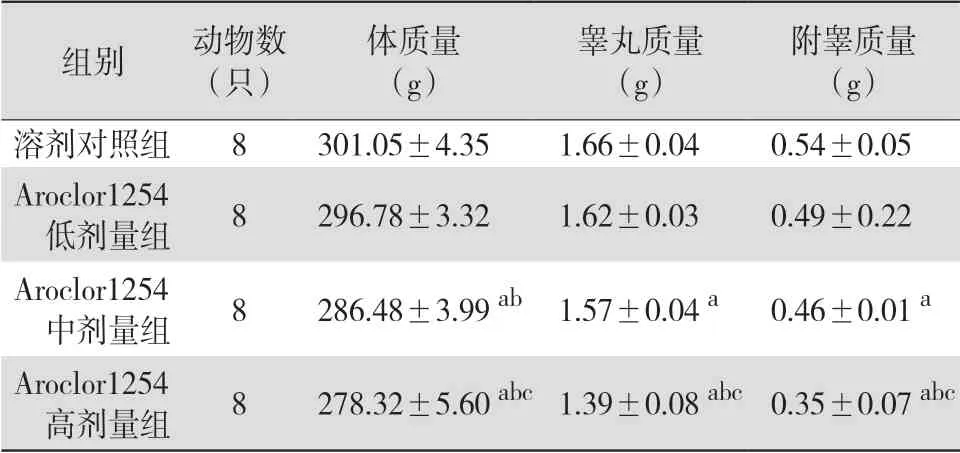
表1 Aroclor1254各剂量组和溶剂对照组大鼠给药后体质量、睾丸和附睾质量比较(±s)
注:溶剂对照组给予玉米油,Aroclor1254低、中、高剂量分别为1、3、5 mg/kg;与溶剂对照组比较,aP<0.05;与Aroclor1254低剂量组比较,bP<0.05;与Aroclor1254中剂量组比较,cP<0.05
组别 动物数(只)体质量(g)睾丸质量(g)附睾质量(g)溶剂对照组 8 301.05±4.35 1.66±0.04 0.54±0.05 Aroclor1254低剂量组 8 296.78±3.32 1.62±0.03 0.49±0.22 Aroclor1254中剂量组 8 286.48±3.99 ab 1.57±0.04 a 0.46±0.01 a Aroclor1254高剂量组 8 278.32±5.60 abc1.39±0.08 abc0.35±0.07 abc
3.2 Aroclor1254对大鼠睾丸和附睾器官系数的影响 与溶剂对照组比较,给药后Aroclor1254低剂量组睾丸和附睾器官系数均无显著变化(均P>0.05),Aroclor1254高剂量组睾丸和附睾器官系数均明显低于另外3组(均P<0.05),说明Aroclor1254对大鼠生殖系统造成损伤。见表2。
表2 Aroclor1254各剂量组和溶剂对照组大鼠给药后睾丸和附睾器官系数以及精子计数比较(±s)

表2 Aroclor1254各剂量组和溶剂对照组大鼠给药后睾丸和附睾器官系数以及精子计数比较(±s)
注:溶剂对照组给予玉米油,Aroclor1254低、中、高剂量分别为1、3、5 mg/kg;与溶剂对照组比较,aP<0.05;与Aroclor1254低剂量组比较,bP<0.05;与Aroclor1254中剂量组比较,cP<0.05
组别 动物数(只)睾丸器官系数(%)附睾器官系数(%)精子计数(×106个)溶剂对照组 8 5.51±0.10 1.80±0.22 19.50±2.92 Aroclor1254低剂量组 8 5.40±0.13 1.60±0.10 18.12±1.35 Aroclor1254中剂量组 8 5.50±0.18 1.60±0.19 a 14.62±0.74 ab Aroclor1254高剂量组 8 5.00±0.25 abc 1.20±0.24 abc11.50±1.06 abc
3.3 Aroclor1254对大鼠精子计数的影响 与溶剂对照组比较,给药后Aroclor1254低剂量组大鼠精子计数无显著变化(P>0.05);Aroclor1254中、高剂量组较溶剂对照组和Aroclor1254低剂量组精子计数均明显降低,且Aroclor1254高剂量组较中剂量组明显降低(均P<0.05),可见大鼠接受Aroclor1254染毒剂量越大,精子计数越低。见表2。
3.4 Aroclor1254对大鼠睾丸组织病理学的影响Aroclor1254处理后,大鼠睾丸组织出现不同程度损伤。溶剂对照组大鼠睾丸生精小管结构完整,管腔充满各级生精细胞,且生精细胞发育正常。见图1A。Aroclor1254低剂量组较溶剂对照组无明显改变。见图1B。Aroclor1254中、高剂量组大鼠睾丸生精小管结构破坏,形态不完整,各级生精细胞排列紊乱。见图1C、1D。且上述症状随着Aroclor1254剂量增大而加重,表明Aroclor1254能破坏大鼠睾丸组织。
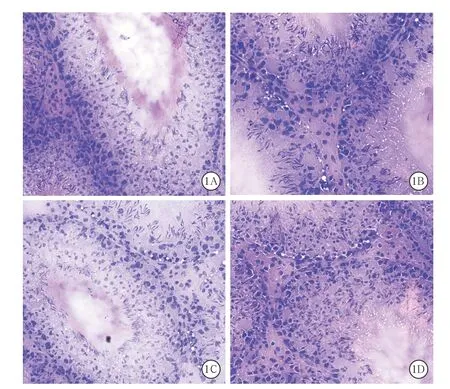
图1 Aroclor1254各剂量组和溶剂对照组大鼠给药后睾丸组织病理学变化(苏木素-伊红染色 低倍放大)
4 讨论
迄今为止,有文献报道我国育龄期男性不孕不育者占30%~40%[6],已引起医疗界高度重视。现已知多种环境毒物可对生殖系统造成损伤[7],但是有关多氯联苯混合物Aroclor1254对雄性动物生殖系统影响的研究还鲜有报道。本研究选用成年雄性SD大鼠作为实验动物,根据预实验选用最佳给药剂量对大鼠进行染毒处理。体质量是衡量机体是否处于健康状态的指标之一,可以灵敏地反映机体各系统功能是否正常[8],从而证实动物是否染毒成功。本研究采用不同剂量(分别为1、3、5 mg/kg)Aroclor1254对大鼠进行染毒处理。在染毒结束后分析大鼠体质量、睾丸和附睾质量以及睾丸和附睾器官系数,结果显示Aroclor1254各剂量组上述指标均有所下降,尤以高剂量组下降明显,表明染毒成功,这一结果与其他报道一致[9]。由此初步验证了Aroclor1254可能对大鼠生殖系统造成损伤的猜想。
本研究计数并分析了染毒后大鼠的精子数量,发现Aroclor1254各剂量组大鼠精子计数均减少,且呈现剂量-效应关系,高剂量组减少最明显。精子发生这一生理过程的主要场所是睾丸生精小管。生精小管是哺乳动物睾丸的基本功能单位[10],也是生殖毒物作用的主要靶点[11],因此本研究对大鼠睾丸组织进行HE染色,观察其病理组织学变化。结果显示当Aroclor1254给药剂量达到3 mg/kg后,随着给药剂量的增加,该药物对睾丸生精小管的破坏程度加重,生精小管内各级生精细胞排列紊乱且溶解,该病理学结果对我们的猜想进行了又一补充。
综上所述,本研究证实了Aroclor1254对大鼠具有生殖毒性,且Aroclor1254在3 mg/kg的剂量暴露下就能对大鼠产生生殖毒性效应。后续可借鉴生物信息学方法对其致病机制进行研究[12]。
利益冲突所有作者均声明不存在利益冲突
