绵羊附睾液和附睾精子中抗氧化酶活性的研究
2022-04-15许娇霞赵勇超王兆琛白雪张楠岱红艳张家新
许娇霞,赵勇超,王兆琛,白雪,张楠,岱红艳,张家新
(内蒙古农业大学动物科学学院,内蒙古自治区动物遗传育种与繁殖重点实验室,内蒙古呼和浩特 010018)
精子在睾丸生成后,经附睾头运输到附睾尾,在附睾转运过程中精子发生形态、胞质和细胞核的变化,结构不断完善,最终获得运动能力和受精能力,成熟的精子储存在附睾尾。在这个过程当中,附睾上皮细胞和精子的代谢都会产生一定的副产物——活性氧(ROS),生理范围的ROS 对于精子正常功能的发挥是必需的。在正常情况下,体内过量的ROS 会被一系列精子内或精子外的抗氧化剂分子清除,若附睾内的抗氧化防御系统和内源性ROS 生成之间失衡,会引起氧化应激、使得精子结构受到损害、精子活力降低。因此,附睾精子和附睾液的抗氧化酶活性的正常维持对于精子的成熟以及储存尤为重要。调节细胞抗氧化功能的酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px) 和过氧化物酶(POD)。有报道表明,在不同动物的附睾液或精子中检测到了不同的酶活性(山羊、马、猪、大鼠、人、狗),然而这些酶在绵羊附睾的活性变化模式鲜有报道。鉴于此,本研究系统地研究了不同抗氧化酶在绵羊附睾不同部位附睾液和精子的抗氧化酶活性变化模式,为进一步研究绵羊附睾抗氧化功能的调节提供理论依据。
1 材料与方法
1.1 样品采集 在2020 年11 月—2020 年12 月,采集10~12 月龄、体重相近、健康的6 只小尾寒羊的睾丸,实验绵羊在相同条件下饲养于土左旗翔泰养殖合作社,在屠宰场屠杀,每只羊的样品分别设置3个重复组。根据Rana 等采集附睾液和附睾精子的方法,将白膜完整的睾丸和附睾置于PBS 中冷藏保存,2 h 内带回实验室。根据Cyr、Rana 等对附睾的划分标准(图1),于超净台中将附睾头、附睾体、附睾尾分离,分别浸入含有3 mL PBS 洁净无菌的培养皿中。每个部位用细剪刀剪3~4个切口,使附睾腔内液体从切口渗出,室温下孵育10 min,用镊子轻轻挤压,收集附睾各部位渗出含有精子的管腔液,室温下1 000 ×g 离心5 min。上清液则为附睾液,将精子沉淀用PBS 洗涤3 次,最后利用雷氏曼染色法对精子涂片进行染色,确保精子无血细胞污染。
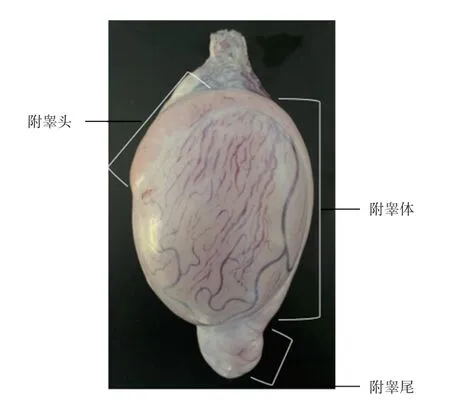
图1 附睾结构
1.2 抗氧化酶活性检测
1.2.1 精子蛋白的提取 根据碧云天公司Western 及IP 细胞裂解液的说明书进行试验,取100 万左右精子,加入200 µL IP 裂解液,充分裂解后,12 000 ×g 离心5 min,取上清,即可用于后续抗氧化酶活性的检测。
1.2.2 蛋白浓度的检测 根据博士德公司BCA 蛋白浓度测定试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的蛋白浓度进行检测,在96 孔板中加入20 µL 的标准品和待测样品,再加入BCA 工作液200 µL,37℃孵育20 min 后,用酶标仪(美国Bio-Tek 仪器有限公司产Synergy HT)测定A562。绘制标准曲线,计算出待测样的蛋白浓度。
1.2.3 总抗氧化力的检测 根据碧云天公司总抗氧化能力检测试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的T-AOC 进行检测,利用ABTS 法,抗氧化物可将ABTS·+还原为ABTS。在96 孔板中相继加入过氧化物酶工作液、待测样、ABTS 工作液,并设置空白对照组,室温孵育6 min,使用酶标仪测定A414,绘制标准曲线,通过公式比蛋白浓度计算T-AOC。
1.2.4 SOD 活性的检测 根据碧云天公司SOD 活性检测试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的SOD 活性进行检测,在96 孔板中依次加入待测样品、SOD 检测缓冲液、WST-8/酶工作液、反应启动工作液,37℃孵育30 min,利用WST-8 法,对WST-8 产物比色,通过公式比蛋白浓度计算出SOD 活性。
1.2.5 CAT 活性的检测 根据碧云天公司过氧化氢酶活性检测试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的CAT 活性进行检测,过氧化物酶可催化过氧化氢生成红色产物,设置空白对照,96 孔板依次加入样品、过氧化氢酶检测缓冲液、过氧化氢溶液,混匀后25℃反应5 min,然后加入过氧化氢酶反应终止液混匀以终止反应。取1个新的离心管加入40 µL 过氧化氢酶检测缓冲液,再加入10 µL 上述反应体系,混匀。取10 µL 加入到96 孔板中,再加200 µL 显色工作液。25℃孵育15 min,使用酶标仪测定A520,绘制标准曲线,通过公式比蛋白浓度计算出CAT 活性。
1.2.6 GSH-Px 活性的检测 根据碧云天公司总谷胱甘肽过氧化物酶检测试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的GSH-Px 活性进行检测,利用NADPH 法,检测NADPH 的减少量,在96 孔板中依次加入谷胱甘肽过氧化物酶检测缓冲液、待测样品和GSH-Px 检测工作液,混匀,加入40 µL GSH-Px 检测工作液,室温下孵育15 min,再加10 µL 过氧化物试剂溶液混匀,立即使用酶标仪测定A340,每隔2 min测定1 次,连续测定10 min,通过公式比蛋白浓度计算出GSH-Px 的活性水平。
1.2.7 POD 活性的检测 根据索莱宝公司过氧化物酶(POD)活性检测试剂盒的说明书分别对绵羊附睾不同部位附睾液和精子的POD 活性进行检测,POD 在有过氧化氢存在的情况下能使愈创木酚发生氧化生成茶褐色物质。在离心管中按顺序加入试剂一、试剂二、试剂三、蒸馏水、样品,混匀后取200 µL 加入到96 孔板中,使用酶标仪测定30 s 和90 s 时的A470,通过公式比蛋白浓度计算出POD 的酶活性。
1.3 统计分析 酶活性采用SAS 25.0 软件中的ANAVO进行单因素方差分析和显著性检验,<0.05 为差异显著,<0.01 为差异极显著。
2 结果与分析
2.1 绵羊附睾液抗氧化能力的结果 如表1 所示,从附睾头到附睾尾,附睾液中T-AOC 显著上升,其中附睾尾的液体中T-AOC 显著高于附睾头和附睾体,附睾头和附睾体差异不显著;附睾尾和附睾体的液体中SOD活性显著高于附睾头,而附睾尾和附睾体差异不显著;CAT 活性在附睾不同部位的附睾液中差异不显著;附睾尾液体中GSH-Px 活性显著高于附睾头和附睾体,而附睾头液体中GSH-Px 活性显著高于附睾体;附睾尾液体中POD 活性显著高于附睾头和附睾体,附睾头与附睾体差异不显著。
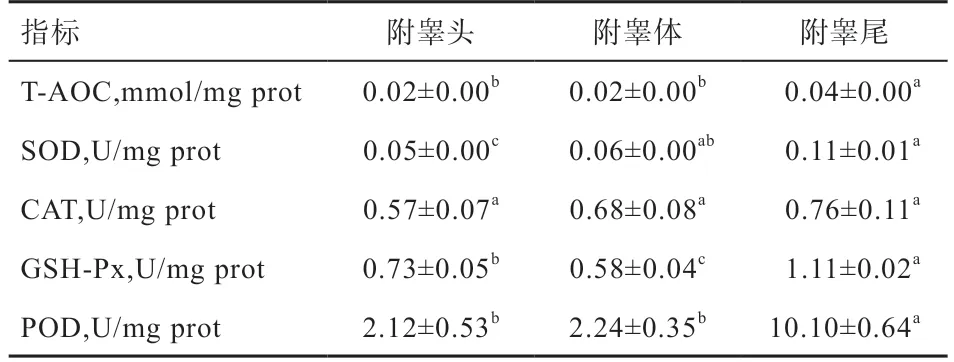
表1 不同部位附睾液抗氧化指标
2.2 绵羊附睾精子抗氧化能力的结果 如表2 所示,从附睾头到附睾尾,附睾精子中的T-AOC 显著上升,其中附睾尾精子中的T-AOC 显著高于附睾头和附睾体,附睾体精子中的T-AOC 显著高于附睾头;SOD 在附睾尾和附睾体精子中的活性显著低于附睾头,附睾尾和附睾体差异不显著;附睾尾精子中GSH-Px 活性显著高于附睾头和附睾体,附睾头和附睾体差异不显著;附睾尾精子中POD 活性显著高于附睾头和附睾体,附睾体显著高于附睾头;而在附睾精子中并未检测到CAT 活性。

表2 不同部位附睾精子抗氧化指标
3 讨 论
哺乳动物精子在睾丸形成后,需要在附睾进一步完成成熟过程。但是从附睾头运输到附睾尾的过程中,精子质膜的多不饱和脂肪酸水平增加,使得精子更容易受到氧化损伤。精子在附睾的运输过程中,代谢率、形态和运动模式都会发生变化,因此其氧化还原状态也会相应改变。尽管已有研究表明,在不同动物附睾中都能检测到抗氧化酶活性,但是相关酶活性的变化趋势有着不同的结果,附睾液和精子中的酶活性不仅随空间的变化而变化,而且这种空间变化也可能存在物种特异性,鉴于此本实验对绵羊附睾不同部位附睾液和精子中抗氧化酶活性的变化进行了研究。
T-AOC 是酶类和非酶类抗氧化剂成分的总和,本研究中,从附睾头到附睾尾不论是精子还是附睾液中T-AOC 均呈上升趋势,附睾尾部精子和附睾液的T-AOC均显著高于其他的附睾部位,这与Rana 等在山羊附睾头到附睾尾中附睾液T-AOC 的变化趋势相一致。这可能是由于尾部精子PUFA 浓度较高,会产生大量ROS,故需要自身以及附睾环境更高的抗氧化能力来平衡过量的ROS。
SOD 是清除过氧阴离子O-重要的抗氧化酶,本实验结果显示附睾液中总SOD 的活性均呈升高趋势,而在山羊的附睾液、以及野猪的附睾精子中也报告了类似结果。在附睾精子中SOD 活性的变化趋势与之相反,这与山羊附睾中精子SOD 的活力变化趋势一致。CAT 可将HO转化为水和氧气,有报道表明,在猪、狗、小鼠、兔的附睾精子中均未检测到CAT 的存在,而在马、人、狗、猪和牛的精浆中CAT 含量很高。研究发现精浆中的CAT 主要来源于前列腺液,而结合本研究的结果发现绵羊附睾精子上并不存在CAT 活性,而附睾液中存在CAT 活性,这说明附睾液也可能是精浆中CAT 的来源之一。由此可见,随着附睾不同区域活性氧类型的变化,CAT在许多哺乳动物精子中的抗氧化功能并不是必需的,这些酶活性在附睾中不同的变化可能归因于精子对特定抗氧化酶的不同需求。
GSH-Px 在哺乳动物不同器官广泛分布,并参与附睾成熟精子的保护。本研究结果显示,附睾液和附睾精子从头到尾均呈升高趋势,这与山羊附睾液中GSH-Px 活性的变化趋势一致。而在马的附睾液中GSH-Px 活性从附睾头部到尾部逐渐降低,与本研究结果相反,这可能是由于物种差异性所致。附睾液中的GSH-Px 的表达取决于附睾上皮细胞的分泌情况,而其活性又会根据不同的抗氧化需求表现出一定差异。
POD 在附睾上皮主细胞、基底细胞和窄细胞中高度表达,但在附睾头和附睾尾上皮的透明细胞中不表达。POD 是精子中重要的抗氧化剂,可以调节过氧化物(HO和有机过氧化物)和过氧化物亚硝酸盐(ONOO)等ROS 水平,以避免细胞毒性。本实验结果显示,不论是附睾液还是精子,从附睾头至附睾尾POD 活性均呈升高趋势,故此精子储存在附睾尾时需要自身以及附睾液中更高活性的POD 保护精子免受氧化应激的损害。
总的来说,不论是在绵羊的附睾液还是附睾精子中,T-AOC 从附睾头到附睾尾均呈升高趋势,其中GSH-Px 和POD 的活性在尾部最高,精子中SOD 活性逐渐降低,而且在精子中未检测到CAT 活性。这可能是由于附睾不同部位的生理作用不同,故而精子对不同抗氧化酶有着不同的需求,但其具体的形成原因仍需进一步研究。
4 结 论
综上所述,绵羊附睾不同部位附睾液及其精子的抗氧化酶活性存在区域特异性,在附睾尾的抗氧化酶活性明显升高,这说明随着精子的成熟,储存在附睾尾的精子对抗氧化环境有更高的需求。
