中华绒螯蟹组织蛋白酶B基因的SNPs及其与鳗弧菌抗性/易感性的关系
2021-12-17段鹏飞鲁秀萍李凤梅
段鹏飞,鲁秀萍,李凤梅
(青岛科技大学海洋科学与生物工程学院,山东青岛266042)
木瓜蛋白酶家族根据其活性位点的氨基酸残基可分为3类:半胱氨酸蛋白酶(包括组织蛋白酶B、C、F、H、K、L、O、S、T、U、V、W 和X)、天冬氨酸蛋白酶(组织蛋白酶D 和E)和丝氨酸蛋白酶(组织蛋白酶A 和G)[1]。组织蛋白酶广泛分布于细菌、植物和动物中,具有广泛的生物学功能,如细胞内蛋白质降解[2],抗原加工[3]和炎症反应[4],这些都是动物新陈代谢所必需的。在半胱氨酸组织蛋白酶中,组织蛋白酶B主要参与机体抵抗外来病原体的入侵。例如,在新加坡石斑鱼虹膜病毒(SGIV)刺激后,石斑鱼(Epinepheluscoioides)脾脏组织蛋白酶B的m RNA 表达在感染后24 h上调[5]。在鳗弧菌感染后8 h,蛏子(Sinonovaculacontricta)组织蛋白酶B表达量在在肝脏和套膜组织中达到最高水平[6]。石鲷生鱼(Oplegnathusfasciatus)的组织蛋白酶B m RNA 也在所有检测组织中表达,并在脂多糖(LPS)和细菌刺激下呈上调表达[7]。此外,所有检测组织中均检测到克氏原鳌虾(Procambarusclarkii)组织蛋白酶B的m RNA 表达,LPS刺激后肝胰腺组织蛋白酶B的表达显著升高[8]。这些结果表明组织蛋白酶B 可能参与了机体对外来病原体感染的免疫应答。
中华绒螯蟹是我国重要的水产养殖品种[9]。近年来,由于细菌、真菌和病毒等原因造成中华绒螯蟹的大量死亡,给蟹养殖业造成了巨大的经济损失[10-11]。弧菌是中华绒螯蟹大量死亡的主要原因[12]。因此,选择高抗性的中华绒螯蟹是一种有效的育种方案。
传统的选择性育种是根据表型来对个体的育种价值进行估计,耗时长,而且总受环境的影响。因此,需要新的有效的育种方法[13]。标记辅助育种是一种基于基因型使用DNA 标记进行选择育种的分子方法,使选择更加高效和经济[14]。由于单核苷酸多态性(SNPs)是生物体中最丰富的多态性,因此在各种DNA 标记中,SNPs成为分子遗传分析的首选DNA 标记[15]。
近年来,有报道称不同的基因和多态性与抗病性有关,其中包括牡蛎体内的CVSI-1基因[16]、草鱼(Ctenopharyngodonidella)C7基因[17]、日本比目鱼鸡型-溶菌酶基因[18]、草鱼CD40 和CD154 基因[19]、金鲳鱼MHCⅡ类α 基因[20]和尼罗罗非鱼MHCⅡ基因[21]。这些研究表明,遗传变异显著影响抗病性,这可能有助于建立基于PCR的抗病性基因分型检测方法,为今后的育种提供依据。目前对中华绒螯蟹基因多态性和疾病易感性的认识还很有限。因此,本研究的目的是鉴定中华绒螯蟹组织蛋白酶B基因中的SNPs,并评估其与鳗弧菌抗性/易感性的关系。
1 实验部分
1.1 主要材料
2019年10 月,在青岛南海海鲜市场购买200只中华绒螯蟹(以下简称螃蟹)(每只(100±10)g)。实验开始前,将螃蟹在(20±3)℃的淡水中驯化1周。每两天更换一次淡水。在整个实验过程中,用玉米喂食螃蟹。
鳗弧菌(Vibrioanguillarum)由中国科学院海洋学研究所实验海洋生物学重点实验室提供,在2216 E的液体培养基中培养25 ℃12 h。随后,细菌在磷酸缓冲液(PBS)(0.1 mol·L-1)悬浮,稀释至1×108CFU·m L-1。
在菌刺激实验中,将螃蟹分为4个处理组和1个对照组,分别放入5 个容器中,每个容器中存放40只螃蟹。对照组在螃蟹的最后一只步足关节膜处注射100μL PBS。另外4 个容器的蟹注射以PBS稀释的鳗弧菌悬浮液(5×108CFU·m L-1)。菌刺激后每隔12 h对容器中螃蟹的死亡数量进行记录,直到菌刺激的第6 d。菌刺激后5 d内死亡的螃蟹类被划分为鳗弧菌敏感组,而在2周内没有明显变化的螃蟹类被认定为鳗弧菌抗性组。鳗弧菌刺激后症状难以识别的螃蟹样本被丢弃,不做统计。每只蟹的肌肉被取出并立即保存在-80 ℃,直到用于DNA 提取。
1.2 基因组DNA提取
每组蟹组织的基因组DNA 按照标准苯酚-氯仿方案提取[22]。
1.3 引物、PCR 扩增和测序
根据中华绒螯蟹组织蛋白酶B m RNA 序列、完整CDS(编码序列)(GenBank accession no.KC020121登录号)设计基因特异性引物(表1)。25 μL PCR 扩增体系:14.8μL的水,10×PCR 缓冲液2.5μL,(MgCl2(25 mmol·L-1)2.5μL,2μL的d NTP(10μmol·L-1),正反引物各1μL(10μmol·L-1),0.2μL(1U)Pfu Taq DNA 聚合酶(Tiangen,北京,中国),和1μL的模板DNA。通过My GeneTMSeries Peltier Thermal Cycler Model MG48+(LongGene,杭州,中国)进行PCR 反应的条件如下:在94 ℃预变性5 min,94 ℃变性30 s,58~65℃复性30 s,和72 ℃延伸1 min,共35个循环,72℃10 min。

表1 扩增基因序列的引物Table 1 Primers used in the genomic sequence amplification
以螃蟹基因组DNA 为模板进行PCR 得到的产物在2%琼脂糖凝胶上电泳分离,用PCR 凝胶纯化试剂盒(北京天根)纯化。随后,使用ABI 3730自动测序仪(Applied Biosciences,Foster City,CA)对纯化的PCR 产物进行双向测序。用DNAMAN 软件对扩增片段进行拼接。
1.4 生物信息学分析
从NCBI(https://www.ncbi.nlm.nih.gov/)中获得EsCatB的cDNA 序列,利用DNAMAN 软件推导其氨基酸序列。使用在线网站(http://smart.embl-heidelberg.de/)预测信号肽、前体肽和成熟肽区。通过在线软件Ex PASY(https://www.expasy.org/)预测EsCatB的糖基化位点、相对分子质量和等电点,利用MEGA7软件通过邻近法构建系统发育进化树。
1.5 EsCatB 中SNP的鉴定与分析
利用Clustal X 对不同个体的EsCatB基因成熟肽区的核苷酸序列进行比对,检测基因的多态性。通过测序色谱图确定每个SNP 位点的基因型。计算抗性组和易感组的基因型和等位基因频率。采用SPSS 23.0软件进行统计分析。用卡方检验计算等位基因频率和基因型频率在抗性组和易感群组中的差异。P<0.05和0.001分别代表有统计学意义和差异极显著。
2 结果与讨论
2.1 EsCat B 基因序列分析
EsCatB的cDNA 全 长(GenBank accession number:KC020121)为1 514 bp,包括一个13 bp的5′非翻译区(5′UTR),一个508 bp的3′非翻译区(3′UTR),一个终止密码子(TAA),996 bp的编码区。编码区含有331个氨基酸残基,预测分子量为36.5 k Da,等电点为6.51。图1为EsCatB基因的cDNA 序列和推导的氨基酸序列。推导出的Es-CatB蛋白编码为包含18个残基的信号肽(MRSLWVIALVVVVVVVEG)、41个氨基酸的前体肽(氨基酸23~63)和79~332个残基的成熟肽(254个残基)的前肽。在推导的氨基酸序列中有到一个N-糖基化位点。

图1 EsCatB的核苷酸序列和推导的氨基酸序列Fig.1 Nucleotide sequence and deduced amino acid sequence of EsCat B
2.2 EsCatB的同源比对与系统发育分析
与其他20个生物的组织蛋白酶B 蛋白序列进行多重序列比对表明,成熟肽区比信号肽区和前体肽区更保守。EsCatB 与越南对虾组织蛋白酶B 蛋白(Gen Bank 录号:ROT74524)的一致性最高(81.61%),其次为单尾对虾组织蛋白酶B 蛋白(GenBank录号:AGV55414)的一致性为77.68%,与中国对虾组织蛋白酶B 蛋白(GenBank 录号:AHA83423)的一致性为77.06%。
此外,系统发育分析显示,20个生物体的组织蛋白酶B蛋白聚类为两个分支:脊椎动物分支和无脊椎动物分支(图2)。在系统发育树中,EsCatB与中国对虾组织蛋白酶B蛋白聚类。这些数据表明,组织蛋白酶B 在生物进化过程中是一个相对保守的基因。
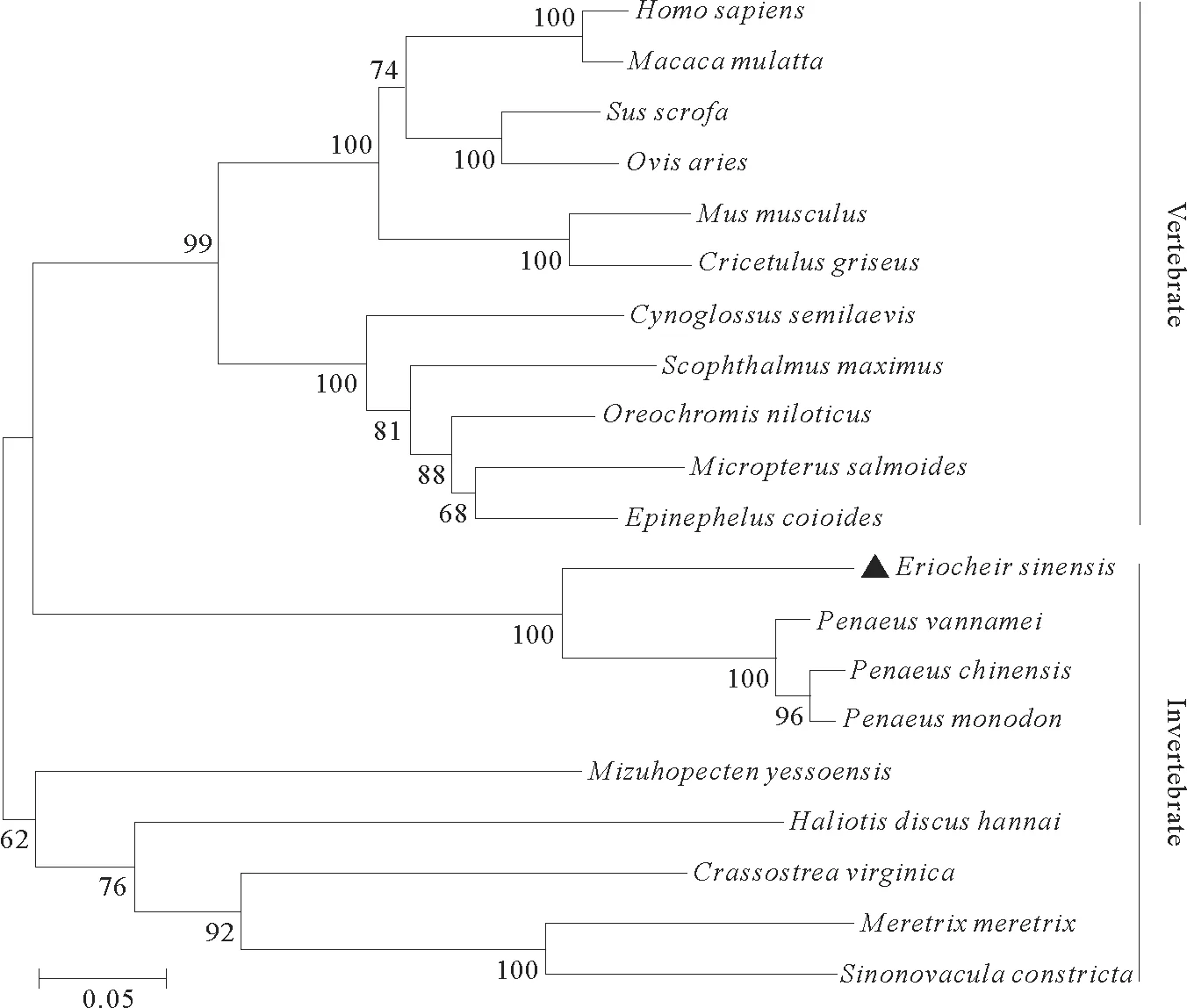
图2 EsCat B 和其他物种组织蛋白酶B蛋白序列的系统发育分析Fig.2 Phylogenetic analysis of EsCat B and known cathepsin B protein sequences
2.3 中华绒螯蟹EsCat B的SNPs鉴定及其抗鳗弧菌的关系
利用两对引物对30个易感个体和30个抗性个体的EsCatB进行扩增和测序。通过比较60条序列,在747 bp的扩增片段内发现19个SNP,包括16个转换,3个颠换,无插入或缺失位点。为了降低SNP检测的错误率,使用小等位基因频率MAF(Minor Allele Frequency)>0.05进行结果的过滤。每个SNP的位置被命名为相对于起始密码子(ATG)。所有SNP位点都是同义突变。抗性组和敏感组EsCatB中19个SNP位点的基因型和等位基因频率如表2所示。根据卡方检验,仅852 C/T位点在基因型(P=0.003)和等位基因(P=0)的水平与中华绒螯蟹对V.Anguillarum的抗性显著相关。易感组TT、TC 和CC 基因型频率分别为3.3%、0%和96.7%,抗性组TT、TC和CC基因型频率分别为33.3%、6.7%和60%。此外,T 等位基因在易感组的频率为3.3%,在抗性组的频率为0.367%。易感组C 等位基因频率为96.7%,抗性组C等位基因频率为63.3%。结果还显示,525AG 位点的基因型频率在两组间有显著差异(P<0.05)。但两组间仅其他两个位点(441G-C,570GA)的等位基因频率有显著差异(P<0.05)。

表2 抗性组和敏感组EsCatB 中19个SNP位点的基因型和等位基因的频率Table 2 Frequency of EsCat B allele and genotype in resistant and susceptible groups were shown

续表2
通过对位点连锁不平衡分析,发现有两个高连锁不平衡的区块:1)SNP4 和SNP6;2)SNP14 和SNP15(见图3)。
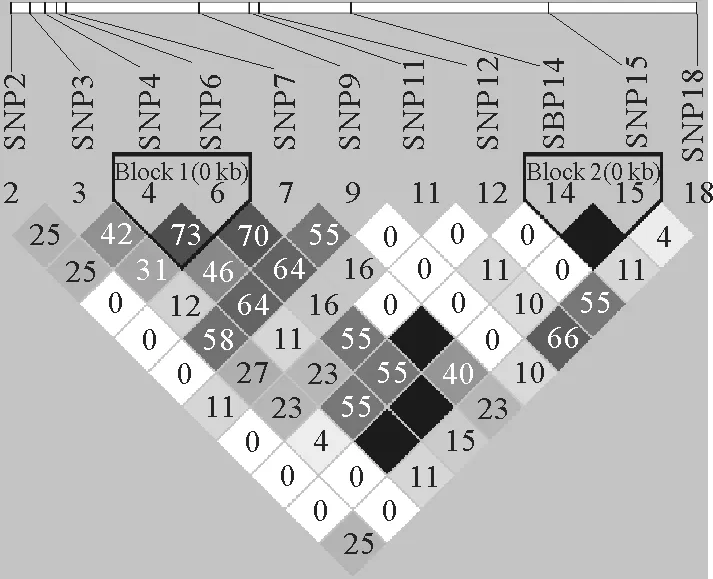
图3 EsCatB 基因型序列的LD图Fig.3 LD plot of EsCat B genotyped sequence
选择这两个区块进行单倍型分析。第1区块发现3个单倍型(TC、GG、TG),第2区块发现4个单倍型(CT、TC、TT、CC)。对易感组和抗性组的单倍型分布进行相关分析显示单倍型与抗病性相关(表3)。

表3 鳗弧菌敏感组与鳗抗性组的单倍型关联分析Table 3 Haplotype associations between V.anguillarum susceptible group V.anguillarum resistant group
3 讨论
鳗弧菌可引起鱼类、双壳类和甲壳类动物的出血性败血症,导致水生生物死亡率高,对水产养殖特别是水生生物幼虫造成巨大损失[23]。鱼类和贝类对外来病原体的抗性主要依靠物理和化学屏障作为先天防御机制,然后通过补体系统进行病原体特异性免疫应答。水生生物幼虫的适应性免疫系统发育不完全,对外来病原体的抗性主要依赖于非特异性的防御反应[23]。这导致水生幼体比成体更容易受到环境病原体的影响,有较高的死亡率[24]。
鳗弧菌与其宿主之间相互作用的机制尚不完全清楚。最小抑制浓度的溴化呋喃酮——由致病基因表达所调控的群体感应系统(quorum sensing system)形成的群体感应抑制剂,可显著抑制QS相关基因(van I/R 和luxs)的表达,抑制鞭毛的生长和生物膜的形成,降低V.anguillarum的运动能力[25]。中药三黄散与恩诺沙星联合应用可提高凡纳滨对虾副溶血性弧菌感染后的免疫力和抗病性[26],与细胞疫苗相比,生物膜口服疫苗在加利福尼亚州鲈鱼的效果更好[27]。肌肉注射编码外膜蛋白K 抗原的DNA 疫苗,可提高牙鲆鱼对鳗弧菌抗性[28]。在这些研究中使用的技术有很多缺点,劳动需求量大且耗费时间较长,最重要的是它们有可能诱发水生生物产生肉芽肿和炎症。此外,抗生素的过度使用导致了耐药微生物菌株的出现、环境污染、药物残留积累等一系列问题[26]。因此,通过分子选择性育种,选择鳗弧菌的抗性基因型,是提高水生动物对鳗弧菌抗性的最有效途径。
在以往的研究中,发现一些特定基因的SNPs与生物体对外来病原体的抗性和易感性有关。例如,抑菌素的一个SNP位点g.-12C>G 与克氏原鳌虾(Procambarusclarkii)体重显著相关[29]。在草鱼toll样受体(TLR 8 gene)中,4168 C/T与草鱼呼肠孤病毒(GCRV)的易感性/抗性显著相关(P<0.01)[30]。南美白对虾(Litopenaeusvannamei)toll样受体(TLRs)的SNP C1526T 与抗病原感染相关[31]。同样,SNP 6515C/T(外显子上的非同义突变)与团头鲂(Megalobramaamblycephala)对嗜水单胞菌(AeromonasHydrophila)感染的抗性也有显著相关性;CC基因型个体比CT基因型个体更抗感染[32]。
在本研究中,对中华绒螯蟹组织蛋白酶B 基因的序列进行了SNPs筛选。在762 bp的片段中发现了19个SNP,且都是同义突变。特定基因中的SNP位点可能对寄主的生物学功能产生不同的影响,例如:某些SNP 位点可能会影响基因的表达、m RNA 构象的稳定性、与某些蛋白质结合的亲和性以及RNA/蛋白质的亚细胞定位,从而使细胞产生某些信号缺陷,导致生物体对某些病原菌表现为易感性状[33]。在编码序列中出现的同义SNP可能会产生罕见的密码子,需要一个罕见的t RNA 来翻译,从而减慢翻译速度,最终导致蛋白质折叠成不同的结构[34]。在以前的研究中,在草鱼的CD40中发现了一个同义突变位点7625 T-C,这可能增强了草鱼对呼肠孤病毒(GCRV)的抗性[19]。同样,草鱼toll样受体同义突变位点1726 A/G 和1726 G/G的选择可能导致草鱼对GCRV 抗性的差异[35]。MMP9基因催化域的两个SNP位点(rs8125581和rs41529445)使蛋白质的结构和功能发生了改变,剪切位点的13个SNP 影响了剪切信号,从而使翻译后表达发生改变[36]。IGF1基因编码区域的一个同义替换SNP c.258G>A 改变了IGF1的折叠和IGF1与IGF1R的相对结合亲和力[37]。同一蛋白的结构差异可能使其在生物学过程中发挥不同的功能,这可能是中华绒螯蟹鳗弧菌的抗性的遗传解释。这一假设需要在未来用其他生物技术进一步验证。
此外,EsCatB中SNP 852C/T 位点处的基因型频率(P=0.003)和等位基因频率(P=0)在易感组和抗性组之间存在显著差异。携带CC基因型和C等位基因的中华绒螯蟹对鳗弧菌具有较高的敏感性。相反,T 等位基因可被认为是SNP 852C/T 位点的抗性等位基因。因此,选择SNP 852C/T 等位基因T的中华绒螯蟹可以提高该物种的抗病性。水产养殖过程中,水生生物可能同时受到多种病原体的感染,而不同的病原体可能与特定的SNP位点相关。因此,SNPs与中华绒螯蟹中多种常见致病菌的相关性应进行评估,并对SNPs与这些病原菌的相关性进行筛选。
对复杂疾病中单个SNP的分析可能有一些重要的意义。对同一遗传染色体上多个SNP 组成的单倍型的研究,可能为定位疾病基因提供额外的信息,也有助于更深入地了解影响遗传标记之间依赖的因素[38]。近年来,许多研究报道了基因单倍型与生物抗性的关系。如大菱鲆(Scophthalmusmaximus)RhoB启动子区、Hap1 TG (P=0.005)和Hap2 AA(P=0.048)被认为与鳗弧菌抗性有显著相关性[39]。中华文蛤小眼畸形相关转录因子(Mp MITF)中5个SNP的连锁不平衡分析表明,单倍型(AGTAG)rahaemolyticus 为保护性单倍型(P=0.041),其在抗性组的单倍型数明显高于易感组[40]。但在我们的研究中,两个区块的单倍型在抗性组和易感组之间没有显著差异。
4 结语
研究了EsCatB基因序列的SNPs与鳗弧菌刺激中华绒螯蟹的易感性/抗性的关系。EsCatB的SNP(852C/T)与中华绒螯蟹对鳗弧菌的抗性显著相关(P<0.01)。选择SNP(852C/T)位点等位基因为T的中华绒螯蟹,可以提高该蟹的抗病性。EsCatB基因编码序列中的SNP 位点(852 C/T)可能是一种有效的分子标记,可以促进中华绒螯蟹对鳗弧菌抗性的选择性选育。
