miR-152通过影响dNK分泌GM-CSF抑制人脐静脉内皮细胞功能
2021-12-17陈宥艺栾丽霞
杨 洋,马 媛,陈宥艺,周 娟,栾丽霞,赵 静*
(1西安市人民医院,西安市第四医院生殖医学中心,西安 710004;2西安医学院第一附属医院妇产科;3空军军医大学唐都医院妇产科;*通讯作者,E-mail:1968834452@qq.com)
子痫前期(preeclampsia,PE)严重威胁母儿健康,其发病率在全世界高达2%-8%[1]。病因不明导致的无法早期识别、预防,成为了PE临床诊治中的掣肘。近年来,围绕着“子宫-胎盘功能障碍”的病因学研究逐步揭示了miRNA、免疫因素、血管形成因子、炎症等[2]与PE发病的相关性,而上述的致病因素彼此相关、互相影响,构成了综合的病因学体系。
孕早期已发生的、包括滋养细胞浸润障碍及继发的螺旋动脉重铸不足在内的母胎界面中异常改变[3],已经成为PE发生的可能诱因。而dNK在母胎界面中,通过分泌多种细胞因子,发挥调节免疫平衡、细胞毒作用、血管生成等诸多生理功能[4],其中GM-CSF能够影响滋养细胞功能及血管形成过程[5]。另外,我们前期研究[6]发现,在PE胎盘组织中病理性高表达的miR-152能够影响dNK分泌功能,并协同抑制滋养细胞浸润,与PE发病相关,但具体机制不明。因此,本研究通过构建dNK与过表达和抑制miR-152的人正常滋养细胞(HTR8)共培养体系,并在共培养过程中特异性封闭dNK表面相关受体(KIR2DL4),采用管样形成实验检测不同共培养上清液干预下HUVEC的功能变化,从而进一步探讨miR-152以何种方式通过其靶基因HLA-G的介导,影响dNK分泌GM-CSF,是否还能够协同参与对血管内皮细胞功能影响的过程。
1 材料和方法
1.1 临床样本
收集2020年9月至2020年10月在西安医学院第一附属医院妇科门诊行人工流产患者的早孕蜕膜组织5例;患者年龄<35岁,BMI≤25 kg/m2,均为1胎正常顺产、第2次妊娠因主观无生育要求而终止妊娠的患者;所有患者既往无遗传性、传染性疾病及代谢性疾病病史;无妊娠期疾病史;无孕早期药物、放射线及毒物接触史。本研究经医院伦理委员同意并批准(批准编号:XYLS2019095),所有患者均签署知情同意书。
1.2 主要试剂和材料
人脐静脉内皮细胞(HUVEC)、人滋养细胞株(HTR8)由空军军医大学唐都医院妇产科实验室惠赠;RPMI-1640培养基、胎牛血清(FBS)、青霉素-链霉素购于美国Gibco公司;F12K培养基、磷酸缓冲盐溶液(PBS)购于武汉普诺赛科技有限公司;miR-152前体及对照分子购于上海吉玛生物公司;TRIzol、lipofectamine2000、CD56、CD16单抗购于美国invitrogen公司;HLA-G、β-actin单抗、HRP标记的二抗购于武汉博士德生物工程有限公司;外周血淋巴细胞分离液试剂盒购于天津灏洋生物科技公司;GM-CSF ELISA试剂盒购于武汉伊莱瑞特生物科技公司;RT-qPCR试剂购于美国VAZYME公司;matrigel胶、Transwell inserts购于美国Costar公司;KIR2DL4单克隆抗体(anti-KIR2DL4)、IgG1同种型对照(IgG1为anti-KIR2DL4的对照物质,应用目的为排除anti-KIR2DL4本身是否对细胞功能产生影响及评判其特异性封闭效果)购于美国Abnova公司;重组人IL-15购于美国PeproTech公司。
1.3 方法
1.3.1 细胞培养及转染 将HTR8取出后解冻,接种于含10%FBS、1%青霉素-链霉素的RPMI-1640培养基中,37 ℃、5% CO2饱和湿度条件下培养。细胞的密度达到80%时,对细胞进行传代。取对数生长期的HTR-8细胞,用RPMI-1640培养基制成单细胞悬液,按每孔2×105个细胞量,均匀的接种于6孔板中,37 ℃、5%CO2饱和湿度条件培养过夜;将HTR8细胞分为:过表达组、抑制组和对照组。对照组采用未进行转染实验的HTR8作为对照;按照Lipofectamine 2000说明书,过表达组HTR8细胞转染miR-152类似物(mimics),抑制组HTR8细胞转染miR-152抑制物(inhibitor)。
转染后6 h于荧光显微镜下观察转染效率(羧基荧光素酶FAM标记对照);48 h后RT-qPCR及Western blot检测转染效率;并将转染miR-152的各组HTR8细胞与后续提取的dNK共培养。
1.3.2 dNK细胞分离、纯化 PBS冲洗蜕膜组织,眼科剪剪碎蜕膜组织至2 mm3左右,加入1 mg/ml胶原酶Ⅳ和0.01 mg/ml DNA酶Ⅰ充分混匀,37 ℃ 5%CO2饱和湿度条件下,消化1 h;按照试剂盒说明书进行淋巴细胞分离步骤。取分离后的细胞并计数;每流式小管1×106个细胞,加入200 μl PBS重悬,每流式小管添加CD16和CD56,5 μl/Test,4 ℃孵育30 min;离心后加入200 μl PBS重悬细胞,流式细胞仪检测分析。dNK的细胞表型为CD56+CD16-。
1.3.3 qRT-PCR检测miR-152及其靶基因HLA-G表达 转染后48 h TRIzol法提取各组HTR-8细胞总RNA,并检测质量。按照反转录试剂盒说明书将总RNA反转录合成cDNA,再以cDNA为模板进行RT-PCR扩增。引物序列:miR-152上游5′-TGCGCTCAGTGCATGACAGAA-3′、下游5′-CCAGTGCAGGGTCCGAGGTATT-3′;HLA-G上游5′-GGCCCACGCACAGACTGACAGAA-3′、下游5′-CCAGGTCGCAGCCAATCATCCAC-3′;U6上游5′-CGCTTCGGCAGCACATATAC-3′、下游5′-AAATATGGAACGCTTCACGA-3′;β-actin上游5′-AGCGAGCATCCCCCAAAGTT-3′、下游5′-GGGCACGAAGGCTCATCATT-3′;反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40个循环。以U6/β-actin为内参,进行PCR反应。每次检测设定3个复孔,每个样本重复3次。根据PCR扩增曲线,使用2-ΔΔCt法计算各组中目的基因miR-152、HLA-G mRNA水平的表达情况。
1.3.4 Western blot法检测miR-152靶基因HLA-G表达 转染后48 h提取各组HTR-8细胞总蛋白,BCA法测定蛋白浓度,以40 μg蛋白上样量进行电泳分离,转膜至聚偏二氟乙烯膜(polyvinylidene fluo-ride, PVDF)上,封闭1 h;加抗HLA-G(1 ∶1 000)、抗β-actin(1 ∶500)抗体,4 ℃孵育过夜,TBST洗膜后加二抗(1 ∶50 000),室温孵育2 h。洗膜后,将ECL试剂中增强液与稳定的过氧化物酶溶液按1 ∶1比例混匀,滴加工作液于PVDF膜上,进行化学发光反应,X线胶片压片后显影、定影,冲洗胶片;随后扫描胶片,用BandScan分析胶片灰度值。
1.3.5 共培养细胞体系的建立 按照1.3.1中方法在6孔板中完成HTR-8转染,随后向6孔板中每孔加入1×106个dNK共培养,实验共分6组:空白共培养组(NC共培养组)、miR-152过表达共培养组、miR-152过表达对照组、miR-152抑制共培养组、通路封闭共培养组、通路封闭对照组。因PE病理性胎盘组织中miR-152为病理性高表达,故上述分组中仅设置了miR-152 mimics NC。
共培养过程中每组均加入20 ng/ml的IL-15(IL-15仅刺激dNK细胞活性,不影响细胞功能)。每组处理方式:空白共培养组(未转染的HTR8+dNK)、miR-152过表达共培养组(转染miR-152 mimics的HTR8+dNK)、miR-152过表达对照组(转染miR-152 mimics对照物的HTR8+dNK)、miR-152抑制共培养组(转染miR-152 inhibitor的HTR8+dNK)、通路封闭共培养组(转染miR-152 mimics的HTR8+dNK+KIR2DL4封闭剂)、通路封闭对照组(转染miR-152 mimics的HTR8+dNK+KIR2DL4封闭剂对照物IgG1)。37 ℃、5%CO2培养箱中培养24 h后收集上清,留待检测及后续实验。
1.3.6 ELISA检测各共培养组上清中GM-CSF表达 将收集到的共培养24 h后6孔板中上清液离心;分别设空白孔、标准孔、待测样品孔;按照ELISA试剂盒说明书步骤操作,加样后,酶标仪测量在450 nm波长处各孔的光密度(OD值),检测值代表各组上清中GM-CSF的表达水平。
1.3.7 管样形成实验检测各共培养组上清对HUVEC功能影响 取对数生长期的HUVEC细胞,用F12K培养基制成单细胞悬液,按每孔2×105个细胞量,接种到6孔板中,37 ℃、5%CO2饱和湿度条件培养过夜;用1.2.5中共培养24 h后的6组共培养上层培养液替换HUVEC培养基,37 ℃、5%CO2培养箱中培养24 h;0.25%胰酶消化HUVEC,用无血清培养基制成单细胞悬液,按照每孔1×105个细胞,均匀接种到预铺有基质胶的24孔板中,37 ℃、5%CO2过夜培养;培养8-12 h后拍照观察,测量、记录各组HUVEC总分支长度及管腔数,并进行统计学分析。
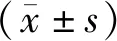
2 结果
2.1 dNK细胞纯度
流式细胞分选结果显示,分离纯化的dNK细胞纯度较高,约97.08%(见图1)。
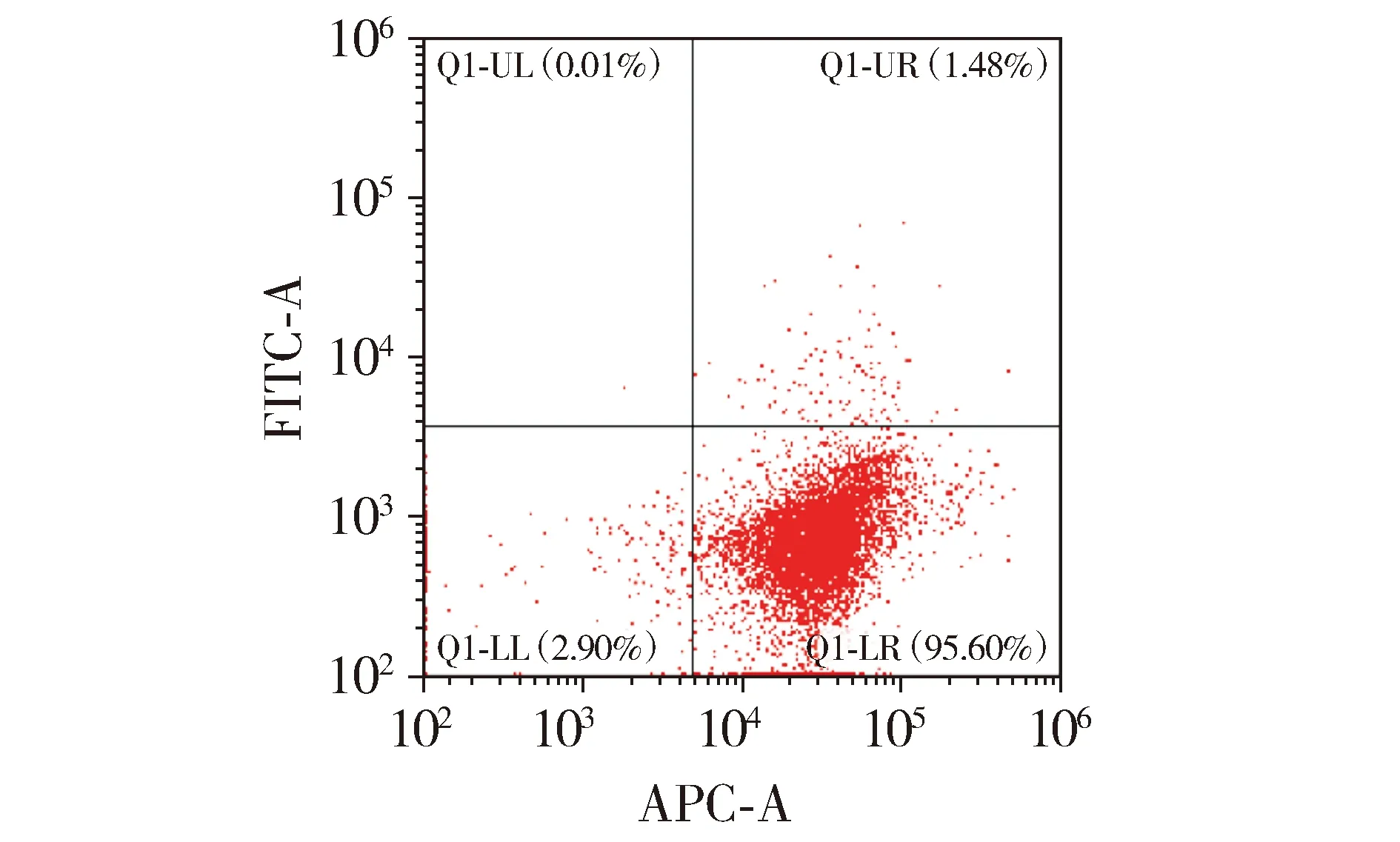
图1 流式细胞分选dNK纯度Figure 1 Purity of dNK cells after flow cytometry sorting
2.2 miR-152的转染效率
qRT-PCR结果显示:与对照组相比,过表达组细胞中miR-152表达水平显著升高(P<0.01),抑制组细胞中miR-152表达降低(P<0.01,见图2),提示miR-152在HTR8细胞中转染效果较好。
与对照组相比,*P<0.01图2 miR-152在HTR8细胞中表达水平Figure 2 The expression level of miR-152 in HTR8 cells
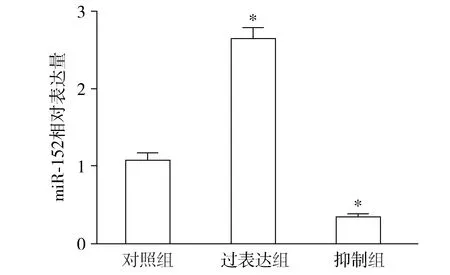
2.3 过表达miR-152对其靶基因HLA-G表达的影响
qRT-PCR和Western blot结果显示,与对照组比较,过表达组细胞中HLA-G在mRNA及蛋白水平表达均显著降低(P<0.01);抑制组细胞中HLA-G在mRNA及蛋白水平表达均显著升高(P<0.01,见图3,表1)。表明miR-152可负性调控HTR8细胞中HLA-G在mRNA及蛋白水平的表达。

表1 HLA-G在mRNA和蛋白水平的表达Table 1 Expression of HLA-G at mRNA and protein levels
图3 HLA-G在蛋白水平表达Figure 3 HLA-G protein expression in three groups
2.4 ELISA检测共培养24 h后上清中GM-CSF的表达
ELISA检测6组共培养上清中细胞因子GM-CSF的浓度,结果显示:与空白共培养组相比,miR-152过表达共培养组、miR-152过表达对照组、通路封闭共培养组、通路封闭对照物组上清中的GM-CSF浓度均降低(P<0.01);其中,通路封闭共培养组上清中GM-CSF的浓度最低(P<0.01,见图4)。提示在过表达miR-152的前提下,同时封闭KIR2DL4受体,能够严重抑制dNK分泌GM-CSF。与空白共培养组相比,miR-152抑制共培养组上清中GM-CSF的浓度增高(P<0.01,见图4)。
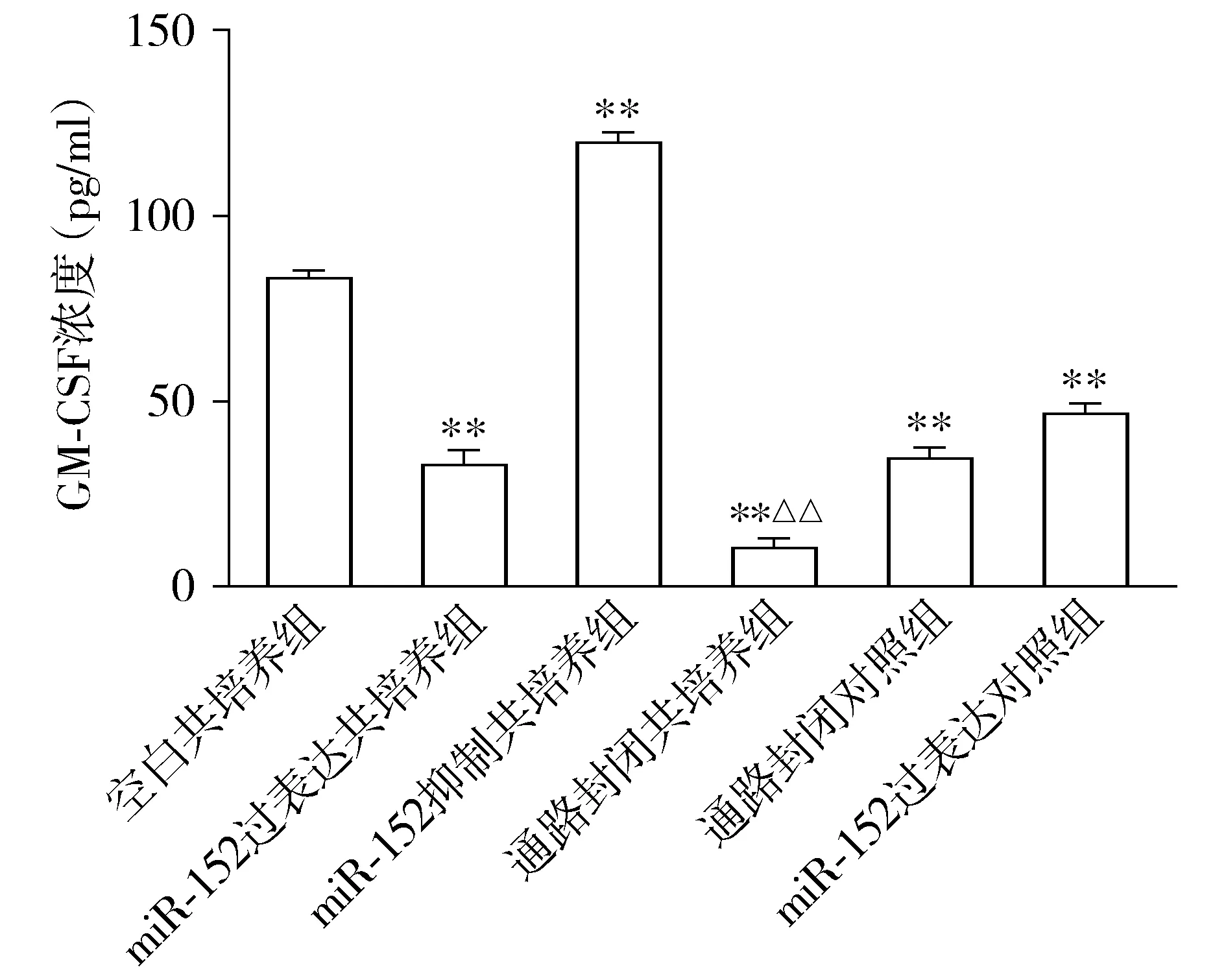
与空白共培养组相比,**P<0.01;与通路封闭对照组相比,△△P<0.01图4 与转染miR-152 mimics及inhibitor的HTR8分别共培养且封闭HLA-G/KIR2DL4通路后dNK分泌GM-CSF的水平变化Figure 4 Changes of GM-CSF secreted by dNK after the co-culture with HTR8 transfected with miR-152 mimics and inhibitor and block of HLA-G/KIR2DL4 pathyway
2.5 共培养后对HUVEC血管形成能力的影响
管样形成实验结果显示:与空白共培养组比较,通路封闭共培养组上清干预后的HUVEC细胞的管腔形成能力,包括总分支长度及管腔数均明显降低(P<0.01);miR-152抑制共培养组上清干预后的HUVEC细胞的管腔形成能力,包括总分支长度及管腔数均明显增高(P<0.01,见图5)。

图5 各组HUVEC血管形成能力情况 (×200)Figure 5 HUVEC blood vessel formation ability in each group (×200)
3 讨论
PE多发生于妊娠20周之后,病情可呈持续性进展,任何程度的PE均可导致母儿严重不良预后[8]。PE的发病机制尚未明确,滋养细胞侵袭障碍、胎盘灌注不良-母体系统性炎症反应[9],以及微小RNA[10]、微环境介质[11]、免疫[12]等因素的综合作用均被发现参与了PE发病过程;而在结构复杂、功能调节方式精密的母胎界面中的异常改变[13],则可能在PE的发病过程中起到了“源头样”作用。
PE的发生源自由蜕膜基质细胞、蜕膜免疫细胞和滋养细胞组成的母胎界面[14]。dNK为母胎界面中重要的免疫细胞组分,能够受到miRNA的间接调控,与复发性流产、PE等发病相关[6,7]。项目组前期发现,在PE胎盘组织中病理性高表达的miR-152能够协同dNK抑制滋养细胞浸润[6],但机制不明。miR-152能够在蛋白水平靶向调控HLA-G已在人绒毛膜癌细胞中得到明确[15],本研究在HTR8中验证了miR-152能够在mRNA及蛋白水平负性调控HLA-G,这与既往研究趋势一致。
HLA-G作为KIR2DL4的唯一配体[16],主要分布于母胎界面的绒毛膜外滋养细胞表面,两者间特异性结合能够传递免疫信号。KIR2DL4为杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)家族成员,其作为NK细胞表面的重要受体,同时发挥活化NK细胞分泌细胞因子和趋化因子,以及抑制激活NK细胞的细胞杀伤作用;HLA-G与KIR2DL4的结合则会促进NK细胞分泌功能,抑制其杀伤活性,从而有利于维系正常妊娠[17]。本研究从人正常早孕蜕膜组织中提取到了纯度较高的dNK,并构建了过表达与抑制miR-152的HTR8和dNK的共培养体系,且在培养过程中特异性封闭KIR2DL4受体;后续ELISA检测培养上清中GM-CSF结果显示,与空白共培养组相比,通路封闭共培养组上清中GM-CSF的浓度最低(P<0.01);miR-152过表达共培养组、miR-152过表达对照组、通路封闭对照组在过表达miR-152的前提条件下,各组上清中GM-CSF的浓度也均分别低于空白共培养组(P<0.01);而抑制miR-152表达后,上清中GM-CSF的浓度高于空白共培养组(P<0.01)。以上结果提示,PE时病理性高表达的miR-152因对其靶基因的负向调控作用,导致HLA-G低表达,从而降低了其与dNK细胞表面KIR2DL4受体的正常结合率,进一步影响dNK分泌功能,导致细胞因子GM-CSF的水平下降。
后续细胞功能验证实验发现:通路封闭共培养组上清干预后,HUVEC的管腔形成能力,包括总分支长度及管腔数明显降低(P<0.01);miR-152抑制共培养组上清干预后,HUVEC的管腔形成能力增强(P<0.01)。上述结果提示当dNK分泌GM-CSF受到抑制后,可影响血内皮细胞成管过程。GM-CSF除经典的造血前体刺激样作用外,还对血管内皮生长因子(vascular endothelial growth factor,VEGF)等细胞因子产生调控作用[18],影响多种细胞的增殖和迁移等功能;在小鼠创伤修复模型中,GM-CSF可促进有丝分裂,加速新生血管形成[19];此外,Zhang等[20]研究发现,dNK能够通过鞘氨醇信号通路以及其表面受体活化后分泌的GM-CSF,参与滋养细胞迁移、血管生成、螺旋动脉重铸等调控过程,这既与我们的发现部分一致,也能够进一步解释共培养条件下细胞功能改变的部分机制。
综上,提示:miR-152可能在HLA-G/KIR2DL4通路的介导下,影响dNK分泌功能,使母胎界面免疫微环境中GM-CSF等细胞因子发生改变,进而抑制HUVEC血管形成能力,诱发后续胎盘血管重塑形成障碍,最终导致PE发生。通过本研究,为PE的病因学研究和临床防治,提供了部分实验和理论依据。
