雄激素对老年大鼠胃粘膜线粒体功能的影响及机制
2021-12-13郭朋璐董曼严晓红康
郭朋璐董 曼严晓红康 洁
(1.哈励逊国际和平医院,消化内科内镜室,河北 衡水 053000;2.河北省以岭医院,石家庄 050000)
氧化应激增加和抗氧化功能降低被认为是胃损伤的关键因素[1-2]。线粒体是衰老过程中细胞生存和死亡的关键调节因子,与年龄相关的结构和功能改变已在人类胃肠道中得到证实[3]。随着年龄的增长,老年大鼠的腺体萎缩被过度产生活性氧的结缔组织所取代,并且Caspase-3凋亡蛋白的表达增加[4]。研究表明雄激素具有抗氧化作用,雄激素缺乏与心血管氧化应激密切相关[5]。雄激素水平影响去势大鼠黑质的氧化应激[6]。目前,尚不清楚雄激素在胃粘膜线粒体介导的细胞凋亡中的作用。因此,本研究旨在探讨雄激素对睾丸切除(gonadectomized,GDX)雄性老年大鼠胃黏膜细胞凋亡的影响,并探讨其分子机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
36只成年雄性SD大鼠,20月龄,体重(550±20)g由北京斯贝福生物技术有限公司[SCXK(京)2016-0002]提供。所有大鼠每笼四只,在受控温度(22±1)℃和湿度(55±5)%条件下,以12 h的明暗循环进行饲养。食物和水可以自由食用。大鼠的组织取材于河北医科大学实验动物中心[SYXK(冀)2019-0004]。动物的使用及实验操作按照河北医科大学实验动物管理委员会(IACUC-JY-2018-075)的规定执行。实验过程中依照3R原则给予所有动物人道主义关怀。
1.1.2 细胞

图1 GES-1细胞Figure 1 GES-1 cell
1.2 主要试剂与仪器
睾丸酮购自北京Solarbio公司(批号:G0712);组织线粒体分离试剂盒(批号:M10274)、ATP检测试剂盒(批号:S33279)购自上海Beyotime公司;Mn-SOD、GSH-Px活性、GSH、GSSG和ROS试剂盒购自南京建成生物工程研究所(批号分别为:960734、970105、944382、983711、952326);Annexinv-FITC/PI凋亡检测试剂盒购自美国Invitrogen公司(批号:BC705);Cell Counting Kit-8试剂盒购自日本Dojindo公司(批号:741261);原位细胞死亡检测试剂盒购自瑞士Roche公司(批号:15396021);Cyt c、Caspase-3或ALDH2抗体均购自美国Abcam公司(批号分别为:ab169407、ab184538、ab11397)。
Synergy2多功能检测仪购自美国BioTek公司;Safire2酶标仪购自瑞士TECAN公司;Tanon 5200 Multi全自动化学发光购自上海天能科技有限公司。
1.3 实验方法
1.3.1 手术和治疗
将大鼠随机分为3组:假手术组(Sham,n=12)、模型组(GDX,n=12)和补充雄激素(androgen,AG)的模型大鼠(n=12)。模型大鼠腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉,并在无菌条件下接受双侧睾丸切除术,包括睾丸、附睾和附睾脂肪的切除。切口用外科钉闭合。假手术组大鼠除双侧睾丸切除术外均接受相同的手术治疗。对于AG组,在下午5:00~6:00将睾丸酮(13.6 mg/(kg·d),溶于芝麻油中)灌胃到大鼠体内。其他组使用芝麻油进行治疗。大鼠连续治疗28 d,进行以下实验。
1.3.2 生化分析
在最后1次治疗后24 h内,大鼠麻醉处死。切除大鼠的胃并用冰冷的生理盐水冲洗,用玻片刮取胃粘膜,采用组织线粒体分离试剂盒分离胃粘膜线粒体,检测线粒体中Mn-SOD、GSH-Px、GSH、GSSG、GSH/GSSG和ROS水平。具体操作为:将胃粘膜在冰冷的缓冲液(10 mmol/L HEPES,pH=7.5,包括200 mmol/L甘露醇、70 mmol/L蔗糖、1.0 mmol/L EGTA、2.0 mg/mL血清白蛋白)中均质,并在4℃下1000 r/min离心10 min。取上清液在4℃下3500 r/min离心10 min,以收集线粒体颗粒。采用试剂盒测定Mn-SOD、GSH-Px活性及GSH、GSSG和ROS的含量。
根据国内企业的财务软件现实使用来看,软件内部的每一个核算子系统之间互相分割,财务数据、信息传输的实时性、一致性、系统性较差,每一个子系统模块之间相互独立,缺乏有效的联系。各个版本的财务软件大多不能有效地结合使用,从而使得财务电算化的系统独立于子系统,而数据交换、信息共享、控制管理等也无法有效开展。
1.3.3 线粒体膜电位
将胃粘膜碎片用平衡盐溶液研磨,并通过尼龙网筛过滤。收集细胞并在37℃的Rh123溶液(10 μg/mL)中培养30 min。在清洗并重新悬浮在1 mL PBS中后,立即通过流式细胞仪(激发/发射波长,488 nm/534 nm)对细胞进行分析。
1.3.4 ATP水平测定
使用ATP检测试剂盒检测ATP。具体操作为,将大鼠胃粘膜匀浆于150 μL溶解缓冲液中,于4℃下12000 r/min离心10 min以收集细胞上清液。在96孔板中加入100 μL ATP检测工作液,然后将收集到的50 μL细胞上清液添加到孔中,并立即使用Synergy2多功能检测仪测量562 nm处吸光值。ATP水平=ATP浓度/蛋白质浓度。
1.3.5 细胞凋亡检测
用Annexinv-FITC/PI凋亡检测试剂盒检测细胞凋亡。取处理后细胞,用冷磷酸盐缓冲盐水冲洗。将细胞(1×105个)重新悬浮在100 μL膜联蛋白结合缓冲液中,然后添加5 μL FITC膜联蛋白V和1 μL PI工作液。室温孵育15 min后,加入400 μL膜联蛋白结合缓冲液并混合,然后用流式细胞仪分析样品。
1.3.6 细胞培养和分组
将人永生胃粘膜细胞GES-1接种在含10%胎牛血清(FBS)的RPMI1640培养基中培养。将细胞分为以下几组:(1)对照组,(2)H2O2组,(3)AG组(含20% AG),(4)Disulfiram组(含5 μmol/L ALDH2抑制剂Disulfiram),(5)Disulfiram+AG组(含5 μmol/L Disulfiram+20% AG)。除对照组外,其余各组均用100 μmol/L H2O2处理6 h,进行以下实验。
1.3.7 细胞活力测定
在孵育6 h后,采用Cell Counting Kit-8试剂盒测量GES-1细胞增殖。将100 μL的混合物(CCK-8与无血清培养基按体积比1:10混合)添加到各孔中,继续孵育1 h,然后使用Safire2酶标仪通过测量450 nm和600 nm之间的光密度差来确定存活细胞的数量。所有实验均重复3次。
1.3.8 TUNEL分析
将GES-1细胞(3×105个/孔)接种于载玻片上,37℃培养24 h,用100 μmol/L H2O2处理6 h,再用4%多聚甲醛固定。使用原位细胞死亡检测试剂盒进行TUNEL分析。用荧光显微镜对载玻片进行分析和成像。所有实验均重复3次。
1.3.9 Western blot分析
将胃粘膜在RIPA缓冲液中匀浆,在4℃以12000 r/min离心20 min,收集上清液。将蛋白质样品(20~50 μg)加载在12%聚丙烯酰胺凝胶上,电泳转移到PVDF膜。将膜暴露于封闭缓冲液中2 h,在4℃下与一级抗体Cyt c(1∶200)、Caspase-3(1∶1000)或ALDH2(1∶1000)抗体孵育过夜。然后在室温下与HRP结合的二级山羊抗兔IgG(1∶2000)和山羊抗鼠IgG(1∶5000)一起孵育1 h。最后用化学发光法在Tanon 5200 Multi全自动化学发光观察结果。
1.4 统计学方法
2 结果
2.1 雄激素对GDX老年大鼠氧化指标的影响
假手术、GDX与AG组间ROS、Mn-SOD、GSHPx、GSH和GSSG水平存在显著差异(P<0.001)。与Sham组相比,GDX组ROS和GSSG水平显著增加(P<0.05),而Mn-SOD、GSH-Px、GSH、GSH/GSSG水平显著降低(P<0.05)。在雄激素治疗后,GDX老年大鼠上述变化显著逆转(P<0.05)(表1)。
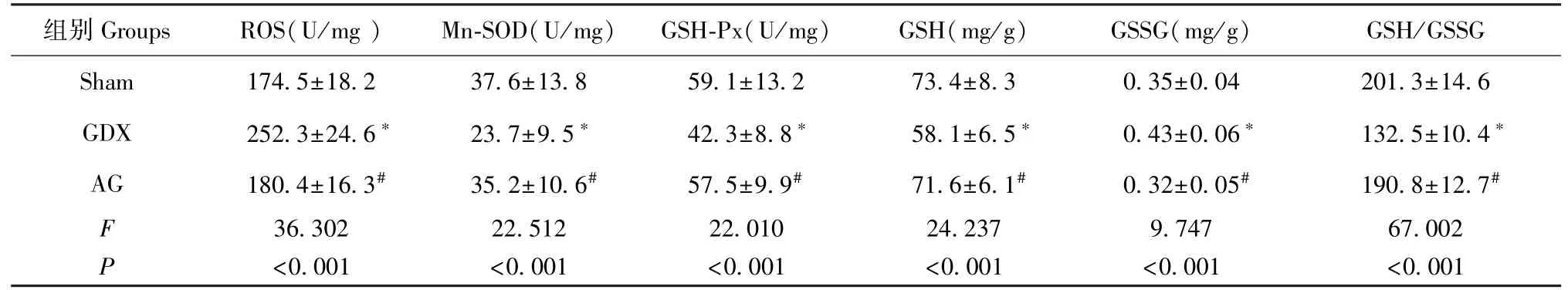
表1 GDX和雄激素给药对胃黏膜线粒体ROS、Mn-SOD、GSH-Px、GSH和GSSG水平的影响Table 1 Effects of GDX and androgen on the levels of ROS,Mn-SOD,GSH Px,GSH and GSSG in gastric mucosa mitochondria
2.2 雄激素对GDX老年大鼠胃粘膜线粒体膜电位、ATP水平和Cyt c蛋白影响
假手术、GDX与AG组间线粒体膜电位、ATP水平、细胞质Cyt c蛋白和线粒体Cyt c蛋白存在显著差异(F=33.126、24.412、55.518、89.742,均P<0.001)。事后检验显示,与Sham组相比,线粒体膜电位、ATP水平和线粒体Cyt c蛋白表达均显著降低(P<0.05),而细胞质Cyt c蛋白表达显著增加(P<0.05)。在雄激素治疗后,GDX老年大鼠上述变化显著逆转(P<0.05)(图2)。

图2 GDX和雄激素给药对胃粘膜的影响Note.A,ATP level.B,Membrane potential.C~E,Cyt C protein expression.Compared with Sham group,*P<0.05.Compared with GDX group,#P<0.05.Figure 2 Effects of GDX and androgen in gastric mucosa
2.3 雄激素对GDX老年大鼠胃粘膜细胞凋亡分析
假手术、GDX与AG组间胃粘膜细胞凋亡和ALDH2、裂解的Caspase-3蛋白表达存在显著差异(F=35.416、28.291、27.526,均P<0.001)。事后检验显示,与Sham组相比,胃粘膜细胞凋亡和裂解的Caspase-3蛋白表达均显著增加(P<0.05),而ALDH2蛋白表达显著降低(P<0.05)。在雄激素治疗后,GDX老年大鼠上述变化显著逆转(P<0.05)(图3)。

图3 GDX和雄激素给药对胃粘膜细胞凋亡影响Note.A,Cell apoptosis was detected by flow cytometry.B~D,Western blot was used to analyze the expression of ALDH2 and Caspase-3.Compared with Sham group,*P<0.05.Compared with GDX group,#P<0.05.Figure 3 Effects of GDX and androgen on apoptosis of gastric mucosal cells
2.4 雄激素降低H2O2处理的GES-1细胞氧化应激相关损伤
ALDH2是一种线粒体基质蛋白,在肝、肾、心、肺和胃肠道等多种组织中有组成性表达。ALDH2在由氧化应激诱导的脂质过氧化产生的ROS清除中起着重要作用[7]。研究进一步考察雄激素是否通过激活ALDH2保护氧化应激诱导的胃粘膜细胞凋亡。采用Disulfiram抑制GES-1细胞中ALDH2表达,Western blot分析显示,GES-1细胞暴露于H2O2或者加入Disulfiram后,ALDH2蛋白表达明显降低,而加入雄激素可增强ALDH2蛋白表达(图4 A)。此外,与对照组相比,H2O2组细胞活力显著降低(P<0.05),细胞凋亡数目明显增加(P<0.05)。雄激素处理显著逆转了H2O2对GES-1的损伤作用(P<0.05),并减少了细胞凋亡数目(P<0.05);然而,当联合加入Disulfiram时,雄激素的治疗活性明显降低(P<0.05)(图4B~G)。此外,雄激素处理显著逆转了H2O2诱导的GSH活性和GSH/GSSG比例降低,和GSSG活性增加;当联合加入Disulfiram时,这种逆转作用降低。

图4 雄激素降低H2O2处理的GES-1细胞氧化应激相关损伤Note.A,Expression of ALDH2 protein was analyzed by Western blot.B,CCK-8 was used to detect cell viability.C,D,TUNEL method was used to detect the apoptosis.E~G,GSH and GSSG levels,and GSH/GSSG ratio.Compared with control group,*P<0.05.Compared with H2O2 group,#P<0.05.Compared with Disulfiram+AG group,&P<0.05.Figure 4 Androgen reduced oxidative stress-related injury in GES-1 cells treated with H2O2
3 讨论
在本研究中,我们发现雄激素影响GDX老年大鼠胃黏膜氧化应激参数、线粒体功能和凋亡。雄性GDX老年大鼠线粒体ROS和GSSG水平升高,线粒体Mn-SOD、GSH-px和GSH活性降低,线粒体膜电位和ATP水平降低。GDX也增加了胃粘膜细胞凋亡以及胞浆Cyt c和裂解Caspase-3的表达,并降低线粒体Cyt c的表达。这些数据支持雄激素在维持胃粘膜线粒体功能中起着重要作用,线粒体作为潜在的雄激素靶点与大鼠胃黏膜细胞凋亡有关。
线粒体作为ROS的主要来源和ROS损伤的主要靶点,受到外源性ROS清除和内源性ROS刺激的影响[8]。Mn-SOD和GSH-PX存在于线粒体基质或线粒体膜间空间。其中,Mn-SOD能催化超氧自由基转化H2O2,从而清除毒素。GSH-Px催化线粒体H2O2的还原,使GSH生成GSSG[9]。GSH水平和GSH/GSSG比值的降低被认为是氧化还原失衡的证据[9]。本研究发现,GDX老年大鼠胃黏膜线粒体ROS升高,Mn-SOD、GSH-Px和GSH/GSSG水平降低,提示GDX老年大鼠存在氧化应激。抗氧化防御和氧化损伤的恶化与线粒体功能障碍密切相关[4]。线粒体功能障碍又会导致更多的自由基生成,并降低抗氧化能力[10]。补充雄激素可恢复GDX老年大鼠胃黏膜线粒体膜电位和ATP水平。因此,研究结果表明雄激素可以通过调节线粒体功能提供抗氧化作用。线粒体膜电位的降低与凋亡相关的线粒体功能障碍相关,这会导致活性氧的生成,并启动线粒体介导的凋亡信号[11]。
ROS参与了细胞凋亡的诱导。以前的研究表明,细胞内ROS的产生可能是一个保守的凋亡事件[12]。线粒体在内源性凋亡途径中起着关键作用。高浓度ROS暴露可引起线粒体释放Cyt c[13]。内源性途径的诱导依赖于Cyt c从线粒体释放到细胞质,并诱导与凋亡细胞死亡有关的细胞内蛋白质水解,特别是Caspases-3[14]。在本研究中,我们发现GDX雄性大鼠胃粘膜细胞凋亡明显增加,伴随着Cyt c从线粒体释放到胞浆中的增加,及Caspase-3的激活。补充雄激素可逆转这些变化,表明雄激素缺乏诱导GDX老年大鼠胃黏膜细胞凋亡,涉及线粒体介导的凋亡途径参与。衰老可能增加患消化性溃疡病的风险。一些研究表明,老化的胃粘膜随着脂质过氧化氢和Caspase-3表达的增加而受损[15]。因此,雄激素可能是预防消化性溃疡病的潜在药物。
ALDH2是一种由位于染色体12q24的核基因编码的线粒体基质蛋白,该蛋白是一种具有56×103相同亚基的四聚体酶[7]。ALDH2在由氧化应激诱导的脂质过氧化产生的ROS清除中起着重要作用[16]。本研究发现,在GDX老年大鼠胃黏膜中ALDH2水平降低,补充雄激素可恢复ALDH2水平。因此,我们进一步验证了雄激素是否通过激活ALDH2减轻胃粘膜细胞氧化应激相关损伤。体外分析结果显示,ALDH2抑制剂Disulfiram降低雄激素对GES-1细胞损伤的保护作用,证实了雄激素通过激活ALDH2来减轻GDX老年大鼠胃黏膜细胞损伤。
综上所述,雄激素缺乏导致老年大鼠胃粘膜细胞线粒体功能障碍和线粒体ROS积累增加,诱导胃黏膜细胞凋亡,这种损害作用至少部分与ALDH2的抗氧化功能抑制有关。
