基于TLR4通路依托咪酯对感染性休克大鼠急性肺损伤的保护作用研究
2021-12-13王清兵路超于
王清兵路 超于 刚
(1.滨州市中心医院麻醉科,山东 滨州 251700;2.滨州市中心医院产房,山东 滨州 251700)
感染性休克是晚期脓毒血症的一种严重并发症,感染性休克常伴发急性肺损伤,机体出现急性、进行性低氧呼吸功能障碍,若不及时干预可引发多器官功能衰竭,死亡率极高[1]。因此,研究感染性休克导致急性肺损伤的机制并给予及时有效干预,对疾病预后有重要意义。炎症反应是感染性休克发生发展的基础,炎性介质如革兰氏阴性细菌外膜脂多糖(lipopolysaccharide,LPS)过度释放,引起促炎因子过度释放,从而引发炎症级联反应及一系列病理生理反应[2]。依托咪酯(etomidate,Eto)是临床常用短效麻醉药,研究显示,Eto可抑制肾上腺皮质功能,从而调控机体炎症反应,降低患者体内促炎因子水平,但具体调控机制尚不明确[3-4]。Toll样受体4(Toll like receptor 4,TLR4)是LPS受体,与免疫炎症反应关系密切[5-6]。因此,本研究采用盲肠结扎穿孔法建立感染性休克大鼠模型,观察Eto抑制感染性休克大鼠炎症反应的机制。
1 材料和方法
1.1 实验动物
SPF级SD大鼠,75只,7周龄,均为雄性,体重250~300 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],饲养于齐鲁动物保健品有限公司,使用许可证号[SYXK(鲁)2019-0020],获得滨州市中心医院伦理审批(IACUC-20190210012),研究过程中做到了3R原则。
1.2 主要试剂与仪器
Eto(江苏恩华药业股份有限公司,国药准字H20020511);LPS(北京索莱宝科技有限公司);大鼠内毒素(endotoxin,ET)ELISA试剂盒(上海颖心实验室设备有限公司);白介素(interleukin)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(上海邦奕生物);BCA蛋白浓度测定试剂盒(上海碧云天生物);兔抗大鼠TLR2、髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)、核转录因子κB p65(nuclear factor κB p65,NF-κB p65)多抗(一抗,美国Abcam公司);辣根过氧化物酶标记的山羊抗兔IgG单抗(二抗,北京索莱宝科技有限公司);徕卡切片机(德国徕卡,RM2016);实时荧光定量PCR仪(美国ABI公司,7500);化学发光成像分析系统(美国Bio-rad公司,CheniDoc XRS)。
1.3 实验方法
1.3.1 分组和模型制备
75只大鼠随机分为假手术组、模型组、模型-LPS组、模型-Eto组、模型-Eto-LPS组,各15只。除假手术组外,其余各组依据参考文献[7]采用盲肠结扎穿孔法复制感染性休克大鼠模型:以1.0 g/kg体重20%乌拉坦腹腔注射麻醉所有大鼠,监测颈内动脉平均动脉压(mean arterial pressure,MAP),左侧股静脉置入套管针,腹中线作2 cm切口,游离暴露盲肠,用3-0丝线环形结扎末端盲肠,用20 G针穿透末端盲肠壁2处(距离约3 mm),保证粪便持续流出,还纳肠管后逐层闭合腹腔。监测MAP,低于基础值70%时认为感染性休克建模成功。假手术组仅作剖腹手术,不结扎盲肠和穿孔,其余操作相同。
1.3.2 干预方法
手术前30 min,模型-LPS组腹腔注射LPS 15 mg/kg,模型-Eto组腹腔注射依托咪酯60 mg/kg(首次10 mg/kg,待大鼠有体动反应后每次追加10 mg/kg至给药完毕),模型-Eto-LPS组同时腹腔注射依托咪酯60 mg/kg+LPS 15 mg/kg,模型组和假手术组腹腔注射生理盐水。
1.3.3 标本采集
预实验显示盲肠结扎穿孔法复制感染性休克模型出现休克的时间为术后4.5~5.0 h,故以术后5 h为取材时间点。眼眶静脉丛取血1.0 mL,3000 r/min离心10 min(离心半径12 cm),收集上层血清,-20℃保存备用。处死各组大鼠,于气管环切后插入气管套管,用1 mL PBS反复灌洗,获得肺泡灌洗液(alveolar lavage fluid,BALF),-20℃保存备用。收集BALF后打开胸腔,取右肺组织,固定于10%中性甲醛备用,另取部分右肺组织置于-80℃保存备用。
1.3.4 血清ET含量及BALF中炎症因子水平检测
取血清和BALF样本,分别采用大鼠ET、IL-1β、IL-6、TNF-α ELISA试剂盒检测血清ET含量及BALF中炎症因子水平,按照试剂盒说明书操作,于酶标仪上检测吸光度值(A570),吸光度-浓度曲线得出数据。
1.3.5 肺组织病理学观察
取固定好的肺组织,常规制作石蜡切片,进行常规苏木精-伊红(hematoxylin-eosin,HE)染色,观察肺组织病理学改变。
1.3.6 肺组织TLR4、MyD88、NF-κB p65 mRNA表达量检测
取-80℃保存的肺组织,提取总RNA后进行逆转录,得到cDNA并调整其浓度,进行实时荧光定量PCR反应,扩增条件:95℃,60 s;95℃,15 s;60℃,20 s;72℃,45 s;共40循环,72℃再延伸5 min,以βactin为管家基因,2-ΔΔCT计算TLR4、MyD88、NF-κB p65 mRNA的相对表达强度。引物序列见表1。
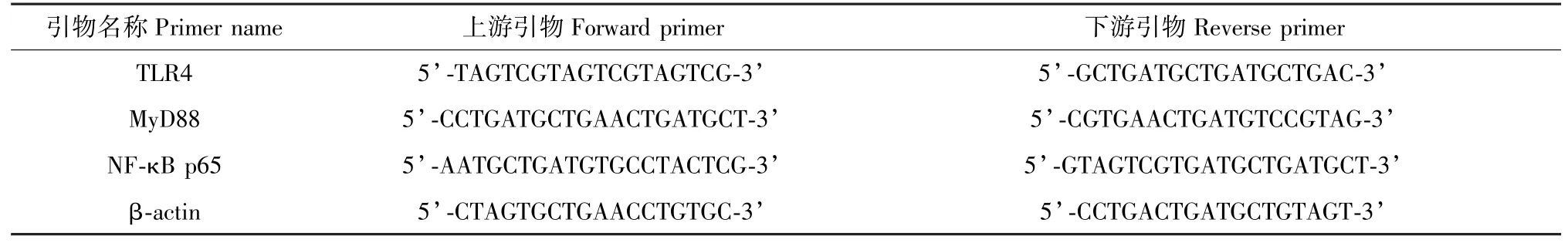
表1 引物序列Table 1 Primer sequence
1.3.7 肺组织TLR4、MyD88、NF-κB p65蛋白表达量检测
将-80℃保存的肺组织研磨,用细胞裂解液裂解20 min,取裂解上清液,进行蛋白定量,取待测蛋白,进行SDS-PAGE电泳,经电转、封闭后,加入1∶1000一抗,4℃过夜,TBST洗涤,加入1∶5000二抗,室温2 h,暗室中曝光显影,凝胶成像系统扫描拍照并进行灰度值分析(内参对照为β-actin)。
1.4 统计学方法
用SPSS 21.0分析数据,计量资料均以平均数±标准差(±s)表示,采用单因素方差分析多样本组间资料,两样本比较用LSD-t检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
除模型组1只、模型-LPS组2只大鼠术后未苏醒建模失败外,其余均建模成功,途中无脱落。假手术组大鼠术后活动及对外界刺激反应均正常;模型组及模型-LPS组术后出现呼吸频率加快、喜卧、寒战、对外界刺激反应差等情况,且模型-LPS组更为严重,出现拒绝饮食进水、呼吸窘迫等情况;模型-Eto组上述症状较模型组减轻,模型-Eto-LPS组较模型-Eto组严重。
2.2 各组大鼠ET含量比较
大鼠ET含量组间比较,差异有统计学意义(P<0.05);模型组、模型-LPS组、模型-Eto组、模型-Eto-LPS组ET含量均高于假手术组,其中模型-Eto组<模型-Eto-LPS组<模型组<模型-LPS组,差异均有统计学意义(P<0.05)。见图1。
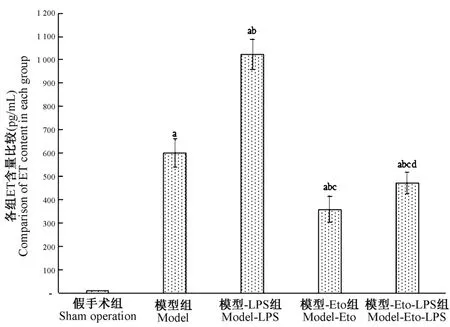
图1 ET含量比较Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with model-LPS group,cP<0.05.Compared with model-Eto group,dP<0.05.Figure 1 Comparison of ET content
2.3 各组大鼠BALF中IL-1β、IL-6、TNF-α水平比较
大鼠BALF中IL-1β、IL-6、TNF-α水平组间比较,差异有统计学意义(P<0.05);与假手术组比较,模型组、模型-LPS组、模型-Eto组、模型-Eto-LPS组BALF中IL-1β、IL-6、TNF-α水平均较高,其中模型-Eto组<模型-Eto-LPS组<模型组<模型-LPS组,差异均有统计学意义(P<0.05)。见表2。
表2 BALF中IL-1β、IL-6、TNF-α水平比较(¯±s)Table 2 Comparison of IL-1 β,IL-6 and TNF-α levels in BALF
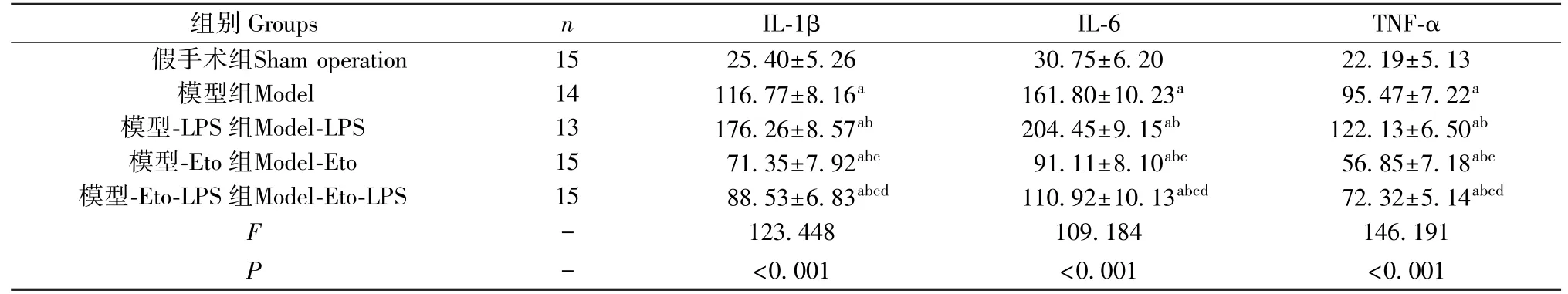
表2 BALF中IL-1β、IL-6、TNF-α水平比较(¯±s)Table 2 Comparison of IL-1 β,IL-6 and TNF-α levels in BALF
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与模型-LPS组比,cP<0.05;与模型-Eto组比,dP<0.05。Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with model-LPS group,cP<0.05.Compared with model-Eto group,dP<0.05.
?
2.4 各组肺组织病理学观察
HE染色显示,假手术组肺组织结构基本正常;模型组和模型-LPS组肺组织出现急性损伤,肺泡明显充血,肺泡壁、肺间质增厚,大量中性粒细胞、淋巴细胞等炎性细胞浸润,且模型-LPS组病变更为严重;模型-Eto组和模型-Eto-LPS组肺组织的上述病变均减轻,但偶有肺泡毛细血管充血和炎性细胞浸润,且模型-Eto组减轻更为明显。见图2。
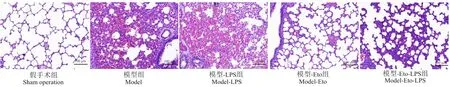
图2 各组大鼠肺组织HE染色图片Figure 2 HE staining pictures of lung tissue in each group
2.5 各组肺组织中TLR4、MyD88、NF-κB p65 mRNA相对表达量比较
大鼠肺组织中TLR4、MyD88、NF-κB p65 mRNA相对表达量组间比较,差异有统计学意义(P<0.05);与假手术组比较,模型组、模型-LPS组、模型-Eto组、模型-Eto-LPS组肺组织中TLR4、MyD88、NF-κB p65 mRNA相对表达量均较高,其中模型-Eto组<模型-Eto-LPS组<模型组<模型-LPS组,差异均有统计学意义(P<0.05)。见表3。
表3 肺组织中TLR4、MyD88、NF-κB p65 mRNA相对表达量比较(±s)Table 3 Comparison of TLR4,MyD88 and NF-κB p65 mRNA expression in lung tissue
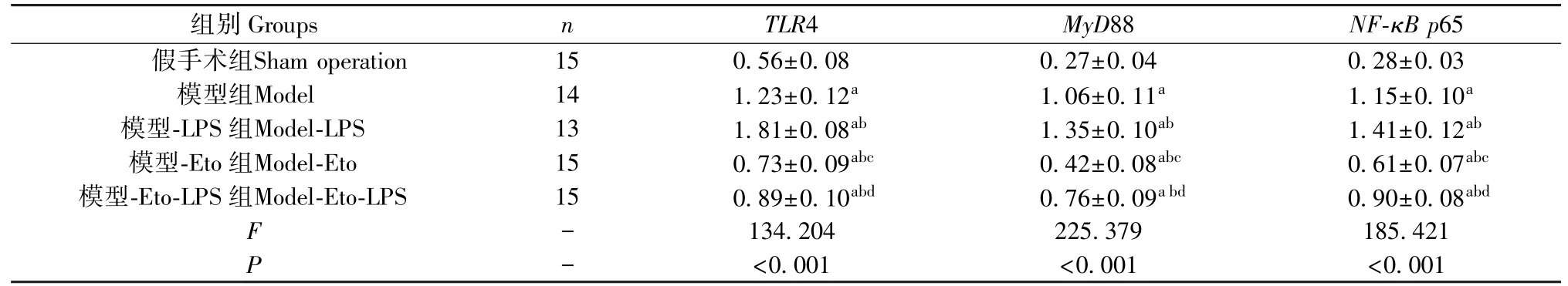
表3 肺组织中TLR4、MyD88、NF-κB p65 mRNA相对表达量比较(±s)Table 3 Comparison of TLR4,MyD88 and NF-κB p65 mRNA expression in lung tissue
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与模型-LPS组相比,cP<0.05;与模型-Eto组相比,dP<0.05。Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with model-LPS group,cP<0.05.Compared with model-Eto group,dP<0.05.
?
2.6 各组肺组织中TLR4、MyD88、NF-κB p65蛋白相对表达量比较
各组肺组织中TLR4、MyD88、NF-κB p65表达量比较,差异有统计学意义(P<0.05);与假手术组比较,模型组、模型-LPS组、模型-Eto组、模型-Eto-LPS组肺组织中TLR4、MyD88、NF-κB p65蛋白相对表达量均较高,其中模型-Eto组<模型-Eto-LPS组<模型组<模型-LPS组,差异均有统计学意义(P<0.05)。见图3。
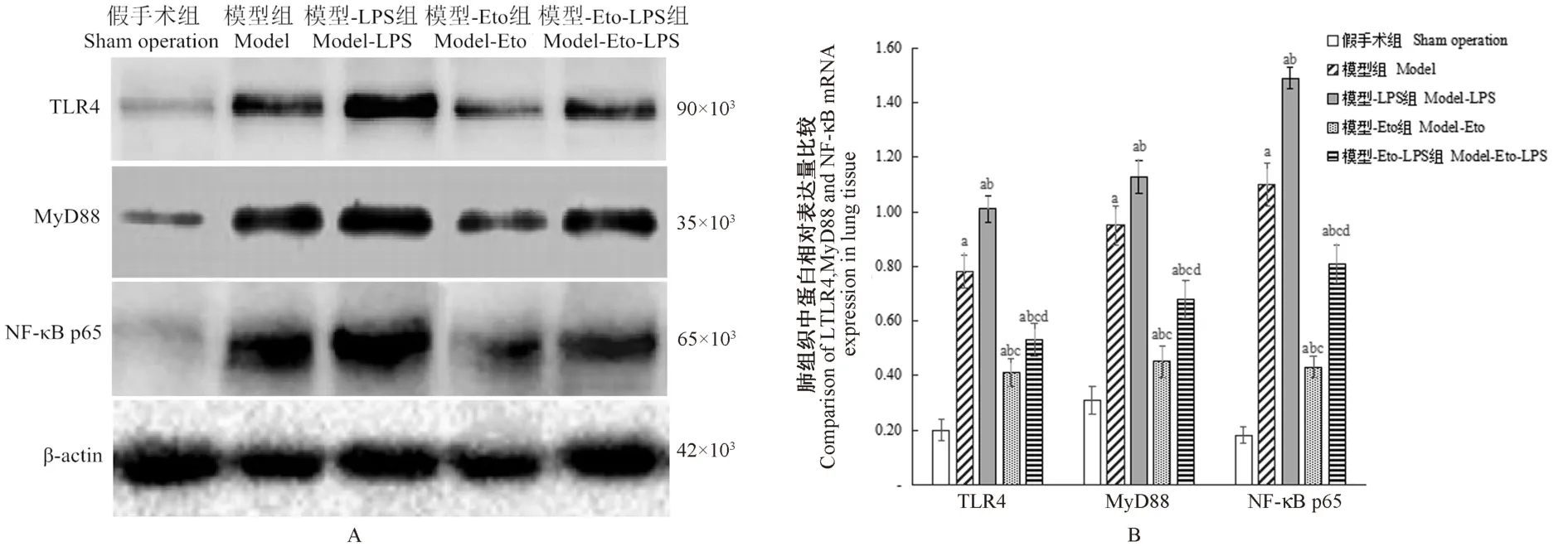
图3 肺组织中TLR4、MyD88、NF-κB p65蛋白相对表达量比较Note.Compared with sham operation group,aP<0.05.Compared with model group,bP<0.05.Compared with model-LPS group,cP<0.05.Compared with model-Eto group,dP<0.05.Figure 3 Comparison of relative expressions of TLR4,MyD88 and NF-κB p65 in lung tissue
3 讨论
感染性休克发病机制十分复杂,由其导致的急性肺损伤已成为感染性休克患者死亡的主要原因[8-9]。严重感染尤其是革兰氏阴性细菌感染可释放LPS、肽糖酐等毒性代谢物,从而激活机体体液和细胞免疫反应系统,促进TNF-α、IL-1β等多种促炎因子释放[10]。研究显示,炎性介质和细胞因子可增加毛细血管通透性、促进血小板凝集等作用,从而对血管造成严重损伤,且此种损伤不依赖初始触发因素,一旦启动可不断放大,最终导致肺毛细血管膜通透性增加,引起急性肺损伤[11-12]。盲肠结扎穿孔具有完全模拟感染性休克发生发展的病理过程的优势,同时可给模型动物足够反应时间,是感染性休克常用的动物模型复制方法。本研究应用盲肠结扎穿孔法复制感染性休克大鼠模型,观察Eto干预对急性肺损伤的保护作用及调控机制,为临床治疗提供参考。
Eto属于咪唑类衍生物,具有起效快、副作用少等优点,在麻醉诱导和维持中具有较高应用价值[13]。既往研究显示,Eto可抑制机体腺皮质功能,从而抑制促炎因子释放,调节细胞因子平衡[14-15]。另有研究表明,Eto可通过抑制血浆皮质醇的分泌,从而降低机体应激反应,抑制急性炎症反应,且抑制作用可持续至停药后24 h[16]。本研究复制感染性休克大鼠模型后,模型组大鼠BALF中IL-1β、IL-6、TNF-α水平明显升高,说明大鼠肺已出现急性炎症反应,模型-Eto组大鼠ET含量及BALF中IL-1β、IL-6、TNF-α水平均降低,肺组织病变减轻,提示Eto可抑制内毒素及促炎因子释放,对感染性休克大鼠急性肺损伤具有保护作用。
TLR4是TLRs家族重要成员之一,是机体固有免疫系统重要组成部分[17]。MyD88是TLR4下游重要信号分子,TLR4识别病原而活化,与MyD88结合并使其活化,从而激活下游NF-κB,促进炎症相关基因转录和翻译,IL-1β、IL-6、TNF-α大量合成和分泌,引起炎症级联反应[18-20]。因此,若可靶向抑制TLR4水平则可有效阻断炎症级联反应。既往研究显示,Eto可通过调节TLR4信号通路抑制内毒素所致小鼠急性肺损伤的炎症反应,说明Eto可靶向抑制TLR4炎症级联反应[21]。本研究复制感染性休克大鼠模型后,模型组大鼠TLR4、MyD88、NF-κB表达均上调,TLR4通路激活;模型-Eto组TLR4、MyD88、NF-κB表达下调,说明Eto可抑制TLR4通路;在Eto干预基础上给予TLR4激活剂LPS干预,模型-Eto-LPS组TLR4、MyD88、NF-κB表达较模型-Eto组上调,且ET含量及BALF中IL-1β、IL-6、TNFα水平较模型-Eto组升高,进一步说明Eto是通过TLR4通路抑制感染性休克大鼠急性炎症反应,发挥对急性肺损伤的保护作用。
综上所述,Eto对感染性休克大鼠急性肺损伤具有保护作用,可能通过抑制TLR4/MyD88/NF-κB通路发挥调控作用,为临床感染性休克所致急性肺损伤的防治提供参考依据。在进一步的研究中,应继续开展大样本动物实验验证本研究的结果,且需深入剖析Eto对急性肺损伤的保护机制,为临床提供更多参考依据。
