青阳参根中一个新的苯二氢化萘型木脂素
2021-12-13李小叁罗宇浩何妙莹吴绮靖杨雪梅
李小叁,龙 娟,罗宇浩,何妙莹,吴绮靖,刘 立,杨雪梅
广东医科大学药学院,东莞 523808
青阳参(CynanchumotophyllumSchneid)是萝藦科鹅绒藤属植物中常见的民间用药,该植物多年生草质缠绕藤本,主要分布于我国的云南、四川、广西、西藏和贵州等省份。青阳参的主要药用部位为根茎。味辛,甘,性温,有一定毒性,祛风湿,益肾健脾和胃。现已上市的青阳参片,有平肝补肾、豁痰镇痉作用,主要用于癫痫、头昏头痛、眩晕、耳鸣、腰膝酸软等症状。研究表明,青阳参的干燥根有抗癫痫、抗抑郁、免疫调节、抗肝炎和抗美尼尔综合征作用[1]。青阳参的化学成分结构类型多样,主要有C21甾类和去氧寡糖[2],其中C21甾类被认为是青阳参的特征性物质和主要药效成分[3-5]。现代药理学研究表明萝藦科植物来源的C21甾类成分具有丰富的生物活性,比如抗肿瘤、抗炎、抗真菌、抗病毒等[2]。近些年来,萝藦科来源的天然C21甾体苷元拥有显著的抗肿瘤活性[6,7],具有潜在的研究价值。青阳参是我国的传统民间用药,在我国资源丰富,但目前对其化学成分研究多数为C21甾体,缺少对其他类型成分研究。近期本课题组对青阳参干燥根的酸水解物的化学成分进行研究,从中得到了一系列结构新颖、具有显著抗肿瘤活性的C21甾体苷元[8]。然而在研究过程中,我们发现了其酸水解物中存在一些微量的其他类型成分。因此,为了进一步了解中药青阳参的物质基础,提高其资源综合利用效率,本文对青阳参干燥根的酸水解物的其他类型成分进行了分离纯化和结构鉴定,并测试了分离化合物的细胞毒活性,以期发现结构新颖的抗肿瘤先导化合物。
1 材料与方法
1.1 材料
Bruker-AV400 NMR和600 NMR核磁共振仪(瑞士Bruker公司);Micromass Q-TOF高分辨(美国Waters公司)和Triple Quad 4500低分辨质谱仪(美国SCIEX公司);Technologies 1260 infinity系列分析型和制备型高效液相色谱仪(德国Agilent公司);C18色谱柱:半制备型:5 μm,250 (10.0 mm,分析型,分析型:5 μm,250 mm× 4.6 mm(美国Epic C18);P-1020型旋光测定仪(日本JASCO公司);QF-510A FT-IR红外光谱仪(北京北芬-瑞丽分析仪器公司);V-550 UV/VIS紫外光谱仪(日本JASCO公司);色谱纯乙腈、甲醇(德国Merck公司);旋转蒸发仪(EA-52型,上海亚荣生化仪器厂);硅胶(200~300目)、硅胶GF254薄层板(青岛海洋化工有限公司);所用其他分析纯试剂均为天津市科密欧化学试剂有限公司生产;培养皿、96孔板(ACEA,美国);胰蛋白酶、DMEM高糖培养基(Gibco)、胎牛血清、谷氨酰胺(Biological Industries,以色列);DMSO(Solarbio);秋水仙碱(纯度99%,阿拉丁试剂公司);水为超纯水,PBS缓冲液等为自配。
中药青阳参干燥根于2019年3月购买于中国云南省昆明市常真堂制药有限公司。由广东医科大学药学院苟占平教授鉴定为青阳参干燥根,标本(No.201903)保存于广东医科大学药学院。
1.2 实验方法
1.2.1 提取和分离
青阳参干燥根15 kg,利用95%乙醇-水(30 L)回流提取4次,每次2 h,然后减压浓缩得到粗提取物(2.25 kg)。粗提取物溶解于5%HCl甲醇-水溶液(V/V,2∶1,30 L)中,加热回流反应3 h,然后慢慢滴加10%NaOH水溶液,中和至pH=7.0。然后浓缩去除有机溶剂,加入水稀释,用乙酸乙酯萃取,浓缩后得到酸水解物(1.48 kg)。取1.0 kg水解物,利用硅胶开放柱色谱,氯仿-甲醇梯度洗脱(95∶1→2∶1,V/V),分离得到10个馏分(Fr.1~Fr.10)。
馏分Fr.5(132.0 g)利用硅胶开放柱色谱,石油醚/乙酸乙酯梯度洗脱(2∶1→1∶5,V/V),得到9个子馏分(Fr.5-1~Fr.5-9)。馏分Fr.5-6(14.0 g)利用硅胶开放柱色谱,环己烷/乙酸乙酯梯度洗脱(2∶1→1∶1,V/V),得到5个子馏分(Fr.5-6-1~Fr.5-6-5)。馏分Fr.5-6-5(450 mg)经制备型高效液相(45%甲醇水,流速3.0 mL/min)得到化合物1(tR= 22.5 min,4.3 mg);馏分Fr.7(30.7 g)利用硅胶开放柱色谱,石油醚/乙酸乙酯梯度洗脱(2∶1→1∶2,V/V),得到9个子馏分(Fr.7-1~Fr.7-9)。馏分Fr.7-8(2.8 g)经制备型高效液相(70%甲醇水,流速3.0 mL/min)得到7个子馏分(Fr.7-8-1~Fr.7-8-7)。馏分Fr.7-8-2(86.1 mg)经制备型高效液相(50%甲醇水,流速3.0 mL/min)得到化合物2(tR= 25.0 min,4.5 mg)。馏分Fr.7-8-3(162.2 mg)经制备型高效液相(55%甲醇水,流速3.0 mL/min)得到化合物3(tR= 22.0 min,22.0 mg)和化合物4(tR= 26.0 min,34.2 mg)。
1.2.2 细胞毒活性测试
选择对数生长的肿瘤细胞(HeLa、H1299、HepG2和MCF-7)用含10% FBS(胎牛血清),1%的左旋谷氨酰胺(L-glutamine),100 units/mL的盘尼西林(penicillin)和100 g/mL的链霉素的RPMI 1640培养基培养。将培养的细胞以5 × 103/孔数量接种于96孔板上,每孔100 μL。在含5% CO2的37 ℃孵育箱中培养48 h,加入不同浓度的待筛样品(化合物1~4和阳性对照秋水仙碱),同时设溶剂空白对照组,37 ℃培养48 h。将96孔板中的原培养基吸出,加入稀释的0.5 mg/mL MTT PBS液,100 μL/孔。在37 ℃孵育4 h后,吸出MTT溶液,加入100 μL的DMSO溶剂,100 μL/孔,使形成的甲瓒晶体溶解,在摇床上低速震荡5 min。然后将96孔板置于酶标仪中570 nm单波长检测吸光值并计算肿瘤细胞生长抑制率:细胞生长率=(实验组OD值-空白孔OD值)/(阳性对照组OD值-空白孔OD值)×100%。重复实验3次,进行量效曲线的绘制和IC50值的计算。
2 结果与分析
2.1 结构鉴定
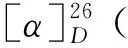
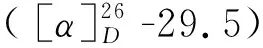

表1 化合物1的1H 和 13C NMR数据(600和150 MHz,CD3OD)Table 1 1H and 13C NMR data of compound 1(600 and 150 MHz,CD3OD)
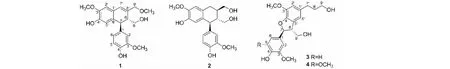
图1 化合物1~4的化学结构Fig.1 The structures of compounds 1-4
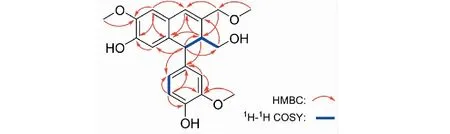
图2 化合物1的主要1H-1H COSY和HMBC相关Fig.2 Key 1H-1H COSY and HMBC correlations of compound 1

化合物3黄色不定型粉末(甲醇),易溶于氯仿、甲醇等有机溶剂。ESI-MS:m/z383.5 [M + Na]+;提示该化合物分子量为360。1H NMR(400 MHz,CD3OD)δH:6.97(1H,d,J= 1.2 Hz,H-2),6.84(1H,dd,J= 8.0,1.2 Hz,H-6),6.79(1H,d,J= 8.0 Hz,H-5),6.74(2H,s,H-2′,6′),5.51(1H,d,J= 6.4 Hz,H-7),3.86(3H,s,3′-OCH3),3.82(3H,s,3-OCH3),3.84(1H,m,H-9b),3.76(1H,m,H-9a),3.59(2H,m,H-9′),3.48(1H,m,H-8),2.64(2H,m,H-7′),1.84(2H,m,H-8′);13C NMR(100 MHz,CD3OD)δC:134.8(s,C-1),110.6(d,C-2),149.0(t,C-3),147.5(t,C-4),116.1(d,C-5),119.7(d,C-6),89.0(d,C-7),55.4(d,C-8),65.0(t,C-9),56.8(q,3-OCH3),136.9(s,C-1′),114.1(d,C-2′),145.2(s,C-3′),147.4(s,C-4′),129.9(s,C-5′),117.9(d,C-6′),32.9(t,C-7′),35.8(t,C-8′),62.2(t,C-9′),56.4(3′-OCH3)。以上数据与文献报道基本一致[15],故鉴定化合物3为dehydroconiferyl alcohol。
化合物 4黄色不定型粉末(甲醇),易溶于氯仿、甲醇等有机溶剂。ESI-MS:m/z413.4 [M + Na]+;提示该化合物分子量为390。1H NMR(400 MHz,CD3OD)δH:6.73(2H,s, H-2′,6′),6.68(1H,s,H-2,6),5.50(1H,d,J= 6.4 Hz,H-7),3.85(3H,s,3′-OCH3),3.80(6H,s,3,5-OCH3),3.84(1H,m,H-9b),3.76(1H,m,H-9a),3.57(2H,m,H-9′),3.48(1H,m,H-8),2.62(2H,m,H-7′),1.81(2H,m,H-8′);13C NMR(100 MHz,CD3OD)δC:133.9(s,C-1),104.2(d,C-2,6),149.3(s,C-3,5),137.0(s,C-4,1′),89.1(d,C-7),55.5(d,C-8),65.0(t,C-9),56.8(q,3,5-OCH3),114.1(d, C-2′),145.2(s,C-3′),147.5(s,C-4′),129.8(s,C-5′),117.9(d,C-6′),32.9(t,C-7′),35.8(t,C-8′),62.2(t,C-9′),56.8(q,3′-OCH3)。以上数据与文献报道基本一致[15,16],故鉴定化合物4为5-methoxydehydroconiferyl alcohol。
2.2 体外人癌细胞毒活性测试
本实验对化合物1~4进行了细胞毒活性评价(见表 2),测试的人癌细胞株为MCF-7、HCT-116、HeLa和HepG2。在100 μmol/L浓度下进行初筛,化合物1和4无明显的细胞毒性,而化合物2和3表现出较强的细胞毒性。进一步对化合物2和3的细胞毒活性进行验证,实验结果表明化合物2和3对四种人癌细胞株均有较好的抑制生长活性,特别是对肝癌HepG2细胞的抑制活性最好,其IC50值分别达到34.19±5.44和22.52±3.91 μM。

表2 化合物1~4的细胞毒活性Table 2 Cytotoxicity of compounds 1~4
3 讨论与结论
由于国内外学者对中药青阳参的化学成分研究大多数集中于C21甾体苷类成分[3-5],因此忽略了对其次级苷、苷元或者其他类型成分研究,一定程度上限制了其资源再次利用和开发。对于含有丰富多样的糖链甾体苷类成分,国内外已有学者着重研究其次级苷或者苷元,比如通光藤[17]、徐长卿[18]、白首乌[6,19]和黑鳗藤[20],主要是利用酸催化水解方法,获得系列具有生物活性次级苷或者甾体苷元。基于文献成功的先例,本课题组前期采用酸水解催化方法处理青阳参根95%乙醇提取物,从中分离、鉴定了一系列结构新颖、具有抗肿瘤活性的C21甾体苷元[8]。此外,我们发现青阳参根的酸水解物中仍存在微量的其他类型成分。本实验是通过采用现代色谱学方法对青阳参根的酸水解物中其他类型成分进行分离、鉴定,从中发现了4个木脂素,其中化合物1为新的苯二氢化萘型木脂素。进一步通过MTT法实验显示化合物2和3具有一定程度细胞毒活性,特别是对肝癌HepG2细胞,其IC50分别为34.19±5.44和22.52±9.13 μM。因此,本实验得到的4个木脂素化合物均是首次从该属植物中发现的,虽然其有可能是天然产物的酸催化水解后产生的脱糖苷衍生物,但在一定程度上反映了青阳参植物中存在木脂素类成分,丰富了其化学结构类型,同时为青阳参的资源化利用提供理论基础,也为寻找新的生物活性天然产物提供新的思路和帮助。
