基于UPLC-QTOF-MS技术分析野生与栽培杨树桑黄的化学成分
2021-12-13昝立峰范宇光包海鹰图力古尔
昝立峰,范宇光,包海鹰,图力古尔,叶 嘉
1邯郸学院生命科学与工程学院,邯郸 056005;2海南医学院药学院,海口 571199;3吉林农业大学药用菌物资源及其开发利用重点研究室,长春 130118
杨树桑黄(Sanghuangporusvaninii(Ljub.) L.W.Zhou & Y.C.Dai)隶属于锈革孔菌科(Hymenochaetaceae)桑黄菌属(Sanghuangporus)的多年生大型药用真菌[1]。生长于山杨(Populusdavidiana)活立木、倒木及树桩上,主要分布于中国长白山和小兴安岭地区以及日本、朝鲜、韩国等东北亚国家[2]。杨树桑黄具有利五脏,软坚和胃,护肝益气之功效,临床上主治胃失和降,肝阳上亢,肾虚精亏。现代研究发现杨树桑黄具有良好的抗肿瘤、免疫调节、抗菌、抗氧化和保肝护肝等多种药理活性,从其子实体中分离得到麦角甾-4,6,8(14),22(23)-四烯-3-酮、樱花亭、二氢莰非素、7-甲氧基二氢莰非素、3,4,5-三羟基-7-甲氧基-二氢黄酮醇、4-(3,4-二羟苯基)-3-丁烯-2-酮、hispolon等麦角甾、黄酮、吡喃酮类活性成分[3-4]。
杨树桑黄是目前市场上主要商品化的“桑黄”物种,栽培技术较为成熟,其子实体栽培包括木段栽培和木屑代料栽培两种模式。有研究发现[5],木段和木屑代料栽培桑黄子实体提取物对肿瘤细胞增殖具有良好的抑制作用,且发现活性成分黄酮、多酚含量与肿瘤细胞增殖抑制和体外抗氧化能力趋势一致。Huo[6]研究发现杨树桑黄水提取物对小鼠各器官没有明显的毒副作用,主要成分为多糖、核苷酸、多酚类化合物,其中多酚为其主要活性成分。目前杨树桑黄子实体质量标准中仅包括总多糖、总酚及麦角甾醇的含量,而关于野生和不同栽培杨树桑黄子实体中活性指标成分的系统分析未见详细报道,同时桑黄中吡喃酮酚类成分易在分离过程中发生结构变化,不易准确鉴定其结构。超高效液相色谱-串联四级杆-飞行时间质谱(UPLC-QTOF-MS)技术兼具液相色谱的高效分离能力与质谱的高灵敏度、高检测能力,在药物有效成分分析、药效物质基础研究等方面具有独特的优势。本研究拟采用UPLC-QTOF-MS技术,根据化合物保留时间、分子离子峰及二级质谱裂解碎片并参照相关文献系统分析野生和栽培杨树桑黄子实体中的活性成分,旨在为进一步指导杨树桑黄开发及提升质量控制标准提供技术支持,同时为其药用功能研究奠定物质基础。
1 材料与方法
1.1 材料与试剂
野生杨树桑黄、栽培杨树桑黄子实体于2020年8月由海南医学院药学院范宇光博士提供并鉴定,3~8 ℃低温放置备用。
甲醇和甲酸为色谱级,购自美国Sigma公司,其余试剂为分析纯,实验用水为超纯水。Seplite AB-8型大孔吸附树脂购买于西安蓝晓科技有限公司。
1.2 仪器与设备
Acquity UPLC-G2 QTOF联用系统(Waters公司);Waters BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);N-1200B旋转蒸发仪(东京理化器械株式会社);Mill-Q Advantage A10超纯水仪(Millipore公司)。
1.3 方法
1.3.1 样品制备
杨树桑黄子实体粉碎至20~40目,称取粉末200 g,先采用正己烷在40 ℃脱脂3次,阴干后用80%的乙醇按料液比1∶7.5在45 ℃浸提3次,每次1.5 h,合并提取液并离心过滤,过滤液在温度为45~50 ℃减压浓缩为水混悬液,水混悬液采用大孔吸附树脂吸附分离纯化,85%乙醇解吸得到解吸液,解吸液减压蒸发浓缩后冷冻干燥得到粉末,分析前取适量用甲醇溶解并过0.22 μm滤膜,即得样品溶液。
1.3.2 色谱条件
色谱柱为Waters BEH C18(100 mm×2.1 mm,1.7 μm);流动相A为甲醇,B相为水溶液(含0.1%甲酸),流动相梯度洗脱过程如下:5%A(0~2 min),5%→100%A(2~30 min),100%A(30~35 min),100%→5%A(35~35.1 min),5%A(35.1~40 min);流速为0.3 mL/min;进样量为10 μL;柱温40 ℃。
1.3.3 质谱条件
电喷雾离子源(ESI)负离子模式扫描,扫描范围质荷比(m/z)50~1 200,毛细管电压为2 800 V,样品锥孔电压30 V,萃取锥孔电压1 V,离子源温度100 ℃,脱溶剂温度300 ℃,锥孔气50 L/h,脱溶剂气流速900 L/h。
2 结果与分析
2.1 杨树桑黄乙醇提取物分析
图1为杨树桑黄子实体乙醇提取物的UPLC-QTOF-MS离子流色谱图,从图中看出UPLC分离条件可以有效地将提取物中的活性成分分开,在UPLC-QTOF-MS条件下得到质谱图,从野生与栽培杨树桑黄子实体中共鉴定出40个化合物,包括小分子有机酸8个、儿茶素类化合物3个、吡喃酮20个、黄酮9个,其中野生和栽培子实体中共有成分14个,包括小分子有机酸3个、吡喃酮酚类物质11个,但各成分相对含量在野生和栽培子实体中差异明显,吡喃酮酚类物质在木屑栽培和木段栽培子实体中相对含量较高,且木屑栽培略高于木段栽培子实体;野生子实体中特有成分14个,包括小分子有机酸1个、儿茶素类3个、吡喃酮1个、黄酮9个,其中儿茶素类和黄酮类化合物仅在野生子实体中发现,而在两种栽培子实体中均未发现;栽培子实体中出现12种特有成分,8种为两种栽培子实体共有成分,4种为木屑栽培子实体中出现,主要为小分子有机酸和吡喃酮。小分子有机酸、儿茶素类、吡喃酮、黄酮化合物在ESI离子源负离子模式下主要产生[M-H]-准分子离子峰,具体信息见表1所示。

图1 杨树桑黄子实体提取物负离子模式下的离子基峰图Fig.1 The base peak ion (BPI) of the negative mode in extracts from S.vaninii 注:A:野生;B:木屑袋料栽培;C:木段栽培。Note: A: Wild fruiting body;B: Bag-cultivated fruiting body;C: Wood cultivated fruiting body.

表1 UPLC-QTOF-MS鉴定杨树桑黄提取物中的化合物Table 1 Identification of compounds from S.vaninii extracts by UPLC-QTOF-MS

续表1(Continued Tab.1)
2.2 化合物鉴定
2.2.1小分子有机酸
在负离子模式下,从野生与栽培杨树桑黄子实体中鉴定出小分子有机酸8个,二级质谱(MS/MS)主要通过失去羧基(COO-)得到特征碎片。
化合物1保留时间1.38 min,分子离子峰为m/z191.109 2[M-H]-,分子式为C6H8O7,MS/MS质谱中母离子裂解失去1分子羧基(44 Da)产生碎片m/z147.030 1[M-H-CO2]-,出峰保留时间较短,比较碎片信息,推测化合物为柠檬酸。
化合物2保留时间2.86 min,分子离子峰为m/z169.013 3 [M-H]-,分子式为C7H6O5。MS/MS质谱中通过母离子裂解失去1分子羧基(44 Da)产生特征碎片m/z125.024 2,确定为没食子酸,仅在野生子实体中出现。
化合物3保留时间2.90 min,分子离子峰为m/z242.976 5 [M-H]-,分子式为C8H4O9。MS/MS质谱中分子离子峰裂解分别失去3分子羧基(44 Da)产生碎片m/z198.986 4、154.997 5、111.007 2,在线查阅Chemical spider数据库,推测化合物为呋喃四羧酸,该化合物仅在木屑栽培子实体中出现。
化合物4、6保留时间分别为5.40、7.32 min,分子离子基峰分别为m/z153.018 5 [M-H]-和m/z137.023 8 [M-H]-,分子式分别为C7H6O4和C7H6O3,分子量相差16。MS/MS质谱中分别出现m/z109.030 2、108.021 9特征碎片,推测化合物通过裂解分别失去1分子羧基(44 Da)和1分子醛基(29 Da)得到特征碎片,参考文献[7]推测化合物4和6分别为原儿茶酸和原儿茶醛。
化合物5保留时间为6.44 min,仅在木屑栽培子实体质谱中检测到,分子离子峰为m/z209.007 5 [M-H]-,分子式为C9H6O6。MS/MS质谱中分子离子峰失去1分子羧基(44 Da)产生碎片m/z165.019 4,继续失去1分子羧基(44 Da)得到特征碎片m/z121.026 3,推测化合物为苯三甲酸。
化合物7保留时间8.09 min,分子离子峰为m/z198.987 0 [M-H]-,分子式为C7H4O7,MS/MS质谱中分别失去2分子羧基产生碎片m/z154.996 8、111.007 4,在线从Chemical spider和PubMed数据库查阅结构图,比较分析推测化合物为袂康酸。
化合物8保留时间10.47 min,栽培子实体中检测到分子离子峰为m/z179.034 5 [M-H]-、分子式为C9H8O4的化合物,MS/MS质谱失去1分子羧基得到碎片m/z135.043 8,参考文献[8]推测化合物为咖啡酸。
2.2.2 儿茶素类化合物
从野生杨树桑黄子实体提取物中鉴定出3个儿茶素类化合物,且出现多个同分异构现象,而在两种栽培子实体提取物中均未发现此类化合物。
化合物9保留时间为8.91、12.18 min,分子离子峰均为m/z289.071 4 [M-H]-,分子式为C15H14O6。MS/MS质谱中产生没食子酸特征碎片m/z169.014 3、125.023 0,推测其为同分异构体,根据化合物保留时间,并参考文献[9]推测化合物分别为儿茶素和表儿茶素。
化合物10保留时间为11.44、12.95 min,分子离子峰均为m/z457.077 0 [M-H]-,分子式为C22H18O11。MS/MS质谱中分子离子峰失去1分子没食子酰基(152 Da)产生碎片m/z305.062 6,而分子离子峰失去1分子没食子酸得到儿茶素碎片离子m/z289.070 6,同时产生m/z169.013 2特征碎片,儿茶素碎片离子进一步通过C环的1,4键断裂得到碎片m/z125.022 9,综合碎片裂解规律和保留时间并参考文献[9]鉴定为没食子儿茶素没食子酸酯和表没食子儿茶素没食子酸酯,其二级质谱图及裂解规律见图2所示。

图2 化合物10的二级质谱图及其裂解途径Fig.2 The MS2 spectrum and fragmentation pathway of compound 10 at negative ion mode
化合物11保留时间为14.97、15.89 min,分子离子峰为m/z441.083 0 [M-H]-,分子式为C22H18O10,与化合物10仅相差1分子羟基,MS/MS质谱同样产生m/z289.069 0、169.012 2、125.022 7碎片离子,推测化合物11为儿茶素没食子酸酯、表儿茶素没食子酸酯。
2.2.3 吡喃酮类化合物

化合物12保留时间13.80 min,分子离子峰为m/z423.069 7[M-H]-,元素组成分析化合物分子式为C22H16O9。MS/MS质谱中母离子失去1分子羧基(44 Da)产生碎片m/z379.081 1,母离子失去1分子咖啡酸产生碎片m/z243.029 9,母核离子发生裂解失去碎片C3H2O3得到特征碎片m/z159.043 0,参考文献[11]推测化合物为phellibaumin D。
化合物13保留时间14.20 min,分子离子峰为m/z177.055 5[M-H]-,分子式为C10H10O3。MS/MS质谱中母离子失去1分子羟基(16 Da)产生碎片m/z161.025 1,母离子失去碎片C2H3O(43Da)产生特征碎片m/z134.036 2,参考文献[12],推测化合物为4-(3,4-二羟基苯基)-3-丁烯-2-酮[4-(3,4-dihydroxyphenyl)-3-buten-2-one]。
化合物14保留时间14.72 min,分子离子峰为m/z288.996 4 [M-H]-,分子式为C13H6O8。MS/MS质谱中母离子失去1分子羧基(44 Da)产生特征碎片m/z245.012 0,进一步裂解失去2分子CO得到碎片m/z217.017 5、189.018 3,同时发现母离子失去2分子羟基得到碎片m/z257.052 5,参考文献[13]推测化合物为phelligridin J。
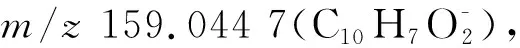
化合物16保留时间16.51 min,分子离子峰为m/z421.092 7 [M-H]-,分子式为C23H18O8。MS/MS质谱中母离子失去1分子羟基产生碎片m/z405.066 9 [M-OH]-,母离子失去1分子C2H2O离子得到碎片m/z379.083 4 [M-H-C2H2O]-,失去1分子二羟基苯乙烯离子得到碎片m/z285.030 4 [M-H-C8H8O2]-,分子离子峰失去1分子4-(3,4-二羟基苯基)-3-丁烯-2-酮得到hispidin特征碎片离子m/z243.027 4 [M-H-C10H10O3]-,hispidin母核离子进一步裂解产生碎片离子m/z217.049 5、159.044 1,参考文献[14]推测化合物为interfungin B。

化合物18保留时间18.86 min,分子离子峰为m/z463.104 5 [M-H]-,二倍分子离子峰为m/z927.213 9 [2M-H]-,分子式为C25H20O9。MS/MS质谱中产生hispidin特征碎片m/z243.029 3,推测化合物为hispidin衍生物,二级质谱产生碎片m/z405.059 0 [M-H3-CH3-CO-CH]-、379.082 1 [M-H-CH3-CO-CH-CO]-、259.060 8 [M-H-C6H5O2-C5H3O2]-、243.029 3 [M-H-C6H5O2-C6H7O2]-,hispidin母核进一步裂解产生碎片m/z217.050 2、159.044 5、135.044 4,根据二级质谱裂解规律并参考文献[16]推测化合物为davallialactone,裂解规律如图3所示。
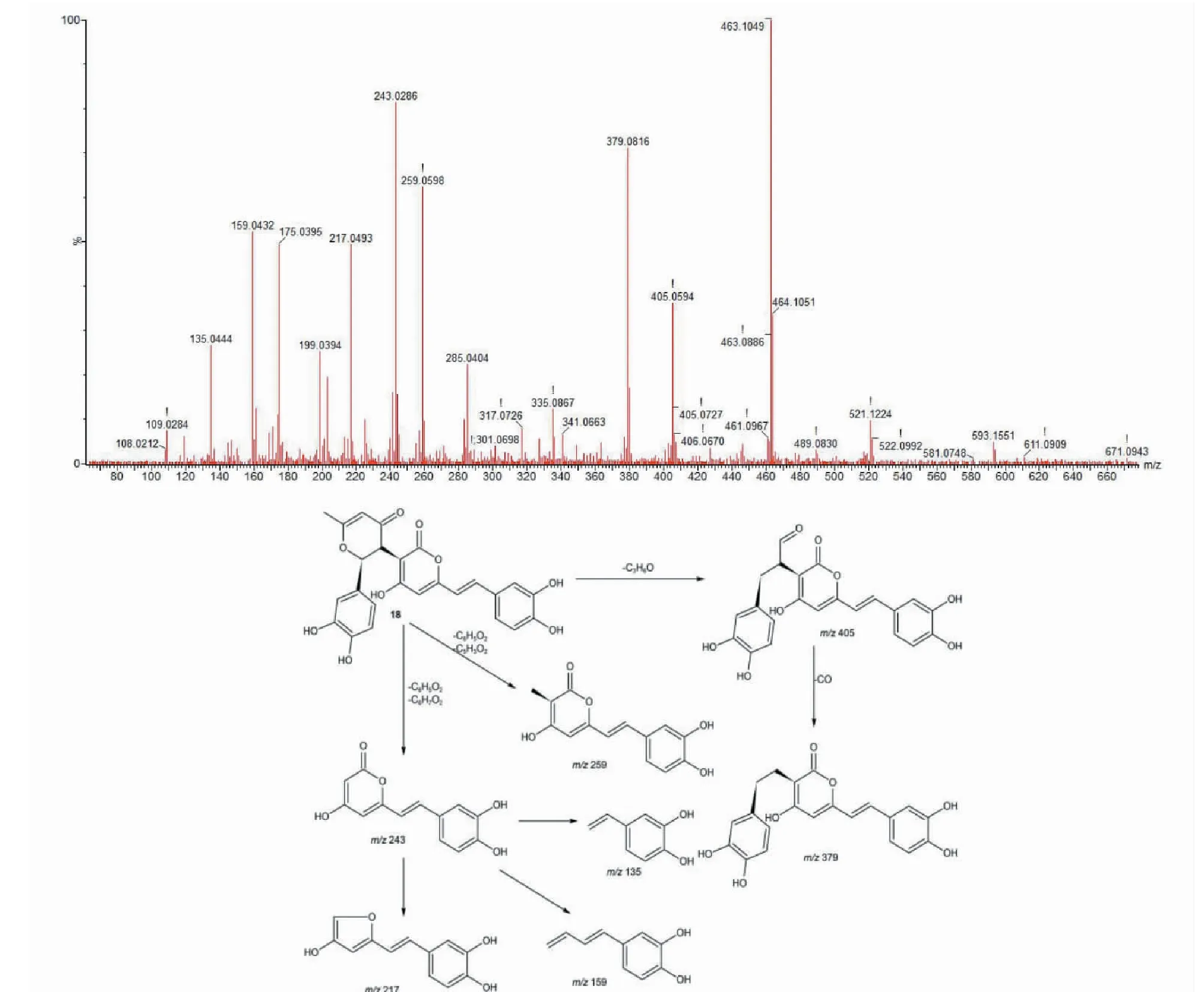
图3 化合物18的二级质谱图及其裂解途径Fig.3 The MS2 spectrum and fragmentation pathway of compound 18 at negative ion mode
化合物19保留时间18.93 min,分子离子峰为m/z521.112 9 [M-H]-,分子式为C27H22O11,一级质谱中出现m/z463.104 5 [M-H]-离子峰,推测化合物与davallialactone结构相似。MS/MS质谱中裂解碎片产生碎片m/z463.097 5、405.064 7、379.084 8、259.061 9、243.029 5、159.044 8、135.043 8,由裂解碎片可知m/z463.097 5碎片与分子离子峰分子量相差58(C2H2O2),参考文献[17]推测化合物为baumin。
化合物20保留时间21.80 min,分子离子峰为m/z423.165 3 [M-H]-,二倍分子离子峰为m/z847.333 4 [2M-H]-,分子式为C22H16O9。MS/MS质谱中裂解失去1分子咖啡酸产生特征碎片m/z243.029 7,吡喃酮母核裂解产生碎片m/z159.044 9、135.044 9,参考文献[11]推测化合物可能为phellibaumin B或D。
化合物21保留时间为23.10、24.66 min,分子离子峰均为m/z489.083 7 [M-H]-,二倍分子离子峰为m/z979.169 7 [2M-H]-,分子式为C26H18O10。MS/MS质谱中裂解产生碎片m/z445.093 1 [M-H-CO2]-、403.086 4 [M-H-C3H2O3]-、377.068 5 [M-H-C5H4O3]-、335.061 4 [M-H-C8H9O2-OH]-、241.049 9 [M-H-C8H9O2-C5H3O3]-,hispidin母核进一步裂解产生碎片m/z159.045 7、135.044 4,根据质谱裂解规律,参考文献[18]推测化合物为hypholomine B及其异构,裂解规律如图4所示。

图4 化合物21的二级质谱图及其裂解途径Fig.4 The MS2 spectrum and fragmentation pathway of compound 21 at negative ion mode
化合物22保留时间23.77、24.80 min,分子离子峰均为m/z461.088 3 [M-H]-,分子式为C25H18O9。MS/MS质谱中裂解产生碎片m/z377.065 6 [M-H-C4H4O2]-、243.026 6 [M-H-C12H10O4]-,吡喃酮母核裂解产生典型碎片m/z159.043 6、135.045 1,参考文献[19]推测化合物为inoscavin A及其异构体。
化合物23保留时间26.44 min,分子离子峰为m/z473.086 4 [M-H]-,分子式为C26H18O9。二级质谱分子离子峰失去1分子CO2产生碎片m/z429.096 3,分子离子峰裂解产生碎片m/z405.060 2 [M-H-C4H4O]-、283.057 8[M-H-C10H6O4]-、243.028 6[M-H-C13H10O4]-,得到hispidin母核进一步裂解产生碎片m/z217.048 1、159.044 6、135.046 8,参考文献[20]推测化合物为hypholomine A。
化合物24保留时间26.60 min,分子离子峰为m/z351.046 9 [M-H]-,分子式为C19H12O7。二级质谱分子离子峰裂解失去1分子二羟基苯(C6H4O2)产生特征碎片m/z243.029 6,特征碎片进一步裂解产生碎片m/z159.042 7、135.045 5,参考文献[11]推测化合物为phellibaumin A。
化合物25保留时间27.42 min,分子离子峰为m/z379.046 8 [M-H]-,分子式为C20H12O8。MS/MS质谱中裂解产生碎片m/z335.051 1 [M-H-CO2]-、269.003 4 [M-H-C6H6O2]-,分子离子峰失去1分子二羟基苯甲酸基得到特征碎片m/z243.026 6 [M-H-C8H7O3]-,特征碎片进一步裂解产生碎片m/z159.044 9、135.045 1,参考文献[21]推测化合物为phelligridin D。
化合物26保留时间28.13 min,分子离子峰为m/z477.121 8 [M-H]-,分子式为C26H22O9。MS/MS质谱中分子离子峰裂解失去1分子甲基和1分子氧产生碎片m/z446.094 0 [M-H-CH3O]-,失去1分子甲基和1分子异丙酮基得到碎片m/z405.057 2 [M-H-C3H5O-CH3]-,碎片继续失去1分子CO得到碎片m/z377.066 2,进一步裂解得到特征碎片m/z243.024 8,母核裂解产生碎片m/z159.045 7,参考文献[21]推测化合物为phelligridin F。
化合物27保留时间28.21 min,分子离子峰为m/z419.078 4 [M-H]-,分子式为C23H16O8。MS/MS质谱中裂解产生碎片m/z403.039 6 [M-H-OH]-、377.070 1 [M-H-C2H2O]-、283.058 4 [M-H-C7H4O3]-,分子离子峰失去1分子Hispolon得到特征碎片m/z243.028 3 [M-H-C10H8O3]-,特征碎片继续裂解产生碎片m/z159.044 3,根据二级质谱裂解碎片,参考文献[22]推测化合物为inoscavin C。
化合物28保留时间28.57 min,分子离子峰为m/z395.076 7 [M-H]-,分子式为C21H16O8。MS/MS质谱中裂解产生碎片m/z363.052 8 [M-H-2OH]-、285.043 5 [M-H-C6H6O2]-,母离子失去1分子甲基和1分子二羟基苯甲醛基得到特征碎片m/z243.028 4 [M-H-C8H6O3]-,母核继续裂解产生碎片m/z159.044 3、135.043 0,参考文献[22]推测化合物为inoscavin D。
化合物29保留时间28.68 min,分子离子峰为m/z623.082 9 [M-H]-,分子式为C33H20O13。MS/MS质谱中裂解产生碎片m/z579.078 8 [M-H-CO2]-、535.322 6 [M-H-2CO2]-、419.036 3 [M-H-C10H4O5]-,母离子失去1分子二羟基苯甲醛和1分子hispidin得到特征碎片m/z243.028 4 [M-H-C20H12O8]-,母核裂解产生碎片m/z159.044 3、135.043 0,参考文献[23]推测化合物为phelligridin I(inonoblin A)。
化合物30保留时间29.57 min,分子离子峰为m/z363.050 8 [M-H]-,分子式为C20H12O7。MS/MS质谱中裂解产生碎片m/z345.227 0 [M-H-OH]-、281.140 0 [M-H-C4H3O2]-、227.125 6 [M-H-C7H4O3]-、159.044 3[M-H-C23H12O11]-、135.043 0,根据裂解规律并参考文献[21]推测化合物为phelligridin C。
化合物31保留时间30.32 min,分子离子峰为m/z435.108 7 [M-H]-,分子式C24H20O8。MS/MS质谱中产生碎片m/z403.083 0[M-H-CH3-OH]-、273.073 2 [M-H-C9H6O3]-、243.028 9[M-H-C11H12O3]-、159.044 3、135.043 0,参考文献[22]推测化合物为inoscavin B。
2.2.4 黄酮类化合物
野生杨树桑黄中黄酮化合物主要是以柚皮素和二氢莰非素为母核的化合物及其衍生物,裂解规律相似,母核裂解产生黄酮典型碎片m/z151、119,而栽培杨树桑黄子实体中未发现典型黄酮化合物。
化合物32保留时间17.81 min,分子离子峰为m/z287.056 1 [M-H]-,元素组成分析分子式为C15H12O6,二级质谱中产生特征碎片m/z259.061 3 [M-H-CO]-,进一步失去1分子羟基得到碎片m/z243.029 6,母核进一步裂解产生碎片m/z151.001 6,参考文献[24]推测化合物为二氢莰非素。
化合物33保留时间23.98 min,分子离子峰m/z271.061 2 [M-H]-,分子式为C15H12O5,二倍分子量为543.128 8 [2M-H]-。二级质谱碎片失去1分子CO得到碎片离子m/z243.029 7,母核进一步裂解失去碎片离子C4H8O4和CH3OH,分别得到典型黄酮碎片离子m/z151.003 0、119.050 5,参考文献[24]推测其为柚皮素。
化合物34保留时间25.87、27.10 min,分子离子峰均为m/z301.0711 [M-H]-,分子式为C16H14O6。二级质谱由分子离子失去1分子CH3产生碎片离子m/z285.038 7,母离子失去1分子CO产生特征碎片离子m/z273.076 3,母离子进一步裂解产生黄酮裂解产生的典型碎片m/z178.996 1、151.001 4,参考文献[20]推测其为橙皮素及其异构体7-甲基圣草酚。
化合物35保留时间27.78 min,分子离子峰m/z393.096 0 [M-H]-,分子式为C22H18O7,二级质谱由分子离子峰失去1分子邻羟基甲苯(C7H6O-)得到碎片m/z287.054 2,母核离子分别失去1分子CO和1分子CO2得到碎片离子m/z259.060 7、243.026 9,母核离子进一步裂解得到典型黄酮碎片离子m/z151.002 8、119.049 3,参考文献[11]中报道桑黄子实体中出现的二羟基甲苯基团均为邻羟基甲苯,由此推测化合物可能为3,5,7-trihydroxy-6-(2-hydroxybenzyl)-2-(4-hydroxyphenyl)-2,3-dihydro-4H-chromen-4-one(phelligrin D)。
化合物36保留时间29.82 min,野生子实体中出现的最强离子峰,分子离子峰为m/z285.076 5 [M-H]-,分子式为C16H14O5,二级质谱由分子离子峰失去1分子甲基得到碎片m/z271.060 6,母核离子继续失去1分子CO得到碎片离子m/z243.027 2,分子离子峰裂解失去C4H8O4得到碎片m/z165.017 2,母核离子继续裂解产生典型黄酮碎片离子m/z151.002 4、119.049 4,参考文献[24]推测其为樱花亭。
化合物37保留时间32.62 min,分子离子峰m/z377.104 5 [M-H]-,分子式为C22H18O6,二级质谱由分子离子峰失去1分子邻羟基苯得到碎片m/z283.060 3,母离子失去1分子邻羟基甲苯得到碎片m/z271.061 4,母核离子裂解产生典型黄酮碎片离子m/z151.002 7、119.049 3,参考文献[11]推测其为phelligrin A或B。
化合物38保留时间32.84、33.42 min,分子离子峰均为m/z391.118 9 [M-H]-,分子式为C23H20O6,推测其为同分异构体,该化合物与化合物37仅相差1分子甲基,同时二级质谱裂解产生碎片与phelligrin A或B基本一致,参考文献[11]推测化合物为methylphelligrin A或B。
化合物39保留时间33.54 min,分子离子峰m/z499.139 3[M-H]-,分子式为C29H24O8,与化合物35分子量相差106(C7H6O),即推测与化合物35相差1分子邻羟基甲苯,二级质谱裂解规律与化合物35基本相似,产生典型黄酮碎片,推测化合物为3,5,7-trihydroxy-6,8-bis(2-hydroxybenzyl)-2-(4-hydroxyphenyl)-2,3-dihydro-4H-chromen-4-one(phelligrin E)。
化合物40保留时间为37.10 min,分子离子峰为m/z483.143 3 [M-H]-,分子式为C29H24O7,该化合物与化合物37分子量相差106,即推测可能相差为1分子邻羟基甲苯,同时二级质谱裂解产生碎片与phelligrin A或B基本一致,参考文献[11]推测化合物为5,7-dihydroxy-6,8-bis(2-hydroxybenzyl)-2-(4-hydroxyphenyl)-2,3-dihydro-4H-chromen-4-one(phelligrin C),化合物二级质谱图及裂解规律如图5所示。

图5 化合物40的二级质谱图及其裂解途径Fig.5 The MS2 spectrum and fragmentation pathway (right) of compound 40 at negative ion mode
3 结论
本研究采用超高效液相色谱-四级杆-飞行时间质谱(UPLC-QTOF-MS)对野生和栽培杨树桑黄子实体乙醇提取物中的化学成分进行系统分析,桑黄中多酚、黄酮化合物含有多个酚羟基,呈酸性,在负离子模式下具有较高的离子化效率,因此选择负离子模式并结合相关文献对其成分结构进行推测,结果从野生和栽培杨树桑黄子实体乙醇提取物中鉴定出小分子有机酸8个、儿茶素类3个、吡喃酮类20个、黄酮9个,其中phelligrins C~E 3个黄酮化合物推测可能为新化合物,均为phelligrin A或B的同系物,准确结构还需进一步鉴定。野生和栽培子实体中共有成分14个,其中11个为吡喃酮酚类成分。
分析结果显示野生杨树桑黄子实体中含有丰富的黄酮、儿茶素类和吡喃酮类化合物,且出现多个同分异构现象,而栽培桑黄子实体中主要是吡喃酮和小分子有机酸化合物,均未发现典型黄酮及儿茶素类化合物,结合文献[5]报道的总酚含量与肿瘤细胞增殖抑制和体外抗氧化能力趋势一致,且栽培子实体的活性高于野生子实体,本次UPLC-QTOF-MS分析结果显示栽培子实体中吡喃酮酚类物质的相对峰面积明显高于野生子实体,且木屑栽培略高于木段栽培子实体,综合分析认为吡喃酮酚类化合物是野生和栽培子实体中的主要活性成分之一,主要包括化合物hispidin和4-(3,4-二羟基苯基)-3-丁烯-2-酮、phelligridimer A、davallialactone、hypholomine B、inoscavin A和B,且化合物davallialactone和hypholomine B在杨树桑黄子实体中含量较高,表现出良好的抗氧化、肿瘤细胞增殖抑制和降血糖活性[25,26]。在杨树桑黄子实体质量标准制定中建议将总酚含量结合吡喃酮化合物davallialactone和hypholomine B作为质量标准的指标成分,完善桑黄的质量标准控制体系。本研究可以为杨树桑黄子实体的质量标准提升和功能研究奠定了理论基础。
