金枪鱼加工副产物的生物转化工艺研究
2021-12-13关平彦杨凌杰闻正顺蔡祥敏
关平彦,夏 磊,杨凌杰,闻正顺,,蔡祥敏
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.舟山市农产品质量安全管理中心,浙江舟山 316021;3.宁波诚元海洋生物科技有限公司,浙江象山 315700)
以海产品的下脚料为原料生产的发酵食品主要有各种海鲜调味料和饲料[1]。低值鱼富含蛋白、氨基酸、小分子肽等多种活性矿物质,蛋白含量平均为16%,是制造海鲜调味品的最好原料,目前我国低值鱼的出肉率只有35%左右,而废弃物却高达65%左右[2],由于人们对海产品的需求量增大,大量的海产品下脚料被抛弃或低值处理,造成了蛋白质及具备相关活性氨基酸的浪费,也造成了污染问题。我国海产品的下脚料为原料,主要生产海鲜汁,海鲜调味品。
海洋功能性食品是以海洋生物为资源而开发的食品,在优化食品风味的同时提高了食品中氨基酸,蛋白质,不饱和脂肪酸,多糖,膳食纤维,维生素,矿物质等的生理活性效能[3]。
目前市场上有鱼蛋白,鱼粉,鱼棒和鱼肝油。所以发酵鱼类等海洋生物下脚料有很大的利用空间和市场价值[4]。同时发酵金枪鱼下脚料经过脱腥后经过美拉德反应后可以用于生产金枪鱼骨汁饮料[5]。加入一定比例食品配料及食品风味添加剂后可以用于加工生产猫粮等宠物食品[6]。
1 材料与方法
1.1 材料与试剂
1.1.1 发酵用乳酸菌及培养基
乳酸菌是由徐州益邦环保科技有限公司提供,该乳酸菌是嗜热链球菌和保加利亚乳杆菌混合菌,我们又进一步筛选分离,对分离得到的嗜热链球菌及保加利亚乳杆菌分别进行传代培养保存。培养基为MRS肉汤培养基,主要成分含牛肉浸粉,酵母浸粉,蛋白胨,葡萄糖,磷酸氢二钾,柠檬酸三铵,乙酸钠,硫酸锰,硫酸镁,吐温。
1.1.2 发酵用酵母菌及培养基
酵母菌是由湖北宜昌安琪酵母有限公司提供,培养基为LB 肉汤培养基,主要成分含酵母浸粉,胰蛋白胨,氯化钠。
1.1.3 酶解所用酶种类
购于上海瑞永生物科技有限公司,胰蛋白酶(猪胰)比活≥250 U·mg-1,风味蛋白酶比活≥40 U·g-1,中性蛋白酶比活≥50 U·g-1。
1.1.4 原料及试剂
实验用原料为购舟山水产市场的金枪鱼下脚料。
实验试剂:酒石酸钾钠、NaOH、Na2CO3、无水CuSO4等试剂,均为分析纯。
1.2 仪器与设备
FA1004 分析天平,上海民桥精密科学仪器有限公司;DGG-9140A 型电热鼓风恒温干燥箱,上海森信实验仪器有限公司;WF-180E 超UV-1600 型紫外分光光度计,上海美谱达仪器有限公司;HH-2 数显恒温水浴锅,国华电器有限公司;THZ-8 气浴恒温振荡器,金坛市医疗仪器厂;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;YC-260 L 4 ℃冰箱,LG 电子有限公司;TD5K 离心机,长沙湘智离心机仪器有限公司;SW-CJ-2F 双人双面超净工作台,苏州净化设备有限公司;ULUP 超纯水机,杭州科晓化工仪器设备有限公司。
1.3 试验方法
1.3.1 酶解工艺
金枪鱼下脚料购买后用粉碎机粉碎,在121 ℃下20 min 灭菌,贮存于-20 ℃冰箱中。称取2.0 g 下脚料,按1:5 的料液比加入无菌水,分别在最适酶解温度下,按酶活比呈梯度加入胰蛋白酶,风味蛋白酶,中性蛋白酶,酶解后利用福林酚法[7]测定发酵液中可溶性蛋白的含量,并计算出结果。
胰蛋白酶按酶活比6 000,7 000,8 000,9 000,10 000 U·g-1加入,不同添加量下设计3 组平行,留1组空白对照,酶解温度37 ℃,料液比1:5,金枪鱼下脚料用量2 g,酶解时间5 h,考察加酶量对酶解效果的影响。
风味蛋白酶按酶活比6 000,7 000,8 000,9 000,10 000 U·g-1加入,不同添加量下设计3 组平行,留1组空白对照,酶解温度50 ℃,料液比1:5,金枪鱼下脚料用量2 g,酶解时间5 h,考察加酶量对酶解效果的影响。
中性蛋白酶按酶活比6 000,7 000,8 000,9 000,10 000 U·g-1加入,不同添加量下设计3 组平行,留1组空白对照,酶解温度55 ℃,料液比1:5,金枪鱼下脚料用量2 g,酶解时间5 h,考察加酶量对酶解效果的影响。
1.3.2 发酵工艺
称取2.0 g 下脚料,然后按1:5 的料液比加入无菌水,再接种不同浓度梯度的嗜热链球菌,保加利亚乳杆菌,酵母菌,分天数发酵,利用福林酚法测定发酵液中可溶性蛋白的含量,并计算出结果,逐天记录。
酵母菌、保加利亚乳杆菌、嗜热链球菌接种量分别分组10%,20%,30%,40%,50%料液比1:5,发酵温度为37 ℃,将发酵时间设为1、2、3、4、5、6 d,考察发酵时间对发酵效果的影响。
1.4 检测指标及方法
1.4.1 可溶性蛋白含量测定
用Folin-酚法[7]进行发酵结果的测定。
标准曲线的制作:取7 支干净的试管,每管中分别加入标准品溶液0、0.05、0.1、0.2、0.3、0.4、0.5 mL。然后补水至0.5 mL,再在每根试管中先用移液枪吸取2.5 mL 福林酚甲试剂,振荡,于室温中静置10 min,然后再用移液枪加入0.25 mL 福林酚乙试剂,振荡,溶液变成深蓝色。室温静置1 h 后在酶标仪750 nm 下测定吸光度值,X 轴为牛血清蛋白浓度,Y 轴为吸光度值,绘制标准曲线,吸光度值计算公式为:

1.4.2 可溶性蛋白转化率测定
用氨基态氮测定法[8]对可溶性蛋白转化率进行测定。可溶性蛋白转化率计算公式为:

式中:M 为蛋白转化率;Y 为发酵前可溶性蛋白含量,mg·mL-1;X 为发酵后可溶性蛋白含量,mg·mL-1;N 为发酵原料总蛋白含量,mg·mL-1。
2 结果与讨论
2.1 酶解过程中金枪鱼下脚料可溶性蛋白转化率变化
2.1.1 空白组
2.1.1.1 空白组氨基态氮含量
NaOH 加入量0.88 mL,氨基态氮含量0.061 6 g·mL-1。
2.1.1.2 空白组可溶性蛋白含量
750 nm 下吸光度值0.566,可溶性蛋白含量0.915 mg·mL-1。
2.1.2 胰蛋白酶解组
胰蛋白酶解组氨基态氮含量,蛋白含量,蛋白转化率平均值及显著性如表1。
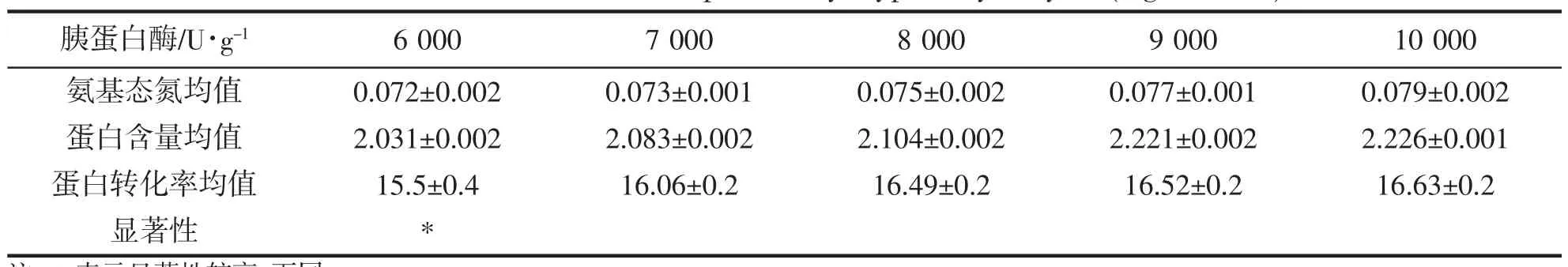
表1 胰蛋白酶解组可溶性蛋白转化率(mg·mL-1,%)Tab.1 Conversion of soluble protein by trypsin hydrolysis (mg·mL-1,%)
2 g 金枪鱼下脚料料液比1:5 时,在37 ℃下随着胰蛋白酶添加量的增加可溶性蛋白转化率不断提高,添加量在接近比活10 000 U·g-1时,可溶性蛋白转化率趋于稳定。胰蛋白酶添加量越低,显著性越高。
2.1.3 风味蛋白酶解组
风味蛋白酶解组氨基态氮含量,蛋白含量,蛋白转化率平均值及显著性如表2。
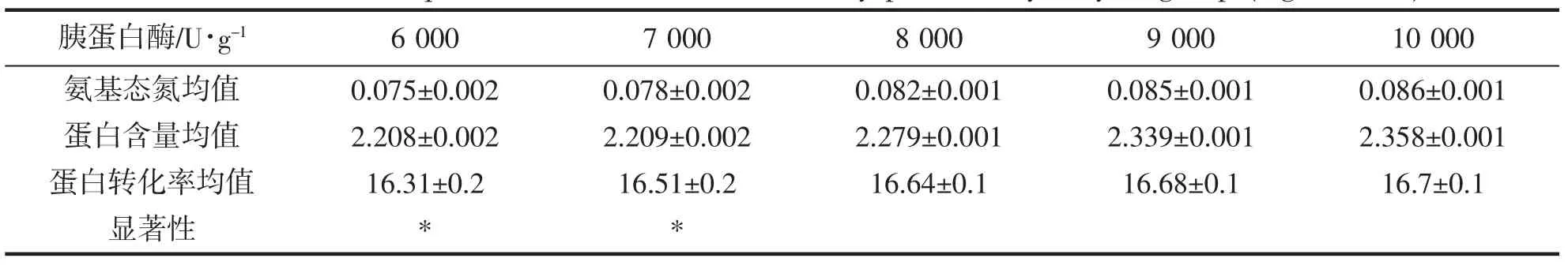
表2 风味蛋白酶解组可溶性蛋白转化率(mg·mL-1,%)Tab.2 The soluble protein conversion rate of savory protease hydrolysis group (mg·mL-1,%)
2 g 金枪鱼下脚料料液比1:5 时,在50 ℃酶解温度下随着风味蛋白酶添加量的增加可溶性蛋白转化率不断提高,添加量在接近比活10 000 U·g-1时,可溶性蛋白转化率趋于稳定。风味蛋白酶在添加量6 000 U·g-1,7 000 U·g-1时,显著性相对较高。
2.1.4 中性蛋白酶解组
中性蛋白酶解组氨基态氮含量,蛋白含量,蛋白转化率平均值及显著性如表3。

表3 中性蛋白酶解组可溶性蛋白转化率Tab.3 The soluble protein conversion rate of neutral protease hydrolysis group(%)
2 g 金枪鱼下脚料料液比1:5 时,在55 ℃酶解温度下随着中性蛋白酶添加量的增加可溶性蛋白转化率不断提高,添加量在接近比活10 000 U·g-1时,可溶性蛋白转化率趋于稳定。中性蛋白酶解组在添加量6 000 U·g-1时,显著性较高。
2.2 发酵过程中金枪鱼下脚料可溶性蛋白转化率变化
2.2.1 酵母菌发酵组
酵母菌发酵组氨基态氮含量如表4 所示。

表4 酵母菌发酵组氨基态氮含量Tab.4 Amino nitrogen content in yeast fermentation
在酵母菌接种量为10%时,随着发酵天数的增加,蛋白转化率不断提高,发酵4 d 后,显著性提高,蛋白转化开始降低(表5)。

表5 酵母菌10%蛋白转化率(mg·mL-1,%)Tab.5 Protein conversion rate of 10% of yeast(mg·mL-1,%)
酵母菌接种量20%,OD 均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表6 所示。在酵母菌接种量为20%时,第1~2 天,蛋白转化率升高比较明显,发酵第5 天后,显著性较高,蛋白转化率达到最大值,随后开始降低。

表6 酵母菌20%蛋白转化率(mg·mL-1,%)Tab.6 Protein conversion rate of 20% of yeast(mg·mL-1,%)
酵母菌接种量30%,OD 均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表7 所示。在酵母菌接种量为30%时,第3 至5 天,蛋白转化率升高比较明显,发酵第5 天后,显著性提高,蛋白转化率达到最大值,随后开始降低。
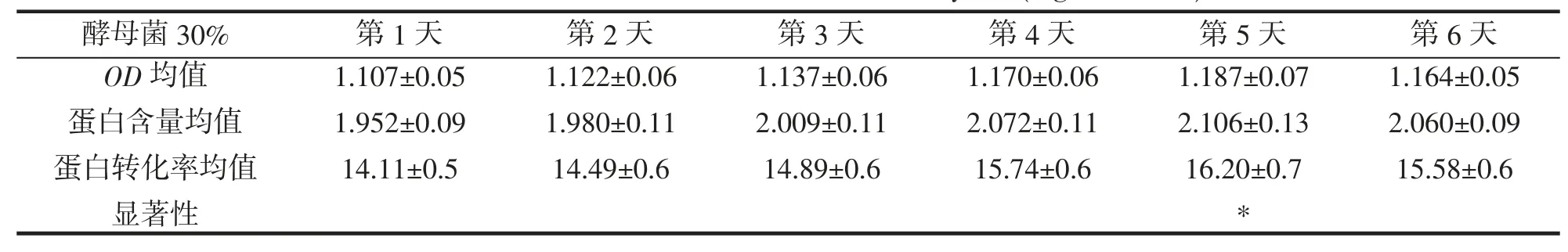
表7 酵母菌30%蛋白转化率(mg·mL-1,%)Tab.7 Protein conversion rate of 30% of yeast(mg·mL-1,%)
酵母菌接种量40%,OD 均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表8 所示。在酵母菌接种量为40%时,随着发酵天数的增加蛋白转化率逐渐升高,发酵第5 天后,显著性提高,蛋白转化率达到最大值,随后开始降低。
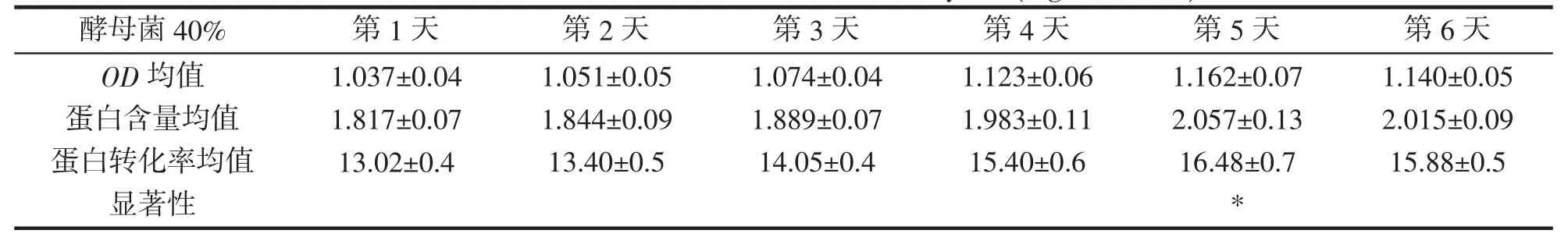
表8 酵母菌40%蛋白转化率(mg·mL-1,%)Tab.8 Protein conversion rate of 40% of yeast(mg·mL-1,%)
酵母菌接种量50%,OD 均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表9 所示。

表9 酵母菌50%蛋白转化率(mg·mL-1,%)Tab.9 Protein conversion rate of 50% of yeast(mg·mL-1,%)
在酵母菌接种量为50%时,前3 天蛋白转化率升高比较明显,第3 天蛋白转化率达到最大值,显著性较高,第3 天至第4 天蛋白转化率降低比较明显,随后蛋白转化率逐渐降低。
2.2.2 保加利亚乳杆菌发酵组
保加利亚乳杆菌发酵组氨基态氮含量如表10 所示。
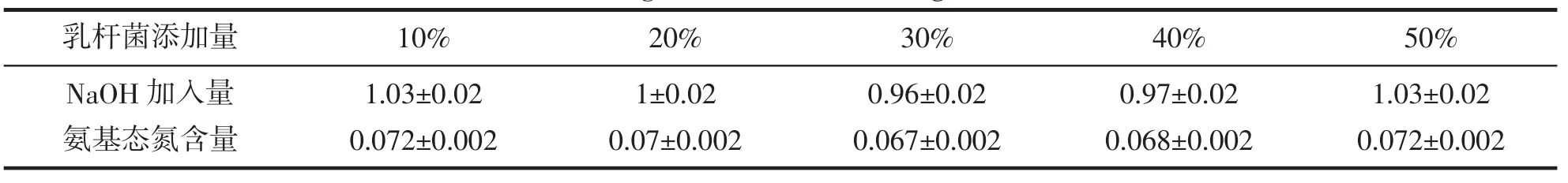
表10 保加利亚乳杆菌发酵组氨基态氮含量Tab.10 Amino nitrogen content in L.bulgaricus fermentation
保加利亚乳杆菌接种量10%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表11 所示。在保加利亚乳杆菌接种量10%时,随着天数的增加蛋白转化率不断提高,第5 天显著性提高,蛋白转化率达到最高,随后开始降低。

表11 保加利亚乳杆菌10%蛋白转化率(mg·mL-1,%)Tab.11 10% protein conversion rate of L.bulgaricus(mg·mL-1,%)
保加利亚乳杆菌接种量20%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表12 所示。在保加利亚乳杆菌接种量20%时,随着天数的增加蛋白转化率不断提高,第5 天显著性提高,蛋白转化率达到最高,随后开始降低。
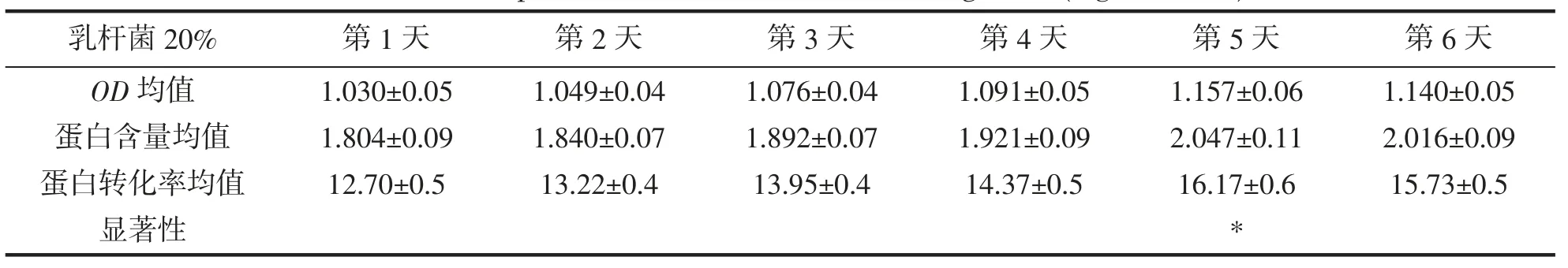
表12 保加利亚乳杆菌20%蛋白转化率(mg·mL-1,%)Tab.12 20% protein conversion rate of L.bulgaricus(mg·mL-1,%)
保加利亚乳杆菌接种量30%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表13 所示。在保加利亚乳杆菌接种量30%时,随着天数的增加蛋白转化率不断提高,第5 天显著性提高,蛋白转化率达到最高,随后开始降低。

表13 保加利亚乳杆菌30%蛋白转化率(mg·mL-1,%)Tab.13 30% protein conversion rate of L.bulgaricus(mg·mL-1,%)
保加利亚乳杆菌接种量40%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表14 所示。在保加利亚乳杆菌接种量40%时,第1 至第4 天蛋白转化率升高速度较快,第4 天蛋白转化率达到最高,显著性较为明显,随后开始降低。
保加利亚乳杆菌接种量50%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表15 所示。在保加利亚乳杆菌接种量50%时,第1 至第3 天蛋白转化率升高速度较快,第3 天显著性提高,蛋白转化率达到最高,之后开始降低。

表15 保加利亚乳杆菌50%蛋白转化率(mg·mL-1,%)Tab.15 50% protein conversion rate of L.bulgaricus(mg·mL-1,%)
2.2.3 嗜热链球菌发酵组
嗜热链球菌发酵组氨基态氮含量如表16 所示。
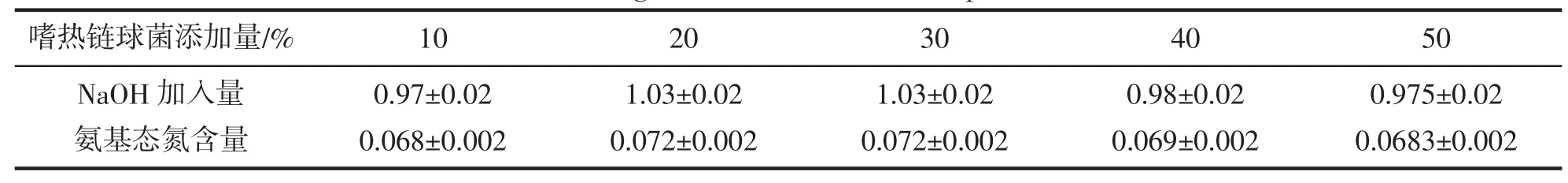
表16 嗜热链球菌发酵组氨基态氮含量Tab.16 Amino nitrogen content of S.thermophilus fermentation
嗜热链球菌接种量10%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表17 所示。在嗜热链球菌接种量10%时,第1 至第5 天蛋白转化率逐渐升高,第5 天显著性提高蛋白转化率达到最高,之后开始降低。
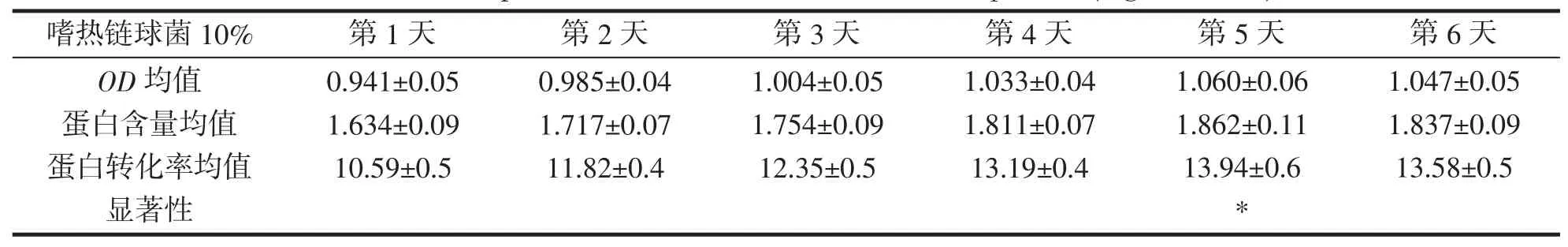
表17 嗜热链球菌10%蛋白转化率(mg·mL-1,%)Tab.17 10% protein conversion rate of S.thermophilus (mg·mL-1,%)
嗜热链球菌接种量20%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表18 所示。在嗜热链球菌接种量20%时,第2 天至第3 天蛋白转化率升高较快,第5 天显著性提高蛋白转化率达到最高,之后开始降低。
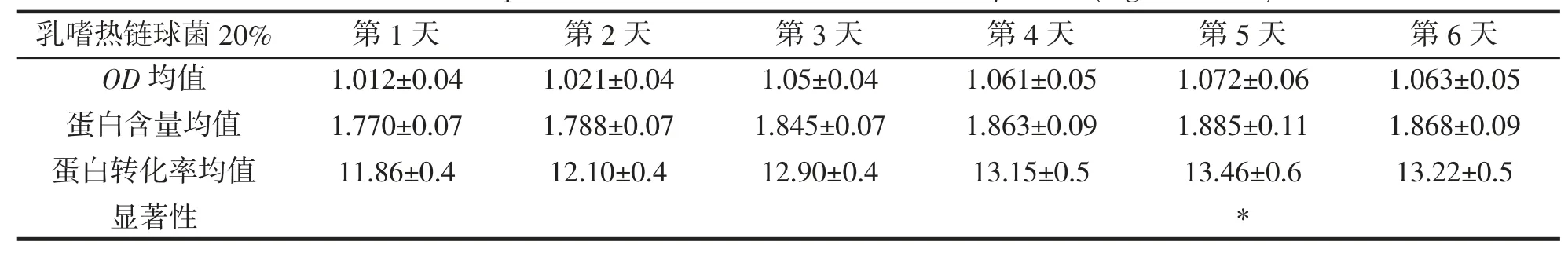
表18 嗜热链球菌20%蛋白转化率(mg·mL-1,%)Tab.18 20% protein conversion rate of S.thermophilus (mg·mL-1,%)
嗜热链球菌接种量30%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表19 所示。在嗜热链球菌接种量30%时,接种后从第1 天开始蛋白转化率逐渐升高,第5 天显著性提高蛋白转化率达到最高,之后开始降低。

表19 嗜热链球菌30%蛋白转化率(mg·mL-1,%)Tab.19 30% protein conversion rate of S.thermophilus (mg·mL-1,%)
嗜热链球菌接种量40%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表20 所示。在嗜热链球菌接种量40%时,接种后从第1 天至第3 天蛋白转化率升高较快,第3 天显著性较高,蛋白转化率达到最高,随后开始降低。

表20 嗜热链球菌40%蛋白转化率(mg·mL-1,%)Tab.20 40% protein conversion rate of S.thermophilus(mg·mL-1,%)
嗜热链球菌接种量50%,OD均值,蛋白含量均值,蛋白转化率均值,显著性,结果如表21 所示。在嗜热链球菌接种量50%时,接种后从第1 天至第3 天蛋白转化率升高较快,第3 天显著性提高蛋白转化率达到最高,随后蛋白转化率开始降低。

表21 嗜热链球菌50%蛋白转化率(mg·mL-1,%)Tab.21 50% protein conversion rate of S.thermophilus(mg·mL-1,%)
2.3 讨论
金枪鱼下脚料在酶解过程中,在蛋白酶的作用下会酶解成氨基酸小分子肽等物质[9],导致可溶性蛋白转化率提高,随着蛋白酶添加量的提高,蛋白转化率逐渐提高,蛋白酶添加量超过8 000 U·g-1后,转化率升高速度趋于平稳,分析可能达到酶解过程中蛋白酶转化率的最大值。风味蛋白酶转化率最大值16.79%,胰蛋白酶转化率最大值16.63%,中性蛋白酶转化率最大值16.57%。风味蛋白酶酶解效果优于胰蛋白酶优于中性蛋白酶。王雨生等[10]为了从金枪鱼皮制备胶原蛋白肽,从木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶中筛选出金枪鱼皮酶解的最佳蛋白是风味蛋白酶。
在接种菌发酵过程中,初始阶段随着发酵天数的增加可溶蛋白转化率逐渐提高,后随着发酵过程的进行,发酵用底料到达菌落总数最大值,部分菌落开始死亡,可溶蛋白转化率开始降低。发酵过程可溶蛋白转化率随着接种量的提高,有个先升高再降低的过程,分析加菌量过多,可能导致菌落更早到达菌落总数最大值。章新[11]乳酸菌与酵母菌发酵作用不同程度上都对鱼有脱腥作用,与对照组比较,其鱼腥味明显降低,表现出来的脱腥风味可能与其发酵产生的产物不同引起的。
棘怀飞等[12]发现美拉德反应对金枪鱼红肉酶解液的挥发性物质和游离氨基酸的组成及含量均有不同程度的影响。后续实验可以以可溶性蛋白转化率为指标检测美拉德反应对蛋白含量的影响,通过美拉德反应释放的特殊气味探索酶解发酵脱腥工艺。
3 结论
通过对实验数据进行分析在金枪鱼下脚料添加量为2 g,料液比1:5 时,酶解过程风味蛋白酶转化率最大值16.79%,胰蛋白酶转化率最大值16.63%,中性蛋白酶转化率最大值16.57%。发酵过程中,酵母菌接种量40%在发酵第5 天时,蛋白转化率出现最大值为16.48%,酵母菌随着接种量的升高,蛋白转化率也随之升高,接种量超过40%后,蛋白转化率升高不再明显。保加利亚乳杆菌接种量30%在发酵第5 天时,蛋白转化率出现最大值16.98%,保加利亚乳杆菌接种量30%,蛋白转化率升高比较明显,发酵效果比较好,后随着接种量的提高,蛋白转化率开始降低。嗜热链球菌接种量30%在发酵第5 天时,蛋白转化率出现最大值15.77%,嗜热链球菌随着接种量的提高,蛋白转化率开始提高,在接种量30%时,蛋白转化率比较好,之后随着接种量的提高转化率开始降低。酵母菌类最适接种量40%,乳酸菌类最适接种量30%。
酶解及发酵过程,分别能使蛋白转化率提高,提高金枪鱼下脚料等低值海产品加工副产物的利用率[13],在不同加酶量及接种量条件,不同接种时间下可溶蛋白转化率发生变化。后续可以通过菌酶联合实验,找到进一步提高可溶蛋白转化率的方式。同时酶解发酵产生的小分子肽具有丰富的营养价值,又有防病抗病等多种功能[14]。肽制剂可能成为继维生素、氨基酸之后在饲料中又一种必不可少的添加物。通过相关实验去除金枪鱼下脚料等低值海洋产品加工副产物的腥味,发酵金枪鱼汁饮料及宠物食品很有潜力和价值。
