鱼类肌肉组织18S rRNA 降解变化与死亡时间的关联性
2021-12-13杨阿敏李彦彦叶浩达王亚军严小军
杨阿敏,李彦彦,叶浩达,王亚军,严小军,陶 震
(1.浙江海洋大学水产学院,浙江舟山 316022;2.宁波大学海洋学院,浙江宁波 315211)
自我国实施了海洋伏季休渔制度以来,如何确定市售鱼类的死亡时间已成为了执法部门面临的一个难题。虽然鱼类死后,鱼体组织会发生形态、物理特征及化合物水平的变化,但目前尚未建立一些适用于鱼类死亡时间推断的检测指标。因此,寻找稳定、灵敏的检测指标是建立死亡时间确定方法的重点之一。
近年来,多项研究表明RNA 在法医学死亡时间推断中具有应用价值。例如,李文灿等[1]利用实时定量PCR(RT-qPCR)方法检测死后大鼠心肌组织中RNA 分子的含量变化,发现18s 与microRNA 分子miR-1-2d 的循环数阈值(Ct)的差值(ΔCt)与死亡时间存在相关性。朱怡等[2]采用类似的RT-qPCR 对RNA 分子进行定量分析,认为脑组织中β-actin mRNA 和18s 的时序性降解与死亡时间存在较好的相关性。INOUE,et al[3]采用类似的策略,检测了死后大鼠肝、心、肺组织中28S 核糖体RNA(28s)、18s 的变化规律,发现降解与时间呈线性关系,但降解速率存在组织特异性,这可能主要受组织内源性核糖核酸酶(RNase)酶活水平的影响[4]。这些研究揭示组织中的RNA 在一定环境条件下的变化具有一定规律性,组织内的RNase 酶活水平是决定其RNA 降解速率最重要的因素之一。这些发现成为了采用RNA 的时序性降解进行死亡时间推断的理论基础[5-7]。受这些研究的启发,本研究采用模式物种斑马鱼Danio rerio 为实验对象,在实验室内模拟鱼类在冷藏保存(0~1 ℃)过程中,分析鱼类肌肉组织中18s 降解规律,并建立了基于肌肉组织中18s 特定片长降解产物的丰度作为检测指标,推测冷藏条件下鱼类贮存时间的方法原型。
1 材料与方法
1.1 实验动物
实验所用斑马鱼来自于实验室所养殖的斑马鱼,体长4~5 cm。养殖系统水温维持在(22±1) ℃。
1.2 试剂与仪器
主要试剂:2×Es TapMasterMix (Dye)、DL 5 000 DNA Marker、DL 1 000 DNA Marker 购自Takara 公司、Regular AGAROSE G-10 购自Biowest 公司、(Ambion) TRIzolReagent 试剂盒购自上海玉博生物科技有限公司、逆转录试剂盒HiScriptII Q RT SuperMix for qPCR (+gDNA wiper)购自南京诺唯赞生物科技有限公司。
主要仪器:BIO-RAD C1 000 Thermal Cycler PCR 扩增仪、SIGMA 1-16K 低温高速离心机、Thermo NANODROP 1 000 型核酸蛋白测定仪、北京六一DYY-6C 型电泳仪电源。
1.3 实验设计及样品采集
实验采用斑马鱼作为研究对象进行死亡时间估测方法的设计和初步验证。预实验中所用斑马鱼先经麻醉,去除鱼皮后取背部两侧(侧线以上)的肌肉,并迅速转移至0 ℃条件下进行处理。取样时间为1~14 d,每相隔1 d 取样1 次,各时间组均包含3 个生物学重复。所有实验样品经低温保存处理结束后,同时取肌肉组织30 mg,用于总RNA 的提取,并以新鲜斑马鱼肌肉作为对照组(即低温保存处理0 d 的样品)。
1.4 总RNA 的提取及凝胶电泳分析
实验采用TRIzol 法分离上述各时间点肌肉样品中的总RNA,具体操作参照所用试剂说明书。用NANODROP 1000 型核酸蛋白测定仪测定RNA 样品浓度,并用1.5%的琼脂糖凝胶电泳分析各样品所提取的RNA 的降解情况。
1.5 cDNA 合成
取上述各时间点样品提取的总RNA 各500 ng,根据HiScriptII Q RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒的操作步骤,分别去除残余基因组DNA 后逆转录合成cDNA,并保存于-20 ℃备用。
1.6 引物设计及特异性和灵敏度分析
实验利用Primer 3 软件进行引物的设计,所设计的引物为了实现2 种目的的PCR 扩增分析,所有引物的相关信息参照表1。其一为了分析18s 分子在死后的降解趋势,即18s 分子是否存在逐步从长片段到更短片段转化的趋势。实验设计了4 对扩增递减片段长度的引物:1700F/1700R、1600F/1600R、1400F/1400R、1000F/1000R,用于扩增18s 多片段长度PCR(18s-ML PCR)反应,其所选片段均接近18s 序列中部区域。其二为了分析动物死后细胞内18s 降解是否存在位点的时序性,即降解是否存在一定的区域偏好性。实验基于斑马鱼18s 序列设计了7 对引物:F1/R1-F7/R7,用于叠瓦氏PCR(Tiling PCR)反应;它们可特异性扩增相似片段的大小(均约600 bp),同时所扩增片段两两相互交叉,共同覆盖整个18s 基因片段。各引物在18s 基因上的结合位点如图1 所示。上述所有引物的PCR 反应退火温度均设置为60 ℃左右。

表1 所有引物的相关信息Tab.1 Information about all primers

图1 18S 叠瓦氏PCR 引物位置示意图Fig.1 Positions of primers targeting 18S rRNA cDNA
引物的特异性通过以新鲜斑马鱼肌肉组织cDNA 为模板进行PCR 反应检测。为了比较各引物间的灵敏度,实验用引物对18sUS-F/18sDS-R 扩增了斑马鱼18s 基因,并根据载体操作说明将片段克隆至pMD19T 载体(Takara)上,构建了18s 模板质粒;以梯度浓度稀释的该质粒(102~106拷贝数·μL-1)为PCR 模板,比较了上述各引物的扩增灵敏度。如果灵敏度有差异,则重新设计引物,使所有本实验所设计的引物的灵敏度相近。PCR 反应体系为:2×Es TapMasterMix(Dye)25 μL、18sUS-F/18sDS-R 各2 μL、模板质粒1 μL、ddH2O 补到50 μL。PCR 反应条件:94 ℃预变性2 min;接34 个循环:94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min;以及72 ℃终延伸2 min。
1.7 叠瓦氏PCR 扩增
本研究假设斑马鱼肌肉组织内18s 分子随着冷藏时间而降解为逐步短片段,而且不同的18s 分子降解是独立的,那么扩增更短片段的引物更有可能在时间更长的样品中得到阳性PCR 反应结果。为了验证上述假设,实验首先用4 对18s-ML PCR 引物,对1.4 中准备的时间点的cDNA 样品进行了扩增,分析各段长产物的扩增与死亡时间的关联性;如果18s 分子随时间发生独立地有序降解,那么扩增更短片段引物可在经历更长死亡时间的样品中得到阳性PCR 反应。此外,为了分析降解是否存在一定位置上的偏好性,实验用7 对tiling PCR 引物,对同样的样品进行了扩增,分析各18s 序列区域的扩增鱼死亡时间的关联性;如果降解存在位点上的偏好性,那么不同引物对各时间点样品的PCR 反应结果会存在差异。PCR 反应体系和条件同1.5 所述。
2 结果
2.1 总RNA 随死后时间变化的电泳分析结果
如图2 总RNA 样品的电泳分析图谱所示,新鲜的鱼类组织呈现较为明显的3 条亮带(从上到下分别代表28sRNA、18sRNA、5sRNA 条带),说明RNA 的降解程度低。随着鱼类保存时间延长,可见上述特征条带的,其表现为28s 和18s 条带的降解。

图2 各死亡时间点样品总RNA 的琼脂糖电泳分析结果Fig.2 Agarose gel electrophoresis of RNA samples
2.2 PCR 引物特异性和灵敏度
通过对引物PCR 扩增产物的分析,确认所设计的引物均能特异性对斑马鱼18s 片段进行扩增。灵敏度的分析表明,各引物在所使用的PCR 反应体系和条件下,它们的灵敏度均为103拷贝数·μL-1的初始模板浓度(图3),所以不同引物对用于同一样品扩增的结果具有横向的可比较性。
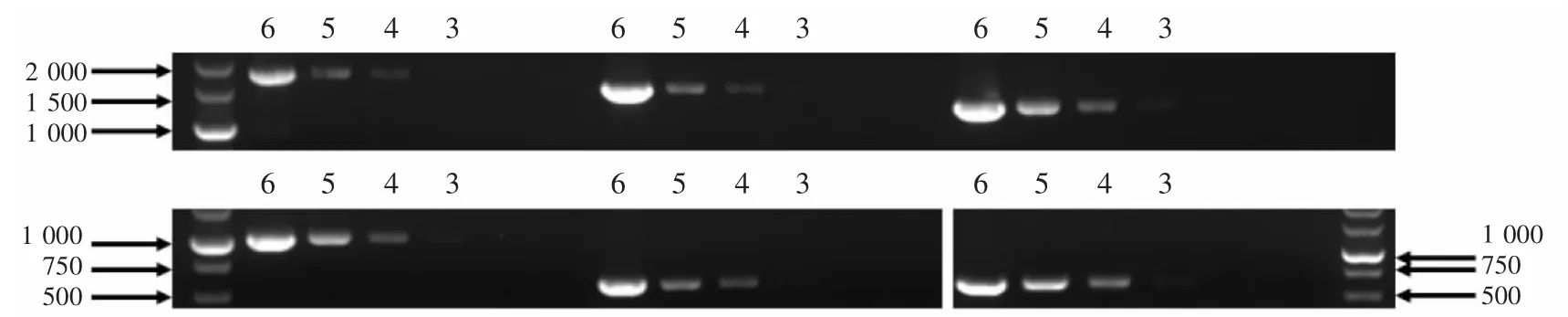
图3 引物的灵敏度图Fig.3 Sensitivity of primers
2.3 肌肉组织内18s 降解的时序性
4 对扩增不同引物的18s-ML PCR 反应结果,显示所扩增产物条带均随着死亡时间延长而逐渐变淡,直至无法获得阳性扩增;同时,扩增短片段的引物能在死亡更久的样品中得到阳性扩增。各时间点样品在采用引物1 700F/1 700R、1 600F/1 600R、1 400F/1 400R 扩增反应中,获得阳性和阴性临界点的死亡时间分别为1、5 d 和7 d,而引物1 000F/1 000R 在实验所采集的样品中均获得了阳性扩增(图4)。上述结果反映了肌肉组织中18s 分子随死亡时间在发生降解,而且降解方式可能从长片段逐渐缩短直至完全碎片化的方式发生。

图4 各时间点斑马鱼肌肉样品cDNA 的18s-ML PCR 反应结果Fig.4 18s-ML PCR results of fish muscle cDNA samples
2.4 肌肉组织内18s 降解的位点偏好性
在鱼类死亡6 d 后的样品中,使用引物对F7/R7(扩增区域1 452~2 055 bp)进行PCR 检测的结果均为阴性;而引物对F5/R5(扩增区域901~1 519 bp)的阴性扩增结果则出现在8 d 后的样品中,而其他靶向离3’端更远区域的引物对在所有样品中都得到阳性扩增结果。上述叠瓦氏PCR 扩增反应的结果说明,18s 的降解过程可能存在一定的位点时序性,即靠近3’端的区域要比5’端区域更快地开始降解。
3 讨论
动物死后细胞内RNA 的降解主要由胞核酸酶(RNase)等分子机制所驱动的[8-9],而且组织内RNA 降解速率取决于来源组织,如肝脏等富含核酸酶的组织中,多种核酸酶的水平具较高,可以快速地引发RNA 降解,但降解的规律性较弱。而肌肉等组织核酸酶含量相对低且成分稳定,所以降解过程可能更具规律性[9]。因此本实验选取肌肉组织作为研究对象,观察鱼类死亡后冷藏时间与RNA 降解之间关联性。此外,低温或冰温保鲜技术是目前水产品贮存及流通中重要的保鲜方法[10],所以探寻在此温度区间内死后动物组织RNA 降解规律具有潜在的应用前景。
真核生物细胞内所有RNA 中含量最高的为核糖体RNA(rRNA),约占真核生物总RNA 的85%[5],而18s rRNA 在物种间具有较好的保守性,即基因序列间具有较高的同源性,所以其基因序列常被用于物种间的系统发生进化分析[11-12]。在分子生物学实验中,常用rRNA 作指示分子判断所提取RNA 样品的完整性[13]。因此,本研究尝试了以18s 作为靶标RNA 分子,通过结合PCR 检测多种特定长度以上18s 降解物相对丰度的方式进行探究降解度与死亡时间之间的量化关系。
曾有多项研究报道了单独利用18s 或结合及其他RNA 的降解推断动物死亡时间的方法[1-2,15],其核心为通过将RT-qPCR 中18s 以及其他RNA 的Ct 值或ΔCt 值与死后间隔时间进行统计回归分析并建立推断方程。这些研究多基于小鼠模型展开,可能与鱼类存在差异。而本研究的结果揭示了斑马鱼肌肉细胞内18s 分子降解可能存在一定程度的位点偏好性,所以基于18s Ct 值的方法可能易受引物扩增区域的影响。为了克服上述的方法缺陷,本实验设计了基于普通PCR 扩增多片段长度18s 区域的方法,通过PCR 扩增结果与死亡时间的关系来推断鱼类死后冷藏时间的方法。此方法可确定鱼类死亡时间范围,而且对仪器要求低。然而,该方法区分死亡时间的分辨率不高,仍需要进一步的测试和完善。例如,在18s 基础上增加基因靶点,选取一些保守性较高且表达丰度适中的基因为对象,分析降解速率与死亡时间之间的规律。另外,实验的结果也需要在更多的鱼类鱼种中进行验证,以及根据需求探索在不同温度条件下的应用性。
综上,本研究确认了在冷藏条件下鱼类肌肉组织18s 降解与死亡时间具有相关性,提出了一种基于PCR 检测多个特定片长18s 降解物丰度的方法推测鱼类死亡时间范围的方案,但仍需要进一步的优化;其次,发现了斑马鱼18s 分子在肌肉组织内自然降解存在一定的位点偏好性,具体机制有待进一步的研究。
