氨基酸蛋白营养液对3 种常见淡水绿藻生长的影响
2021-12-13赵旭民吴陈炎张延军陈东良李继姬
赵旭民,吴陈炎,曾 霖,张延军,陈东良,毛 帅,李继姬
(1.国家海洋设施养殖工程技术研究中心,浙江舟山 316022;2.浙江华太生物科技有限公司,浙江义乌 322005;3.浙江海洋大学海洋科学与技术学院,浙江舟山 316022)
微藻——光能自养型单细胞藻类,广泛分布于淡水、海水生态系统,种类繁多。微藻细胞太阳能利用率高、生长繁殖迅速、且营养丰富:富含蛋白质、脂质、糖类、维生素(A、B1、B2、B6、C 及E)、类胡萝卜素(虾青素及β-胡萝卜素)、不饱和脂肪酸(EPA 及DHA)、藻多糖、矿质元素及抗氧化物质等多种营养成分[1],可满足水产养殖动物在幼苗期的正常生长发育营养需求。利用微藻饵料加强种苗营养的做法已经应用于对虾、海参、海胆、双壳贝类、甲壳类等动物育苗工作中[2-4],微藻饵料在提高育苗存活率、保证幼苗正常变态和发育、提高生长速度、提高免疫力等方面具备一定的作用[5]。另外,微藻可以高效地利用光合作用降低养殖水体中常见的氨、氮等有害无机物并产生氧气,净化水质保证溶解氧的供应[6]。因此,微藻已成为水产养殖的重要基础保障,养殖水体中养殖动物与微藻的合理搭配成为高效、健康养殖的必备举措,实践意义显著。
小球藻Chlorella sp.为普生性单细胞绿藻,隶属于绿藻门Chlorophyta,绿藻纲Chlorophyceae,卵囊藻科Oocystaceae,小球藻属Chlorella,具备适应能力强、分布广、生长速度快、营养丰富等特点[7]。斜生栅藻Scenedesmus obliquas,隶属于绿藻门Chlorophyta,绿球藻目Chlorococcales,栅藻科Scenedesmaceae,栅藻属Scenedesmus,具备易存活、繁殖能力强、环境耐受性强、氮磷利用率高、油脂及虾青素含量高等特点[8-9]。卵囊藻Oocystis sp.,属于绿藻门Chlorophyta,绿藻纲Chlorophyceae,绿球藻目Chlorococcales,卵囊藻科Oocystaceae,卵囊藻属Oocystis,广泛分布于小型湖泊和池塘等常见淡水水体中[10]。此3 种绿藻在水产养殖中均具有较高的应用价值:研究表明小球藻能够明显提高南美白对虾的存活率、促进生长[11];斜生栅藻细胞中富含的虾青素作为鱼类维生素A 的前体具备增强鱼类和虾、蟹类的免疫功能、促进生长和提高存活率的特点[12-14];卵囊藻因细胞吸附有害物质的能力而具备调控改善养殖水环境及增强对虾抗病力的特点[15];因此水产养殖对上述绿藻的需求和依赖性是很高的。
针对3 种绿藻细胞的生长和繁殖已有诸多报道,研究发现不同添加物和培养基对于不同绿藻发挥了积极作用:维生素B1 对小球藻的增殖有极显著的促进作用[16],蛋白胨和牛肉膏对小球藻的生长促进作用大[17],BG11-N 培养基有利于小球藻的快速生长,SE 培养基更有利于小球藻对油脂的积累[18];BG11 培养基有利于斜生栅藻的生长,F/2 培养基更适合斜生栅藻油脂以及中性脂的积累[19];鱼汁、海泥抽出液和尿液均能促进卵囊藻的生长[20]。目前针对单一藻种所需的无机盐[21]、微量元素[22]、维生素[23]、有机营养物质等开发针对性的单一最适培养基成为研究的侧重点,但是投入成本偏高,作为淡水养殖水体的微藻也并非单一物种,而是多物种搭配,因此多物种普适性的水体添加物可能成为更经济、更高效的举措。
本研究以F/2 和BG11 培养基为3 种绿藻的基础培养基,以市售华太氨基酸蛋白营养液为培养添加物,在不同的温度下设置不同浓度的双向梯度实验,评价该添加物对3 种绿藻的扩繁的效果,以期找到一种普适性的养殖水体添加物,为养殖体系中绿藻扩繁环节提供一个高效、经济的选项。
1 材料与方法
1.1 实验材料与及实验仪器
小球藻 (Chlorella sp.,GY-D19)、斜生栅藻(S.obliquus,GY-D13)及卵囊藻(Oocystis sp.,GY-D5)藻种购自上海光语生物科技有限公司。配制基础培养基的所有无机盐及氨基酸试剂购自上海国药集团化学试剂有限公司。氨基酸蛋白营养液采用大米加工而成,其生产工艺如图1 所示。对氨基酸蛋白营养液组成进行测定(国家标准GB/T 18246-2000),其主要成分见表1。
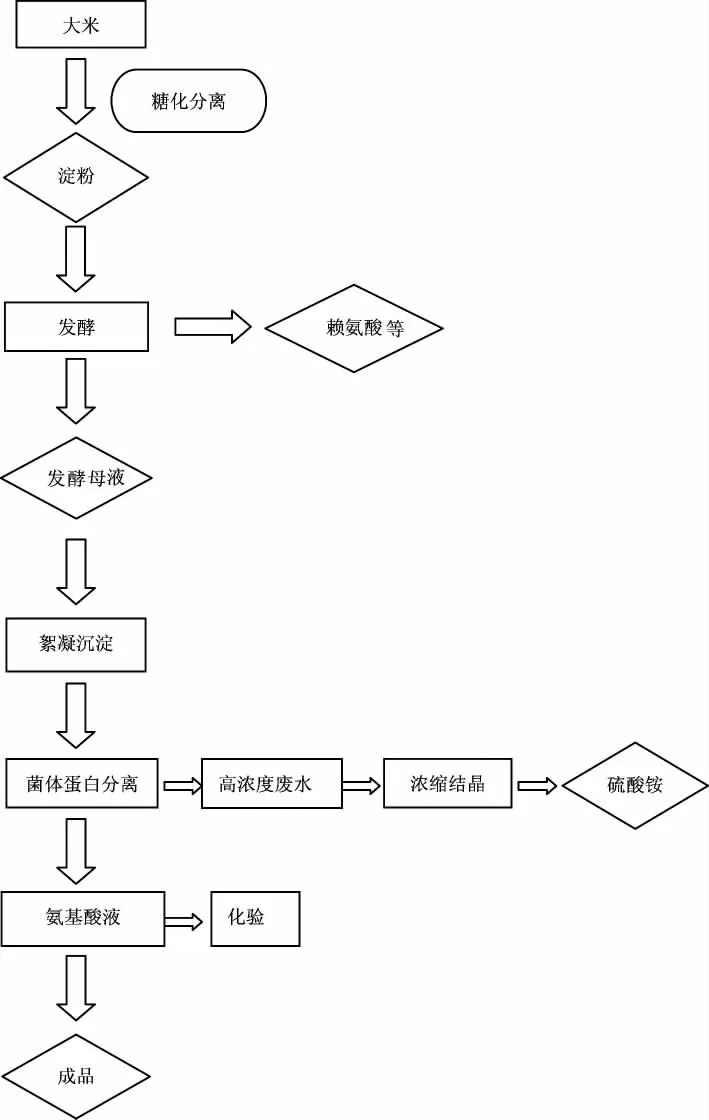
图1 氨基酸蛋白液生产工艺图Fig.1 Production process diagram of amino acid protein nutrient

表1 氨基酸蛋白液主要成分含量Tab.1 Content of main components in amino acid protein nutrient
实验所用仪器有:生物显微镜(CX23LEDRFS1C 型,奥林巴斯),血球计数板(AP-0650030 型,MARIENFELD),紫外可见光分光光度计(UV-2550 型,岛津),人工气候箱(RXZ-500D 型,宁波江南仪器厂),纯水仪(MilliporeElix)。
1.2 绿藻培养方法及双梯度实验设计
基础培养基配制与氨基酸蛋白营养液脱水处理:F/2、BG11 基础培养基配方参照王丽娟等[19]实验标准。使用纯水机处理后的超纯水添加各组分无机盐后经121 ℃、20 min 高压灭菌,随后加入经0.22 μm 孔径滤膜过滤除菌的氨基酸组分制成基础培养基备用。因营养液为膏液状,含水量会因生产批次的不同有起伏,为了实验的严谨性采取干重浓度设计(膏液状营养液经烘干测得干湿比为0.773 2)。
3 种绿藻均在人工气候箱中培养,各参数设置为:光照强度4 000 Lux、湿度75%、光照周期16 L/8 D,培养过程中每天摇瓶4 次。取生长至对数期的藻种在无菌环境下接种于容量体积为100 mL 的透明锥形瓶中,培养体积为50 mL,用过滤孔径为0.2~0.3 μm 的透气封口膜封口以防止杂菌污染。绿藻初始接种浓度分别为小球藻0.33×105cells·mL-1、斜生栅藻0.16×105cells·mL-1和卵囊藻0.04×105cells·mL-1。
双梯度实验设置是6 个实验温度(16、19、22、25、28 及31 ℃)和4 个氨基酸蛋白营养液(添加物)浓度(0、10、100 及1 000 mg·L-1),其中0 mg·L-1为空白对照,其他均为干重浓度。不同温度分批进行,同一温度下的4 组浓度实验同时进行,设置4 组平行组,连续培养并观测11~12 d,每24 h 测定藻液浓度。
1.3 藻浓度测定
本实验采用紫外可见光分光光度计和血球计数板测量藻浓度。首先,取生长至较高浓度的3 种藻液进行全波长扫描确定每种藻的光谱特征峰波长:小球藻686 nm、斜生栅藻682 nm、卵囊藻687 nm。然后取培养好的3 种微藻悬浮液用基础培养基按比例稀释成各种浓度,用血球计数板法计算藻浓度(单位105cells·mL-1),重复6 次,取平均值。将相应藻浓度用分光光度计在每种藻的特征峰波长下测定吸光度,以基础培养基为参比,求得每种藻细胞浓度(x)与藻液吸光度(y)之间的线性关系。
3 种微藻标准曲线方程为:
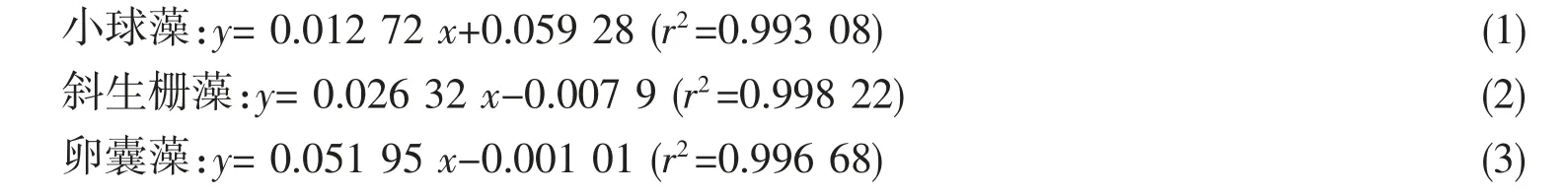
3 组标准曲线方程的r2均大于0.99,表明藻浓度与OD 值之间有较好的线性关系,可以用分光光度计法测定藻浓度,测得OD 值代入标准方程换算为藻浓度。
2 数据分析
所有藻液细胞浓度数据采用平均值±标准偏差(SD)的模式呈现,采用SPSS 软件的单因素方差分析法(ANOVA)进行实验组与对照组的显著性差异分析(P<0.05)。使用比生长率(SGR)来表示特定时间段内藻细胞群体的单位时间增长率,公式如下:

式中:A、B 为培养天数,d;CA、CB为第A 天和第B 天的藻浓度,105Cells·mL-1;(TB-TA)为第A 天到第B 天的培养时间长度,d。
3 结果与讨论
3.1 不同温度下营养液对3 种绿藻生长的影响
以3 ℃为间隔的梯度设计横跨16~31 ℃共6 个温度,覆盖了水产养殖实际生产过程中季节交换导致的多级温度变化。图2~7 的(a)分图分别显示的是6 个温度下经过11~12 d 培养后的3 种绿藻的细胞浓度,营养液对绿藻生长的影响因不同温度和不同物种而存在较大的差异。
温度梯度实验的最低温是16 ℃,小球藻的对照组和实验组均停止生长,斜生栅藻和卵囊藻均适应低温并对营养液的添加作出积极响应,相比对照组细胞浓度在一定程度上显著增加,见图2(a)。随着实验温度的上升,小球藻对照组均停止生长,而营养液的添加提升了小球藻的低温耐受性并显著提升了细胞浓度,见图3(a)。在高温31 ℃时,小球藻对照组同样受到高温胁迫停止生长,而营养液的添加同样提升了小球藻的抗高温性能并显著提升了细胞浓度,见图7(a)。由此可见,氨基酸蛋白营养液的添加使得小球藻提升了温度耐受性,适宜温度跨度得到扩展。然而,31 ℃(图7(a))、28 ℃(图6(a))及22 ℃(图4(a))实验组的卵囊藻受到添加的营养液的胁迫作用,细胞浓度显著低于对照组,而其他温度下呈促进生长的作用,暂未发现卵囊藻这种无规律变化的原因。对于斜生栅藻,所有温度下的实验组均呈现较好的生长态势,相较于对照组促进作用显著。
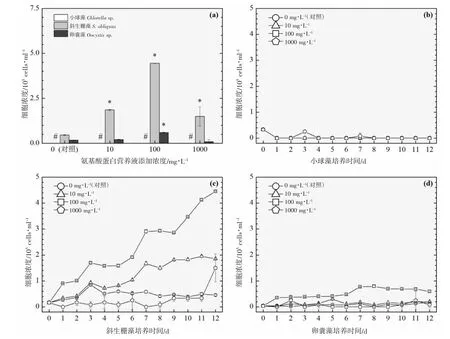
图2 添加氨基酸蛋白营养液对3 种绿藻生长的影响(16 ℃).(a):经过12 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):12 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.2 Effects of adding amino acid protein nutrient on the growth of three green microalgae (16 ℃)(a):Histogram of cell concentrations of three green microalgae after 12 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period
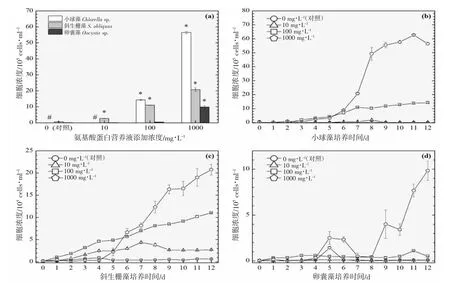
图3 添加氨基酸蛋白营养液对3 种绿藻生长的影响(19 ℃).(a):经过12 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):12 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.3 Effects of adding amino acid protein nutrient on the growth of three green microalgae (19 ℃).(a):Histogram of cell concentrations of three green microalgae after 12 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period

图4 添加氨基酸蛋白营养液对3 种绿藻生长的影响(22 ℃).(a):经过12 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):12 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.4 Effects of adding amino acid protein nutrient on the growth of three green microalgae (22 ℃).(a):Histogram of cell concentrations of three green microalgae after 12 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period
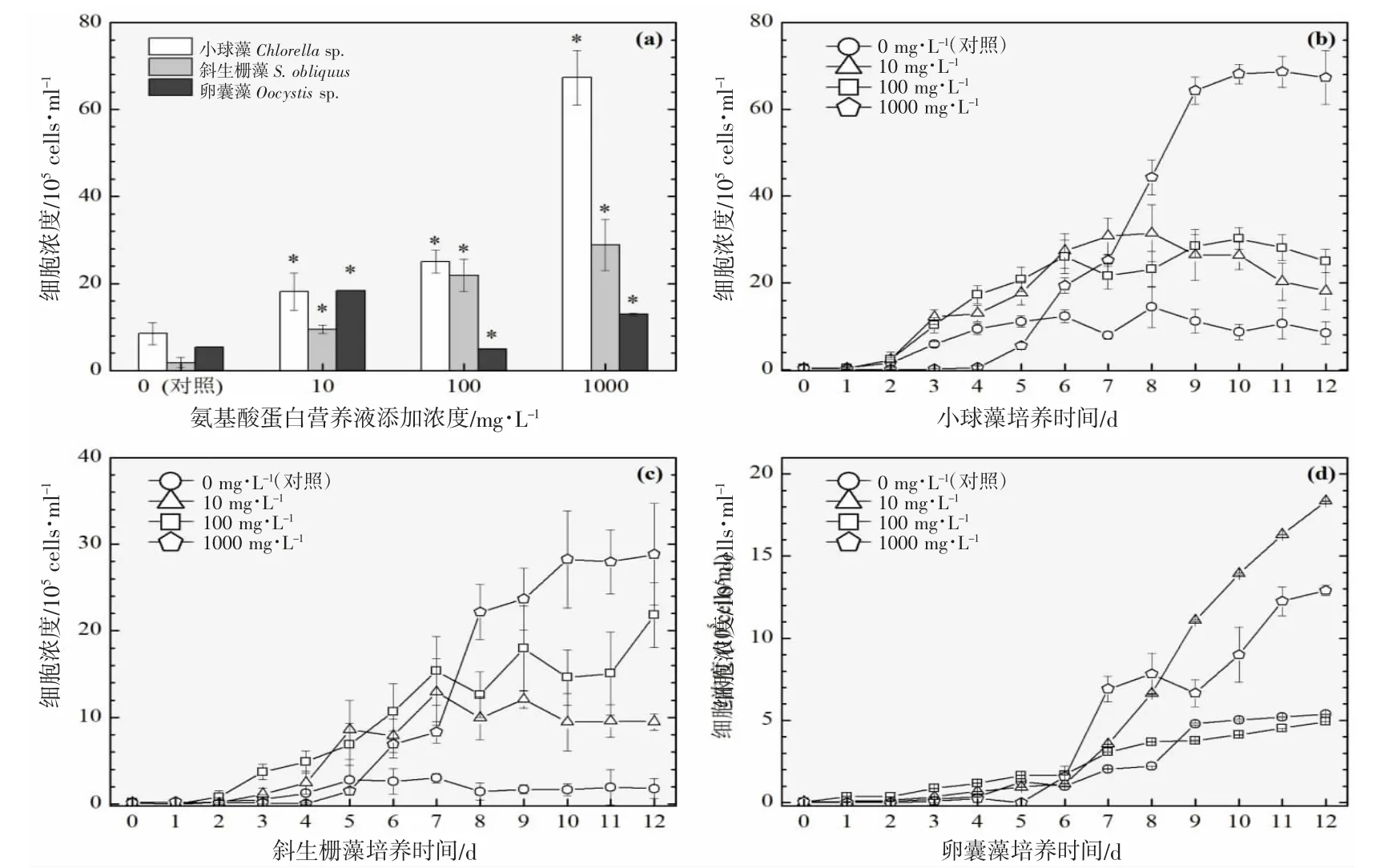
图5 添加氨基酸蛋白营养液对3 种绿藻生长的影响(25 ℃).(a):经过12 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):12 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.5 Effects of adding amino acid protein nutrient on the growth of three green microalgae (25 ℃).(a):Histogram of cell concentrations of three green microalgae after 12 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period
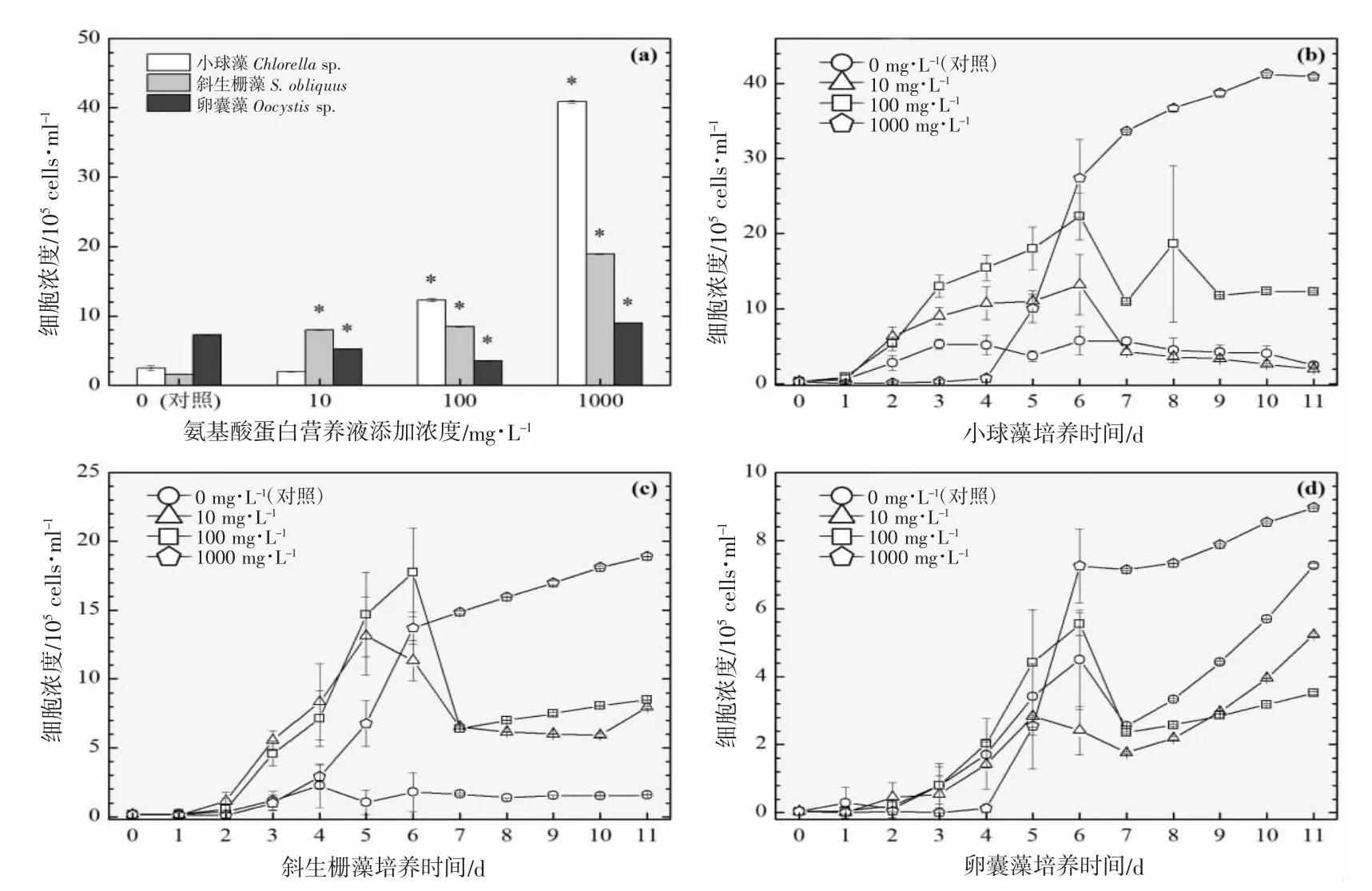
图6 添加氨基酸蛋白营养液对3 种绿藻生长的影响(28 ℃).(a):经过11 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):11 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.6 Effects of adding amino acid protein nutrient on the growth of three green microalgae (28 ℃).(a):Histogram of cell concentrations of three green microalgae after 11 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period
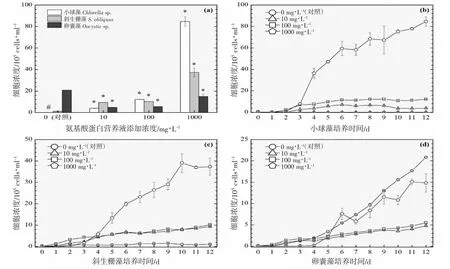
图7 添加氨基酸蛋白营养液对3 种绿藻生长的影响(31 ℃).(a):经过12 d 培养期的3 种绿藻细胞浓度柱状图;(b)、(c)及(d):12 d 培养期内小球藻、斜生栅藻及卵囊藻的生长曲线图Fig.7 Effects of adding amino acid protein nutrient on the growth of three green microalgae (31 ℃).(a):Histogram of cell concentrations of three green microalgae after 12 d;(b),(c) and (d):Growth curves of Chlorella sp., S.obliquus and Oocystis sp.,during 12 d culture period
相对于营养物质如葡萄糖或尿素,温度对小球藻细胞生长的影响更大,最适宜的温度在25~30 ℃之间[24],本研究中的小球藻适宜温度宽度相对得到扩展(19~31 ℃),是氨基酸蛋白营养液的功效。
3.2 不同营养液浓度对3 种绿藻生长的影响
营养液的浓度是决定细胞群体生长的关键,不同营养液浓度的设计的目的是期望为实际生产过程提供使用剂量参考。图2~7 的(b、c、d)分图分别显示的是3 种绿藻在4 种浓度(0、10、100 及1 000 mg·L-1)培养液施用后的生长曲线,不同浓度营养液产生的细胞群体生长促进程度不同。
对于小球藻,除低温16 ℃实验组之外,其他温度实验组的3 个浓度梯度与促进效果均呈现正相关性,浓度越高,促进细胞群体生长的程度越高。与之类似的是斜生栅藻,16 ℃实验组的最高浓度(1 000 mg·L-1)的促进作用明显小于中浓度(100 mg·L-1),其他温度的促进效果均与浓度呈现正相关性。而卵囊藻实验组细胞增殖的效果与营养液浓度没有呈现明显的相关性。
营养添加物或者必需微量元素对于微藻细胞具有促进生长和增殖的作用,但浓度升高之后便使藻细胞受到胁迫造成负面影响:高浓度种畜禽粪便浸出液对小球藻生长产生胁迫[25],超过0.015 mmol·L-1的磷添加使得小球藻的生长速度降低[26],质量浓度大于0.284 9 μg·L-1的微量元素Co2+对斜生栅藻产生不同程度的抑制效应[27]。本研究中出现的抑制效应部分出现在高浓度,相关机制可能与上述现象一致,为高浓度胁迫。有研究表明:随着培养液盐度的上升,卵囊藻的生物量显著下降,推测原因可能是卵囊藻生长所需渗透压较低[28],这与本研究中高浓度氨基酸营养液反而抑制生长的现象吻合。
3.3 单位时间增长率的变化与分析
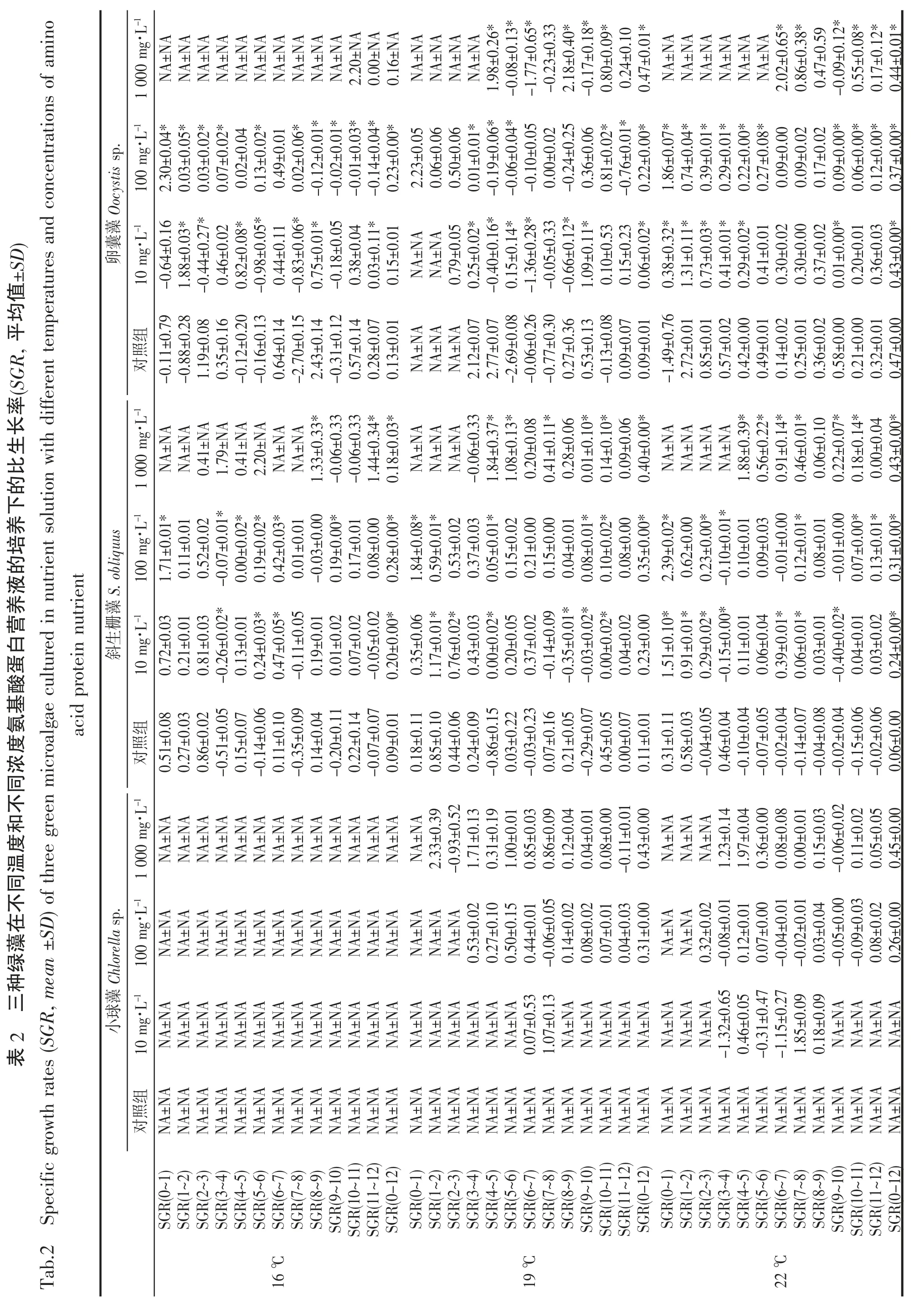
经过11~12 d 培养之后的细胞浓度反映的是最终的增殖结果,每天的细胞群体生长情况与单位时间增长率可以反馈不同时间段的生长情况,可以给生产实践提供第一手的信息。表2 表示3 种绿藻在不同温度和不同浓度氨基酸蛋白营养液的培养下的比生长率,清晰展示了每天的细胞群体增殖情况,同时也直观地反映在生长曲线图上(图2~7(b、c、d))。
生长曲线的交叉反映了比生长率的变化,19 ℃高浓度营养液在第5 天的时候显著增强了斜生栅藻的细胞生长(图3(c)),SGR(4-5)=1.84±0.37 和SGR(5-6)=1.08±0.13 相较于SGR(3-4)=0.06±0.33 明显增加,并高于同期中、低浓度及对照组,相似的增殖转折情况在斜生栅藻22~31 ℃实验组均有所体现。高浓度(1 000 mg·L-1)的营养液添加并未在培养前期1~3 d 内发生较大的生长率变化,反而有一定的抑制作用,进入4~5 d 之后开始发生明显的上升转折直至11~12 d 的培养期结束,相同的情况也发生在小球藻的培养体系内。这一段0~4 d 的培养期可以称为高浓度营养液调整适应期,因此高浓度营养液的添加效果在4 d 之后呈现可以指导生产实践过程中施肥操作。低温情况下,最适宜斜生栅藻的营养液浓度是中浓度(100 mg·L-1),然而中浓度并未出现调整适应期,这是一个值得注意的地方。而卵囊藻的生长曲线多重交叉现象,生长曲线未能呈现规律性的变化,可能需要更进一步的实验去解析卵囊藻与营养液之间的相关性。

4 结论
本研究双梯度实验结果表明:华太氨基酸蛋白营养液的添加对小球藻和斜生栅藻的细胞增殖具有显著的提升作用,除16 ℃低温特殊情况之外高浓度(1 000 mg·L-1)的增殖效果最好;对小球藻表现出显著的适宜温度跨度扩展,增加了小球藻在高、低温时期淡水水体扩繁的可能性;部分浓度的营养液在特定温度下对卵囊藻表现出一定程度的抑制效应,需要进一步的实验探究造成抑制效应的机理。期望本研究的结果可以为华太氨基酸蛋白营养液在淡水养殖生产中的应用提供藻种筛选、培育温度及培养浓度等方面的参考。
