2 种养殖模式下草鱼肌肉营养成分的比较分析
2021-12-13施永海徐嘉波袁新程谢永德
杨 明,施永海,徐嘉波,袁新程,谢永德
(1.上海市水产研究所,上海 200433;2.上海市水产技术推广站,上海 200433)
草鱼Ctenopharyngodon idellus 与鲢Hypophthalmichthys molitrix、鳙Aristichthys nobilis 和青鱼Mylopharyngodon piceus 并称为“四大家鱼”,是我国重要的淡水经济鱼类,年产量达550 万t 以上,占我国淡水养殖鱼类产量的1/5,在我国绝大部分地区均有养殖[1-2]。草鱼肉质肥嫩,味道鲜美,深受消费者喜爱。随着人民生活水平的不断提升,对于水产品质量的要求越来越高。草鱼作为我国最主要的大宗淡水鱼类品种之一,探讨不同养殖模式下草鱼的营养差异,并据此提升草鱼品质对于促进草鱼养殖产业的可持续健康发展有着重要的意义。已有学者关注到草鱼的营养品质问题,主要涉及野生和养殖草鱼肌肉营养成分差异[3-4];不同饵料对草鱼肌肉营养成分和品质特性的影响[5-8];传统池塘养殖和池塘内循环系统养殖草鱼的营养差异[9-10]。事实上,鱼类肌肉营养成分含量除了因品种不同而存在差异外,还与饵料来源、鱼体生长阶段、性别和生存环境密切相关[11-13]。因此,明晰不同养殖模式下草鱼营养成分差异程度则显得十分重要。对于不同鱼类的营养成分差异研究,主要集中在海水和淡水养殖[14]、投喂不同饵料[15]、养殖与野生[16]、循环水养殖与常规池塘养殖[17]等方面,但对于投喂同种饲料下的不同养殖模式而言,则报道甚少。尤其是草鱼作为我国重要的淡水鱼类养殖品种,开展多种养殖模式研究,对于优化草鱼养殖模式,提高经济效益具有重要的现实意义。但对于草鱼单养或草鱼二元或多元养殖模式下其肌肉品质差异尚未见相关报道。基于此,本研究分析比较了草鱼单养和草鱼-凡纳滨对虾混养2 种模式下其肌肉营养成分和品质差异,旨在了解草鱼肌肉营养成分与养殖模式的关系,以期为草鱼饲料配方优化、选择适宜的养殖方式、改善养殖草鱼营养品质提供借鉴和参考。
1 材料与方法
1.1 试验材料
养殖试验用鱼取自上海市崇明区瑞钵水产养殖专业合作社,混养组受试鱼体质量(6.58±0.91)kg;单养组受试鱼体质量(6.00±0.38)kg。草鱼养殖试验期间所用饲料为颗粒配合饲料(粗蛋白(32.11±1.43)%、粗脂肪(6.06±0.06)%、粗灰分(11.65±0.03)%、水分(8.31±0.00)%),凡纳滨对虾所用饲料为商业颗粒饲料(粗蛋白(44.50±2.37)%、粗脂肪(5.85±0.52)%、粗灰分(13.03±0.06)%、水分(6.68±0.03)%)。草鱼料和虾料的氨基酸、脂肪酸组成与含量测定结果列于表1。

表1 草鱼、凡纳滨对虾配合饲料中氨基酸和脂肪酸组成及含量Tab.1 Composition and content of amino acid and fatty acid in grass carp C.idellus and L.vannamei formulated feed
1.2 试验设计和养殖管理
采用2 种模式开展草鱼的养殖试验,其中一组为草鱼单养模式(以下简称单养组),另一组为草鱼-凡纳滨对虾混养模式(以下简称混养组)。单养组和混养组试验塘面积均为8 000 m2,单养组和混养组草鱼鱼种(均重750 g)于2019 年4 月22 日放入,放养密度均为4 500 尾/hm2,混养组凡纳滨对虾苗种于2020 年6 月7 日放入池塘,放养密度30 尾/m2,凡纳滨对虾养殖试验周期持续4 个月。2020 年11 月20 日分别对单养组和混养组的草鱼进行随机采样,取其背部肌肉进行相关营养成分的测定。
1.3 营养成分测定方法
依照105 ℃烘干法(GB 5009.3-2016)测定水分含量;按照550 ℃灼烧法(GB 5009.4-2016)测定粗灰分含量;按照凯氏定氮法(GB/T 6432-2018)测定粗蛋白含量;按照氯仿-甲醇法测定粗脂肪含量(GB 5009.6-2016);先按照GB/T 18246-2000 中的碱水解法前处理样品,然后采用反相高效液相色谱法测定色氨酸含量;先按照GB 5009.124-2016 中的盐酸水解法前处理样品,然后使用日立L-8900 型氨基酸全自动分析仪(日本日立高新技术公司)测定除色氨酸外的其他氨基酸含量;按照GB 5009.168-2016 法使用Agilent 6890 型气相色谱仪(美国安捷伦科技公司)峰面积归一法测定脂肪酸含量。
1.4 营养品质评价方法
根据联合国粮食与农业组织/世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization,FAO/WHO)提出的人体必需氨基酸均衡模式[18]以及全鸡蛋蛋白模式[19],对2 种养殖模式下的草鱼肌肉进行氨基酸评分(amino acid score,AAS),化学评分(chemical score,CS)和必需氨基酸指数(essential amino acid index,EAAI)评分,计算公式如下:

式中:n为比较的氨基酸数;t为样品蛋白质中必需氨基酸含量,mg·g-1;s为鸡蛋蛋白质中必需氨基酸含量,mg·g-1;其中氨基酸含量=(样品中氨基酸含量/样品中粗蛋白含量)×6.25×1 000,mg·g-1N;F为支链氨基酸与芳香族氨基酸的比值。
1.5 试验数据处理及分析
采用独立样本t检验(Independent samplest-test)进行单养和混养模式之间各营养成分含量的比较,描述性统计值使用平均值±标准差(Mean±SD)表示,P<0.05 视为存在显著性差异,P<0.01 视为存在极显著性差异。
2 结果
2.1 常规营养成分
从混养组和单养组草鱼肌肉常规营养成分测定结果可知(表2),混养组草鱼肌肉粗蛋白和粗灰分含量略高于单养组,但差异不显著(P>0.05),单养组水分含量显著高于混养组(P<0.05),但混养组粗脂肪含量显著高于单养组(P<0.05)。

表2 混养组、单养组草鱼常规营养成分含量比较(n=3,鲜重,%)Tab.2 Comparison of common nutrient components in muscles of C.idellus under two culture modes(n=3,fresh weight,%)
2.2 氨基酸组成和含量
单养和混养2 种养殖模式下的草鱼肌肉均检出18 种常见的氨基酸(表3),包括8 种必需氨基酸(EAA)、2 种半必需氨基酸(HEAA)和8 种非必需氨基酸(NEAA)。单养组氨基酸总量和鲜味氨基酸含量极显著高于混养组(P<0.01),单养组必需氨基酸和半必须氨基酸含量显著高于混养组(P<0.05)。18 种氨基酸中,除胱氨酸、酪氨酸、组氨酸和色氨酸在两组间不存在显著差异外(P>0.05),其余氨基酸含量均是单养组含量显著高于混养组(P<0.05)。两组间单个氨基酸含量均以谷氨酸的含量最高,其次为天门冬氨酸和赖氨酸。必需氨基酸与氨基酸总量之比、必需氨基酸与非必需氨基酸之比和鲜味氨基酸与氨基酸总量之比在两种模式下无显著性差异(P>0.05),其中单养组和混养组必需氨基酸与氨基酸总量的比值分别为(41.28±1.28)%和(40.57±0.16)%,单养组和混养组必需氨基酸与非必需氨基酸的比值分别为(81.85±0.20)%和(81.51±0.58)%,均高于FAO/WHO 提出的理想模式标准(ΣEAA/ΣAA 为40%左右,ΣEAA/ΣNEAA 为60%以上)。
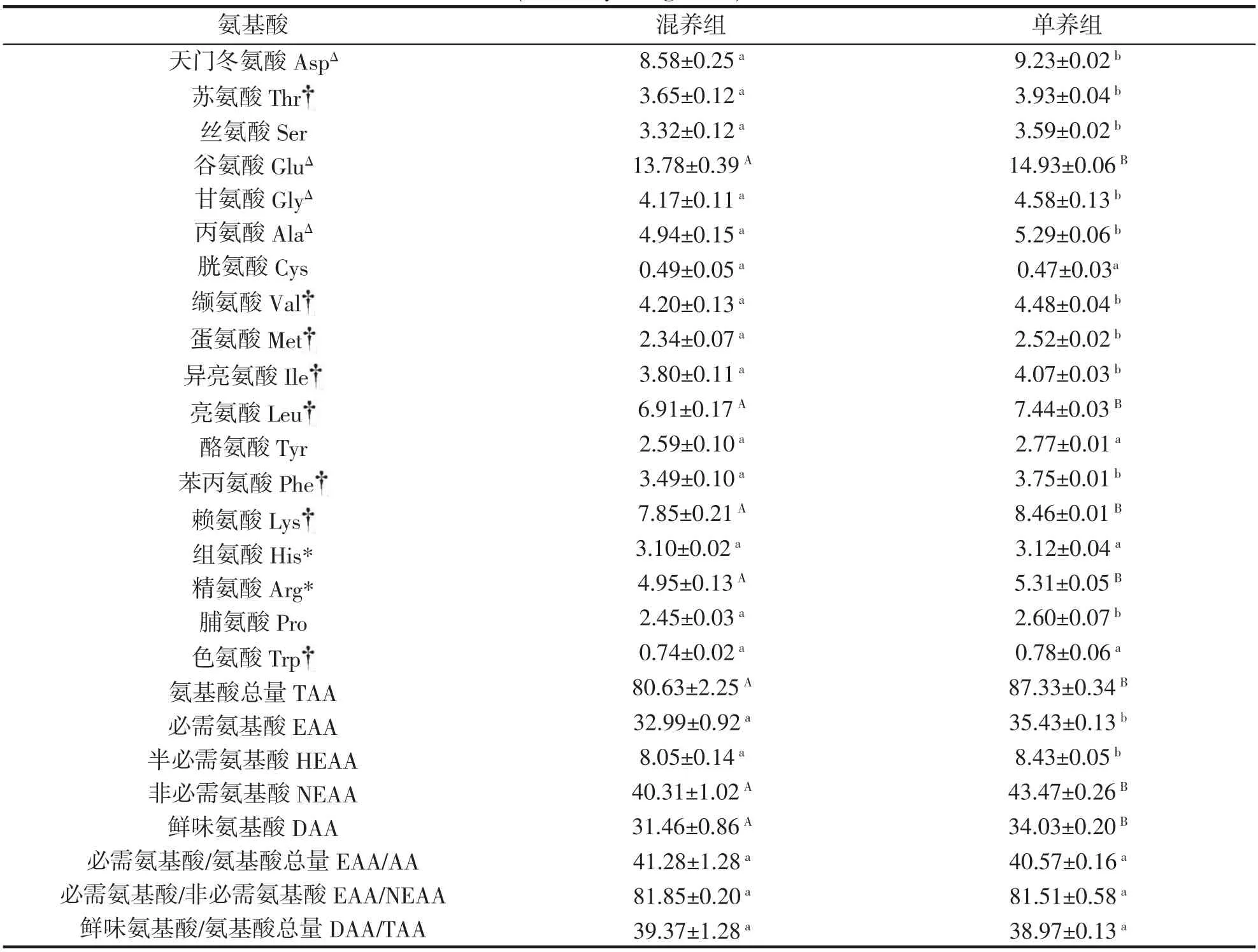
表3 混养组、单养组草鱼氨基酸组成及含量比较(n=3,干重,%)Tab.3 Comparison of amino acid composition and content in muscles of C.idellus under two culture modes(n=3,dry weight,%)
2.3 营养品质评价
将表3 中必需氨基酸含量的数据换算成每克氮中含氨基酸毫克数后,再分别与FAO/WHO 制定的氨基酸评分模式标准和全鸡蛋蛋白质的氨基酸评价标准进行比较,分别计算出2 种养殖模式下草鱼肌肉的AAS、CS、EAAI 和F 值。由表4 可知,基于FAO/WHO 氨基酸评分模式标准,单养组和混养组的色氨酸(Trp)、蛋氨酸+胱氨酸(Met+Cys)和缬氨酸(Val)含量低于该标准,其余氨基酸含量均大于FAO/WHO 标准;基于全鸡蛋蛋白标准,2 种养殖模式下的赖氨酸(Lys)含量均高于该标准,其余氨基酸含量低于此标准,但CS 值均大于0.5。由AAS 可以看出,单养组和混养组的第一限制性氨基酸均为色氨酸,第二限制性氨基酸为蛋氨酸+胱氨酸;而根据CS 标准,单养组和混养组的第一限制性氨基酸为蛋氨酸+胱氨酸,第二限制性氨基酸为色氨酸;混养组和单养组的EAAI 分别为76.19 和75.74;支链氨基酸与芳香族氨基酸的比值(F 值)分别为2.46 和2.45。
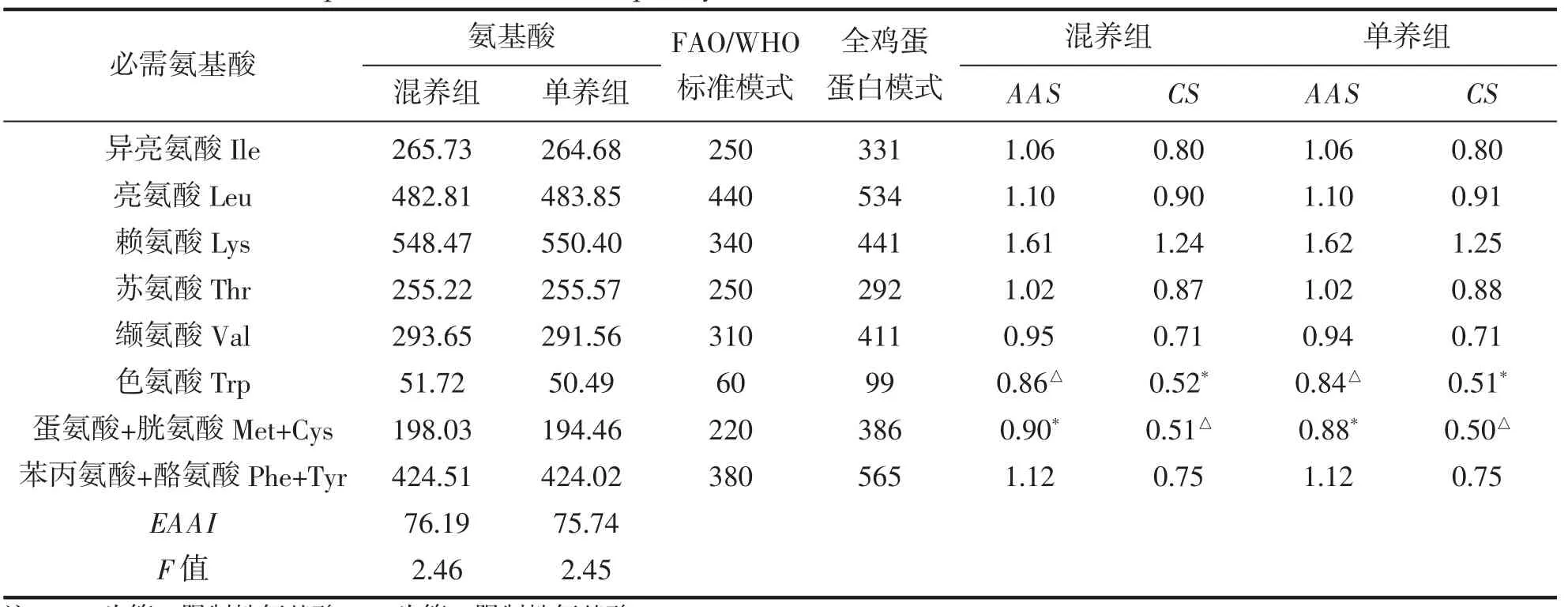
表4 混养组、单养组草鱼营养品质比较Tab.4 Comparison of nutritional quality in muscles of C.idellus under two culture modes
2.4 脂肪酸组成和含量
单养组和混养组的脂肪酸组成均包含4 种饱和脂肪酸、3 种单不饱和脂肪酸和4 种多不饱和脂肪酸(表5)。饱和脂肪酸中,以棕榈酸(C16:0)的含量最高,其中混养组含量(18.17%)略高于单养组(17.035%),但两者差异不显著(P>0.05),硬脂酸(C18:0)在两组间差异也不显著(P>0.05),但混养组豆蔻酸(C14:0)显著高于单养组(P<0.05),而单养组花生酸(C20:0)显著高于混养组(P<0.05);单不饱和脂肪酸中,除棕榈烯酸(C16:1)在两组间无显著差异外(P>0.05),混养组油酸(C18:1n9)和二十碳一烯酸(C20:1)含量极显著高于单养组(P<0.01);多不饱和脂肪酸中,混养组亚麻酸(C18:3n6)含量极显著低于单养组(P<0.01),2 种养殖模式下的草鱼均检测出了二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),且混养组EPA、DHA 含量均显著低于单养组(P<0.05),且单养组(EPA+DHA)极显著高于混养组(P<0.01);混养组单不饱和脂肪酸总量(ΣMUFA)极显著高于单养组(P<0.01),但多不饱和脂肪酸总量(ΣPUFA)却是单养组极显著高于混养组(P<0.01);饱和脂肪酸总量/不饱和脂肪酸总量(ΣSFA/ΣUFA)在两组间无显著差异,单养组为31%,混养组为33%。
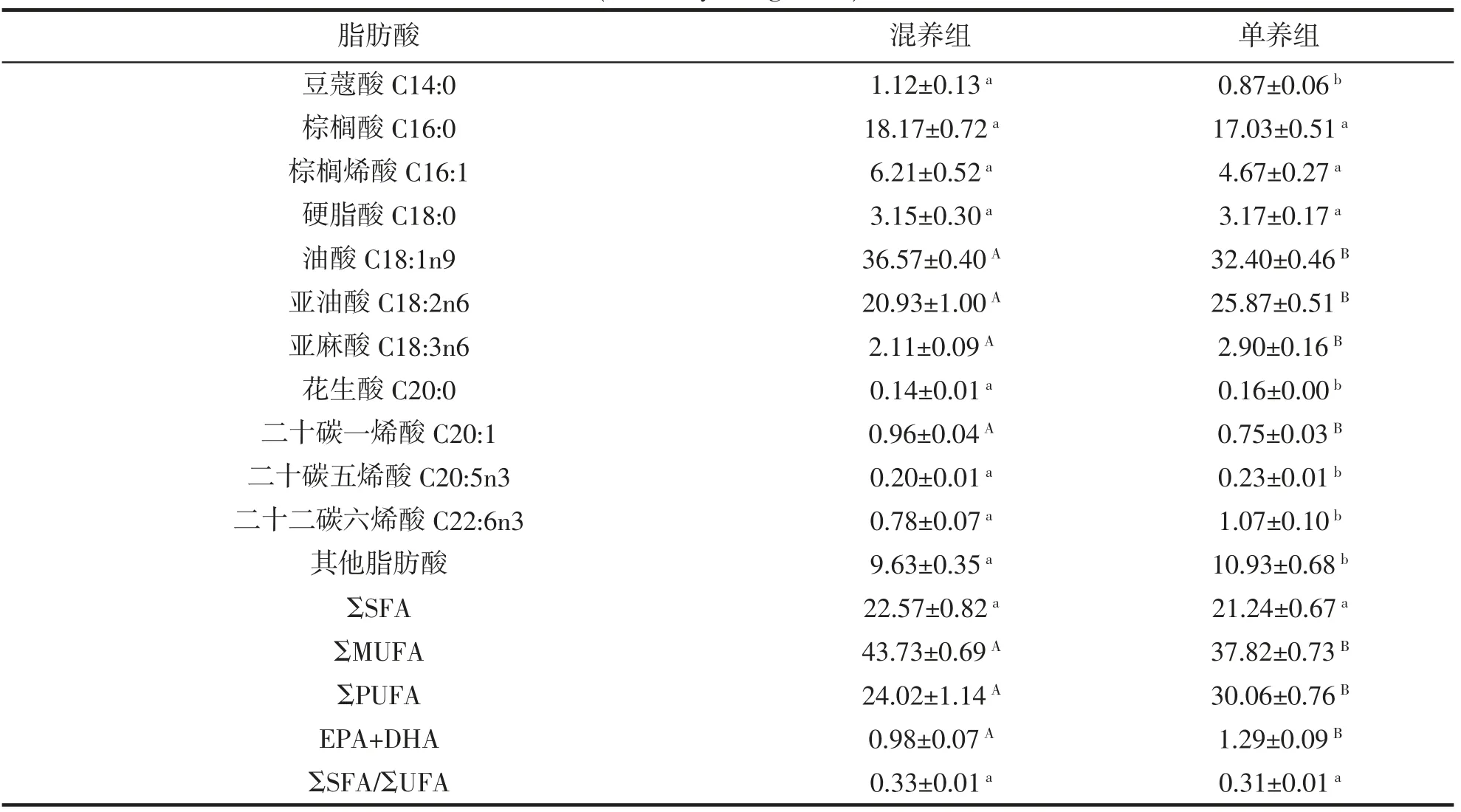
表5 混养组、单养组草鱼脂肪酸组成及含量比较(n=3,干重,%)Tab.5 Comparison of fatty acid composition and content in muscles of C.idellus under two culture modes(n=3,dry weight,%)
3 讨论
3.1 单养组和混养组草鱼肌肉常规营养成分分析比较
现有的研究表明,鱼类肌肉中常规营养成分含量的差异,不仅取决于品种不同,其他如饵料、投喂方式、生长阶段、养殖模式等因素对其都有一定的影响[12,20]。周裕华等[21]对糠虾、小杂鱼与蛤肉3 种不同饵料投喂下的菊黄东方鲀Takifugu flavidus肌肉营养成分进行的研究表明,蛤肉组饲喂下的肌肉粗蛋白含量显著低于糠虾组和小杂鱼组,而粗脂肪含量间则是糠虾组>小杂鱼组>蛤肉组;对摄食浒苔和人工饵料的点篮子鱼Siganus guttatus幼鱼肌肉营养成分的比较研究表明,浒苔组点篮子鱼幼鱼的粗蛋白质和粗灰分含量显著高于人工饵料组,而粗脂肪含量显著低于人工饵料组[22];施永海等[23]对配合饲料和活饵料喂养的刀鲚Coilia nasus开展了肌肉营养品质分析与比较,发现配合饲料饲喂的刀鲚肌肉水分含量显著高于活饵料组,而粗脂肪含量显著低于活饵料组。此外,也有学者就不同养殖模式下鱼类营养成分差异进行了相关研究,如颜孙安等[24]对大围网、池塘和网箱3 种养殖模式下大黄鱼Pseudosciaena crocea肌肉的营养成分进行比较分析;吉红等[25]对池塘与网箱养殖匙吻鲟Polyodon spathula肌肉营养成分及品质进行了比较研究;李来好等[26]对池塘和水库养殖的奥尼罗非鱼Oreochromis niloticus♀×O.aureus♂的营养成分差异进行了比较研究,以上研究结果均表明不同的养殖模式对鱼体肌肉营养成分有着显著影响。本研究采用草鱼单养和草鱼-凡纳滨对虾混养2 种养殖模式开展试验,所用饲料为草鱼专用商品饲料。在此2 种养殖模式下,单养组水分含量显著高于混养组,但其粗脂肪含量显著低于混养组,混养组草鱼肌肉粗蛋白和粗灰分含量略高于单养组,但差异不显著。养殖环境不同会影响鱼体肠道的微生物群落结构,进而通过肠道微生物调节营养物的代谢来影响鱼体肌肉品质。因此,混养组和单养组草鱼之间显著的粗脂肪含量差异可能与不同养殖环境下草鱼差异性的肠道微生物富集于脂质代谢有关[27]。
3.2 单养组和混养组草鱼肌肉氨基酸组成及含量分析比较及营养品质评价
鱼肉蛋白质营养取决于其氨基酸含量与组成,它是衡量鱼类营养价值和影响鱼肉风味的非常重要的指标,特别是人体所需的8 种必需氨基酸组成与含量[28-29]。本试验条件下,单养组、混养组草鱼肌肉氨基酸总量(87.33%、80.63%,以干基计)和必需氨基酸总量(35.43%、32.99%)含量较高,普遍高于大黄鱼[30]、鳜Siniperca chuatsi[31]、银鲳Pampus argenteus[32]、暗纹东方鲀T.fasciatus[33]等名贵经济鱼类,单养组和混养组必需氨基酸与氨基酸总量的比值分别为41.28%和40.57%,单养组和混养组必需氨基酸与非必需氨基酸的比值分别为81.85%和81.51%,均高于FAO/WHO 提出的理想模式标准(ΣEAA/ΣAA 为40%左右,ΣEAA/ΣNEAA 为60%以上),说明本试验条件下单养组和混养组草鱼肌肉氨基酸营养较为全面和丰富,均为优质蛋白质。
单养和混养2 种模式对草鱼肌肉氨基酸组成种类没有显著影响(两种模式下的草鱼肌肉均检出18 种氨基酸),但显著影响氨基酸含量。18 种氨基酸中,除胱氨酸、酪氨酸、组氨酸和色氨酸在两组间不存在显著差异外(P>0.05),其余单个氨基酸含量均是单养组含量显著高于混养组(P<0.05),单养组氨基酸总量和鲜味氨基酸含量极显著高于混养组(P<0.01),单养组必需氨基酸和半必需氨基酸含量显著高于混养组(P<0.05)。单养组氨基酸营养价值较混养组高。肌肉中鲜味氨基酸包含谷氨酸、天冬氨酸、甘氨酸和丙氨酸,它们的组成和含量决定着动物蛋白的味道鲜美程度,谷氨酸和天冬氨酸是其特征性氨基酸,其中谷氨酸的鲜味最强[34]。研究指出,不同的养殖模式对鱼体肌肉品质有着显著影响。如网箱养殖斑石鲷Oplegnathus punctatus的肌肉呈味氨基酸和氨基酸总量均显著高于水泥池养殖斑石鲷[35];投喂冰鲜鱼的网箱养殖大黄鱼肌肉氨基酸总量、必需氨基酸总量、呈味氨基酸总量、鲜味氨基酸总量均高于池塘组、深水网箱养殖模式[11];对北极红点鲑Salvelinus alpinus在循环水、半流水和全流水3 种养殖模式下的营养成分分析表明,18 种氨基酸含量及必需氨基酸、半必需氨基酸、鲜味氨基酸、非必需氨基酸总量均为全流水模式>半流水模式>循环水模式[36]。可见,即使在苗种来源相同、投喂相同饵料的条件下,由于养殖模式各异,其肌肉氨基酸含量也存在差异,而导致这种差异的原因主要在于生活环境不同。
必需氨基酸指数(EAAI)反映了必需氨基酸的平衡性,是评价蛋白质营养价值的常用指标之一。本试验中单养组和混养组的EAAI 指数分别为75.74 和76.19,明显高于大麻哈鱼Oncorhynchus keta(61.31)[37]和黄颡鱼Pelteobagrus fulvidraco(63.61)[17]等经济鱼类,与海水养殖的红鳍东方鲀T.rubripes(76.61~77.64)相当[38],说明2 种养殖模式下的草鱼蛋白质营养价值高,氨基酸平衡性较好。此外,从肌肉营养品质评价来看,依据AAS 标准,单养组和混养组的第一限制性氨基酸均为色氨酸,第二限制性氨基酸为蛋氨酸+胱氨酸;而根据CS 标准,单养组和混养组的第一限制性氨基酸为蛋氨酸+胱氨酸,第二限制性氨基酸为色氨酸。因此,今后在饲料的配制上要注重适当提高色氨酸和蛋氨酸+胱氨酸的含量,保证氨基酸营养的均衡性。
3.3 单养组和混养组草鱼肌肉脂肪酸组成及含量的分析比较
脂类是鱼体的重要组成部分,对鱼类具有重要的生理功能和生物学效应。脂类对淡水鱼的营养价值很大程度上取决于多不饱和脂肪酸(PUFA)的种类和数量,尤其是亚麻酸、亚油酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等[39-40]。α-亚麻酸能提高胎婴儿的大脑发育和脑神经功能,增强胎婴儿视力、脑细胞信息功能,促进人脑正常发育以及促进胎婴儿的机能和形体发育。亚油酸是具有许多重要生理功能的天然不饱和脂肪酸之一,具有降低脂肪、增强机体免疫能力等独特的生理功能[41-42]。而EPA 和DHA,具有维护生物膜的结构和功能、治疗心血管疾病、抗炎、抗癌以及促进大脑健康发育、减肥、增加动物的产仔率和成活率等生理功能,能够对淡水鱼类的生长、脂质稳态平衡、健康免疫、繁殖性能等方面产生积极的作用[43-44]。与海水鱼类自身无法合成高度不饱和脂肪酸(HUFA)不同,淡水鱼类具备合成HUFA 的能力。因此,摄取淡水鱼类可有效补充对人体健康有益的ω-3 和ω-6 系列HUFA。本研究中,单养组亚油酸C18:2n6 和亚麻酸C18:3n6 含量均极显著高于混养组(P<0.01),而EPA、DHA 含量显著高于混养组(P<0.05),两者之和(EPA+DHA)则极显著高于混养组(P<0.01),单养组多不饱和脂肪酸总量(ΣPUFA)极显著高于混养组(P<0.01)。因此,单养组脂肪酸营养明显优于混养组。鱼体脂肪酸的相对含量除了受到食物、年龄、性别等因素影响外,养殖模式不同导致的生长环境差异也是影响鱼体脂肪酸含量的重要外在因素。如池塘内循环养殖模式下大口黑鲈Micropterus salmoides的MUFA+PUFA 显著高于常规池塘养殖模式[45];对循环水模式、半流水模式和全流水模式3 种养殖模式下北极红点鲑Salvelinus alpinus的肌肉营养成分比较研究显示,循环水养殖的脂肪酸种类、饱和脂肪酸、不饱和脂肪酸和EPA+DHA 总量最高,全流水模式的多不饱和脂肪酸总量最高[36];大围网、池塘和网箱三种养殖模式下大黄鱼肌肉的PUFA 含量及DHA+EPA 的相对含量依次为池塘养殖>大围网养殖>网箱养殖[24]。因此,本试验条件下单养组和混养组脂肪酸含量差异可能与不同养殖模式造成的环境差异有关,进而影响了鱼体脂肪酸的含量。
除了环境因素外,鱼体脂肪酸的组成还受饲料脂肪酸的组分构成影响,从本结果来看,单养组(0.23%)和混养组(0.20%)草鱼肌肉EPA 含量均低于饲料中EPA 含量(0.52%),说明饲料中EPA 含量可满足单养组和混养组草鱼生长发育所需。此外,草鱼饲料中未检出DHA,但单养组和混养组草鱼肌肉中DHA 含量分别为1.07%和0.78%,说明草鱼具备对饲料脂肪酸的转化能力。鱼体组织器官脂肪酸组成与饲料脂肪酸组成有一定的相关性。陈伟洲等[46]的研究表明,花尾胡椒鲷Plectorhinchus cinctus 组织中的脂肪酸构成受饲料中n-3 HUFA 含量影响,受影响的顺序是性腺>肌肉>肝胰脏,组织对n-3 PUFA、特别是DHA 具有较强的选择性保留作用,说明这些脂肪酸在性腺发育成熟中具有重要的生理作用。刘兴旺等[47]的研究表明,军曹鱼Rachycentron canadum 鱼体各器官中n-3 HUFA 的水平随饲料中n-3 HUFA 水平的增加而逐渐提高,且随着DHA 添加量的增加,肌肉和肝脏中18:1n-9 的含量逐渐降低。吉红等[48]对饲料中HUFA 影响草鱼脂质代谢的研究表明,HUFA 组中肌肉组织n-3 系列、HUFA 含量较对照组显著升高。因此,今后应加强草鱼饲料中DHA 适宜添加量的研究,以进一步促进草鱼生长发育,优化草鱼肌肉脂肪酸组成。
本试验条件下,2 种养殖模式对草鱼肌肉一般营养成分、氨基酸组成含量、脂肪酸组成含量存在显著影响,单养组草鱼肌肉营养品质总体上优于草鱼-凡纳滨对虾混养模式。
