2型糖尿病肾脏疾病患者血清同型半胱氨酸及炎性因子水平的分析
2021-12-10孔晓牧魏先森徐英春
刘 辉,马 亮,刘 倩,孔晓牧,魏先森,徐英春
(1.中国医学科学院 北京协和医学院 北京协和医院 检验科,北京 100730;2.中日友好医院 检验科,北京 100029;3.中日友好医院 肾内科,北京 100029)
糖尿病肾脏疾病 (diabetic kidney disease,DKD) 是由糖尿病所致的慢性肾脏结构和功能障碍,我国约10%~40%的2 型糖尿病(type 2 diabetes mellitus,T2DM)患者合并DKD[1]。DKD 漏诊率高,严重影响到早期诊断及治疗,DKD 筛查指标受到越来越多的关注。既往研究[2,3]显示同型半胱氨酸 (homocysteine,HCY) 以及炎性因子与DKD 的发生发展联系密切。本研究旨在分析T2DM 患者血清HCY、 肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、 白细胞介素6(interleukin 6,IL-6) 水平与DKD 发生发展的相关性,为DKD 的早期诊断提供依据。
1 资料与方法
1.1 临床资料
选取2019年2月~2020年4月中日友好医院内分泌科和肾内科T2DM 住院患者304 例,其中男204 例、女100 例;年龄32~90 岁,中位数年龄62 岁。分为单纯T2DM 组(147 例)和DKD 组(157 例)。T2DM的诊断依据世界卫生组织(WHO)1999年公布的诊断标准,DKD 的诊断和分期依据中国糖尿病肾脏疾病防治临床指南[4]。排除标准:妊娠状态;合并自身免疫性疾病;合并肿瘤;合并严重感染性疾病;近期遭受巨大创伤;营养不良等。根据尿微量白蛋白/肌酐比值(urinary albumin/creatinine ratio,UACR),将DKD 患者分为2 个亚组:UACR 3~30 mg/mmol 为微量白蛋白尿组,UACR>30 mg/mmol 为大量白蛋白尿组。本研究经过医院伦理委员会批准(2016-59),研究对象或监护人已签署知情同意书。
1.2 研究方法
收集患者年龄、性别、BMI、糖尿病病程、血压等基础资料。患者空腹>8h,次日清晨采集静脉血样本。尿微量白蛋白检测采用免疫比浊法,HCY检测采用循环酶法,检测仪器为美国贝克曼库尔特公司的Beckman Coulter AU5800 全自动生化分析仪。肾小球滤过率(eGFR)计算使用CKDEPI 公式。TNF-α、IL-6 检测采用化学发光法,检测仪器为德国西门子公司的IMMULITE 1000 化学发光免疫分析仪。
1.3 统计学方法
应用SPSS22.0 统计软件。计数资料组间比较采用χ2检验。符合正态分布的计量资料采用x-±s表示,组间比较采用独立样本t 检验。非正态分布的计量资料以四分位数间距用M(Q1,Q3)形式表示,组间比较采用Mann- Whitney U 检验。采用Spearman 相关进行相关性分析。
2 结果
2.1 T2DM 组与DKD 组患者的临床情况
表1 示,DKD 组患者糖尿病病程、BMI、 收缩压、HCY、TNF-α、IL-6 水平均显著高于T2DM 组(均P<0.05)。
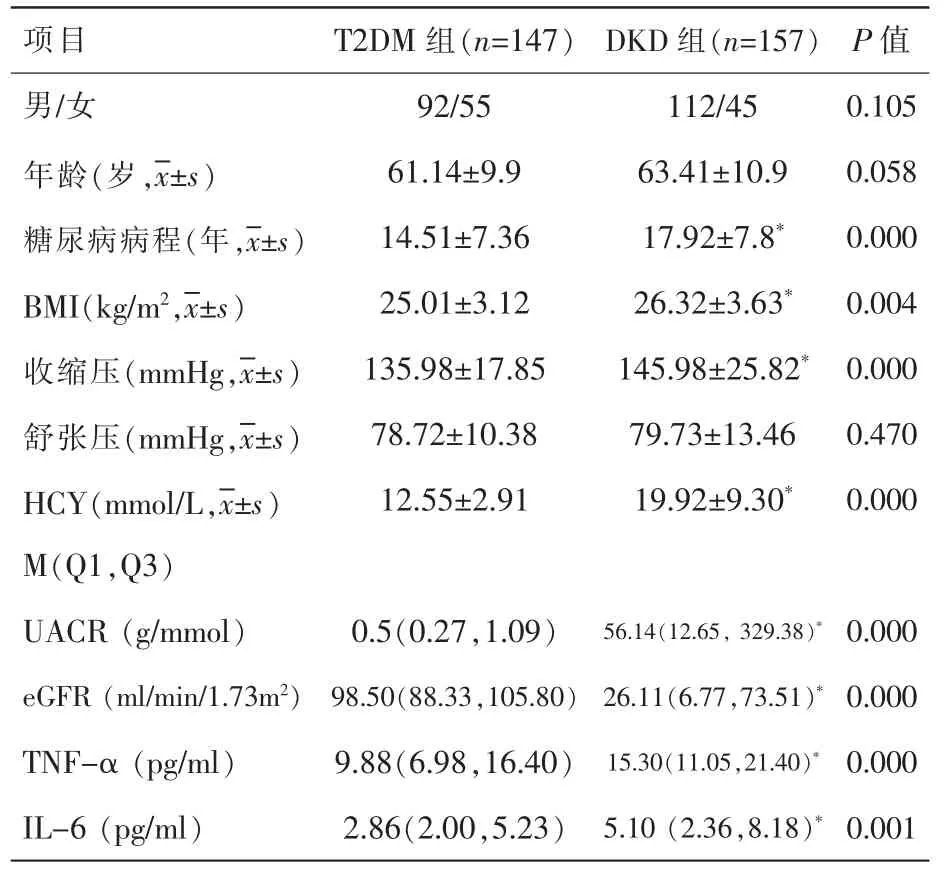
表1 T2DM 组与DKD 组患者临床资料比较
2.2 DKD 组HCY、IL -6、TNF -α 与UACR 及eGFR 的相关性分析
对157 例DKD 组患者进行Spearman 相关性分析显示,HCY、IL-6、TNF-α 水平与UACR 存在正相关,r 值分别为0.305,0.199,0.272 (均P<0.05);而与eGFR 存在负相关,r 值分别为-0.668,-0.212,-0.268(均P<0.05)。
2.3 DKD 患者亚组结果比较
表2 示,DKD 患者大量蛋白尿组HCY、TNFα、IL-6 水平高于微量蛋白尿组(均P<0.05)。

表2 DKD 患者亚组的HCY、TNF-α、IL-6 水平比较
3 讨论
DKD 是T2DM 最常见的并发症之一,早期诊断、预防及延缓DKD 的发生发展对延长患者的寿命、改善其生活质量具有重要的意义。研究发现,DKD 患者拥有较长的T2DM 病程并且收缩压、BMI 较T2DM 患者明显升高,提示我们对于DKD的防治应及早筛查,重视对传统DKD 危险因素的干预。多项研究显示良好的生活方式、积极的健康管理可以降低DKD 的发生、降低死亡风险[5]。
3.1 HCY 水平与DKD 的关系
同型半胱氨酸(HCY)是蛋氨酸和半胱氨酸的代谢产物,在人体内处于恒定水平。高水平的HCY 被认为是DKD 的独立危险因素。研究发现DKD 患者HCY 水平明显高于T2DM,与既往研究一致[2,6]。Lu 等[7]研究发现,HCY 可引起肾小球系膜细胞、足细胞以及裂隙膜的损伤,而这些损伤可导致肾小球硬化和肾功能下降。高水平的HCY 导致T2DM 患者肾脏损伤的机制尚不完全明确。目前认为HCY 水平升高会导致氧自由基和过氧化氢的生成增加,激活NADPH 氧化酶,降低血管内皮细胞一氧化氮的活性,抑制细胞内抗氧化酶的活性,进而引起肾脏细胞的损伤。Tyagi 等[8]在基础实验研究中发现,HCY 可浓度-时间依赖性地上调NADPH 酶mRNA 的表达及活性氧的产生,进而增强氧化应激反应。同时发现,HCY 也可成为一种炎症刺激物,增强炎性反应。HCY 能促进平滑肌细胞、 内皮细胞、单核细胞等分泌炎性因子,如TNF-α,IL-6、单核细胞趋化蛋白-I 等。本研究中分析发现,DKD 患者血清HCY 水平与UACR及eGFR 水平存在相关性。UACR 及eGFR 为监测患者肾脏功能最常用的筛查指标,可用来检查患者病情的进展。而HCY 水平与其相关提示我们将HCY 水平纳入对患者疾病进展的评估。同时进一步亚组分析发现,大量蛋白尿组患者HCY 水平高于微量蛋白尿组,提示DKD 患者HCY 水平随着病情发展严重程度逐渐升高。综合以上研究结果不难发现,患者HCY 水平与DKD 的发生发展密切相关,HCY 有望成为DKD 筛查指标。
3.2 TNF-α 水平与DKD 的关系
近年研究[9,10]认为,微炎症状态在DKD 发生发展中起到重要的作用。在DKD 的早期阶段,巨噬细胞和T 细胞即可在肾小球及其间质聚集浸润。免疫细胞和肾脏固有细胞相互作用,促进TNF-α、IL-6、IL-1 等炎性因子分泌,参与了DKD的病理过程。其中TNF-α 主要由单核巨噬细胞合成,可通过与相应受体的结合激活细胞内转导通路并产生生物效应,是DKD 肾脏微炎症的主要诱导因子和驱动因子,在炎性因子网络中心处于中心地位[11]。本研究发现DKD 患者TNF-α 水平明显高于T2DM 组,并且与DKD 患者肾脏功能指标UACR 和eGFR 存在相关,提示TNF-α 水平与DKD 的发生和进展存在相关性。同时进一步亚组分析中发现,大量蛋白尿组患者TNF-α 水平明显高于微量蛋白尿组,提示随着DKD 患者疾病进展严重,TNF-α 水平明显升高。使用TNF-α 来辅助诊断DKD 患者病情可成为临床新的思路。
3.3 IL-6 水平与DKD 的关系
IL-6 由内皮细胞、白细胞、脂肪细胞和系膜细胞等产生,起核心调节作用。独特的受体系统介导的IL-6 信号机制,参与许多基因转录[12,13],可促进系膜细胞增殖、 增强细胞外基质的扩散与过度传导,从而改变血管通透性,同时加速肾小球基膜增厚,引起肾脏功能及结构的异常。既往研究[12]观察到DKD 大鼠肾皮质中IL-6 的mRNA 基因表达及尿中IL-6 水平均显著增加,且其增加的程度与肾损伤程度呈正相关,可造成肾小球滤过膜通透性异常、系膜细胞肿胀、纤维连接蛋白表达增强。本研究发现DKD 患者IL-6 水平明显高于T2DM 组,且与UACR、eGFR 水平相关。同时亚组分析中发现,大量蛋白尿组患者IL-6 水平明显高于微量蛋白尿组,提示IL-6 预示DKD 的发生发展的价值。
DKD 的发生会给患者带来巨大的生活负担,而且疾病的进展具有不可逆性。早期诊断、预防与延缓DKD 的发生发展至关重要。DKD 的确诊金标准为肾脏穿刺病理检查,但因其操作带有损伤性,无法普及。经典的筛查指标也存在一定的局限性,寻找新的DKD 的风险指示指标显得尤为迫切。本研究中发现DKD 与T2DM 患者HCY、TNF-α、IL-6 水平存在明显差异,同时与经典的筛查指标UACR、eGFR 存在相关性。提示HCY、TNF-α、IL-6 水平与DKD 及其进展密切相关。本研究样本量偏小,临床推广仍需要大样本量进行验证,但本研究提供了新的思路。对于糖尿病患者加强血清HCY、TNF-α、IL-6 的检测有助于预测DKD 的风险,及时评估患者的肾脏状态,值得引起临床的关注。
