含过渡金属镉或汞的四元硫化物的溶剂热合成及性能
2021-12-09舍乐木格杜翠霞田昕雨白音孟和
舍乐木格 杜翠霞 田昕雨 白音孟和
(内蒙古师范大学化学与环境科学学院,呼和浩特 010022)
0 引言
近年来,硫属化合物由于其结构的多样性而受到了广泛研究,并在半导体、热电、光学、磁性等领域具有潜在的应用前景。如在半导体3D-ABaSbQ3(A=Li、Na,Q=S、Se)[1]中,4种化合物结晶成不同的结构:NaBaSbS3、NaBaSbSe3(P21/c)和 LiBaSbS3、LiBaSb-Se3(Pbam)。单晶热电材料α-CsCu5Se3[2]具有独特的三维网络结构,由于其极低的晶格热导率,在980 K时品质因数(ZT)高达1.3;3D-LiGaGe2Se6[3]和2DLn4GaSbS9(Ln=Sm、Gd、Tb、Dy)[4]化合物在红外区表现出非线性光学(NLO)响应;而近期有研究者发现了新型的Cs2[Mn2Ga3S7Cl][5]和Cu2MgSn3S8[6]硫属化合物均表现出显著的反铁磁(AFM)行为。起初研究者们将一些[SbxQy]n-阴离子与不饱和过渡金属配合物结合形成M1-Sb-Q(Q=S、Se)三元硫属化合物(M1=Cu、Zn、Cd、Hg、Ga、Sn),如 [Mn(C4H13N3)2]n[ZnSb2Se5]n[7]、[Zn(tren)]2CdSb2Se6[8]、[Mn(tren)]CdSb2Se5[8]、[Fe(tren)]Cd2SbSe5[8]、[Co(en)3]Hg2Sb2S6[9]、[Ni(1,2-dap)3]2HgSb3S7Cl[9]、[Ni(1,2-dap)3]HgSb2S5[9]、[Mn(dien)2]HgSb2S5[9]、[TM(tren)]HgSb2S5(TM=Mn、Fe、Co)[9]、[TM(dien)2]Hg3Sb4S10(TM=Mn、Co、Ni)[9]、[Ni(1,2-pda)3]HgSb2Se5[10]、[Mn(dien)2]HgSb2Se5[10]、[Ni(en)3]Hg2Sb2Se6[10]、[Ni(en)(teta)]Hg2Sb2Se6[10]、[Ni(pda)2]Cu4Sb2S6[11]、[Ni(dien)2]CuSb3S6[11]、[TM(en)3][SnSb4S9](TM=Ni、Co)[12]、[CH3NH3]4Ga4SbS9S0.28O0.72H[13]。当质子化有机阳离子或过渡金属配合物被碱金属或碱土金属离子所取代,形成AM1-Sb-Q(A=碱金属或碱土金属)结构的化合物相对较少,如采用溶剂热法、助溶剂法和高温固相法合成 的 M3Ag9Sb4S12(M=K、Cs、Rb)[14]、ACu2SbS3(A=K、Rb、Cs)[15]、BaAgSbS3[16]、MHgSbSe3(M=K、Rb、Cs)[17]、KHgSbS3[18]、RbHgSbTe3[19]、K2MSbS3(SH)(M=Zn、Cd)[20]、A2Sb2Sn3S10(A=K、Rb、Cs)[21、]Ba23Ga8Sb2Se38[22、]RbCuSb2Se4·H2O[23]。通过高温固相法或助溶剂法合成的硫属化合物的结构相对简单,这是由于在高温条件下,成键原子形成简单的链或环而不能进一步参与形成复杂结构。因此,温和的溶剂热法特别适合于合成新的硫属化合物。
为了丰富多元锑硫属化合物的结构和种类,我们利用溶剂热法在1,2-丙二胺和水的混合体系中,成功合成了2种含过渡金属镉或汞的四元硫化物Rb2CdSbS3(SH)(1)和 Rb2HgSb4S8(2),并对其进行了一系列性能研究。
1 实验部分
1.1 试剂与仪器
S(天津市化学试剂三厂,分析纯)、HgI2(河北邢台化学试剂有限公司,分析纯)、CdI2(上海公私合营恒心化工社,分析纯)、Sb2S3(阿拉丁,分析纯)、Rb2CO3(Alfa Aesar,99%)、1,2-丙二胺(国药集团化学试剂有限公司,99.0%)未经进一步纯化,直接使用。
利用日立F-3400N型扫描电子显微镜(SEM)观察化合物1和2的形貌并进行能谱分析(EDS),工作电压为20 kV。用Rigaku XRD-6000型X射线粉末衍射仪(日本岛津)对产物的物相进行X射线衍射(XRD)分析,管压为40 kV,管流为40 mA,Cu靶Kα射线辐射(λ=0.154 184 nm),扫描范围为5°≤2θ≤75°,通过与单晶衍射数据计算结果对比来确定产物纯度。差热分析(DTA)采用DTG-60H型分析仪(日本岛津公司),升温速率为10 ℃·min-1,N2气氛保护,加热温度范围为25~800℃。差示扫描量热分析(DSC)采用200 F3 Maia型分析仪,升温速率为10℃·min-1,N2气氛保护,加热温度范围为25~600℃。FT-IR光谱在Nicolet 6700红外光谱仪上测试,用溴化钾与样品粉末压片。紫外可见漫反射(UV-Vis DRS)光谱在Shimadzu UV-2550型(日本)双光束紫外可见分光光度计上进行测量,BaSO4作参比,波长扫描范围为220~800 nm,积分球直径为27 mm,所测得数据用Kubelka-Munk函数α/S=(1-R)2/(2R)转换,其中R为给定能量下的反射率,α为吸收系数,S为散射系数[24]。X射线光电子能谱(XPS)分析采用Thermo Scientific ESCALab250xi型分析仪。采用日立F-2600荧光分光光度计在室温下测定了荧光性质,操作范围为250~900 nm。
1.2 制 备
将 Rb2CO3(24 mg,0.1 mmol)、Sb2S3(34 mg,0.1 mmol)、S(13 mg,0.4 mmol)、CdI2(36.6 g,0.1 mmol)混合后放入厚壁玻璃管中,再加入533 mg 1,2-丙二胺和175 mg H2O混合溶剂,在酒精喷灯上封管(填充率约为10%)。之后将密封的厚壁玻璃管放入不锈钢反应釜中置于140℃烘箱内加热7 d。冷却至室温,将产物分别用无水乙醇和蒸馏水进行洗涤,可获得黄色块状化合物1。化合物1在空气或乙醇中可以稳定存在。将制备化合物1时所用的CdI2替换成HgI2(45 mg,0.1 mmol),在其他条件不变的情况下合成了黄色长条状化合物2,化合物2在空气或乙醇中可以稳定存在。化合物1的产量为36.7 mg;化合物2的产量为32.4 mg。
1.3 结构测定
化合物1和2单晶尺寸大小分别为0.17 mm×0.08 mm×0.02 mm和0.22 mm×0.19 mm×0.15 mm,分别在293(2)和296(2)K下,采用Bruker Apex-Ⅱ型CCD衍射仪采集了衍射数据,衍射仪采用石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm),全部数据经Lp校正和经验吸收校正。晶体结构采用直接法解出,全部非氢原子坐标及各向异性热参数用全矩阵最小二乘法修正,化合物1中的氢原子是通过红外光谱分析确定。所有结构计算工作用Olex2程序[25]完成。有关化合物1和2的晶体学数据列于表1,部分键长和键角数据列于表2。

表1 化合物1和2的晶体学数据和结构精修参数Table 1 Crystal data and structure refinement parameters for compounds 1 and 2
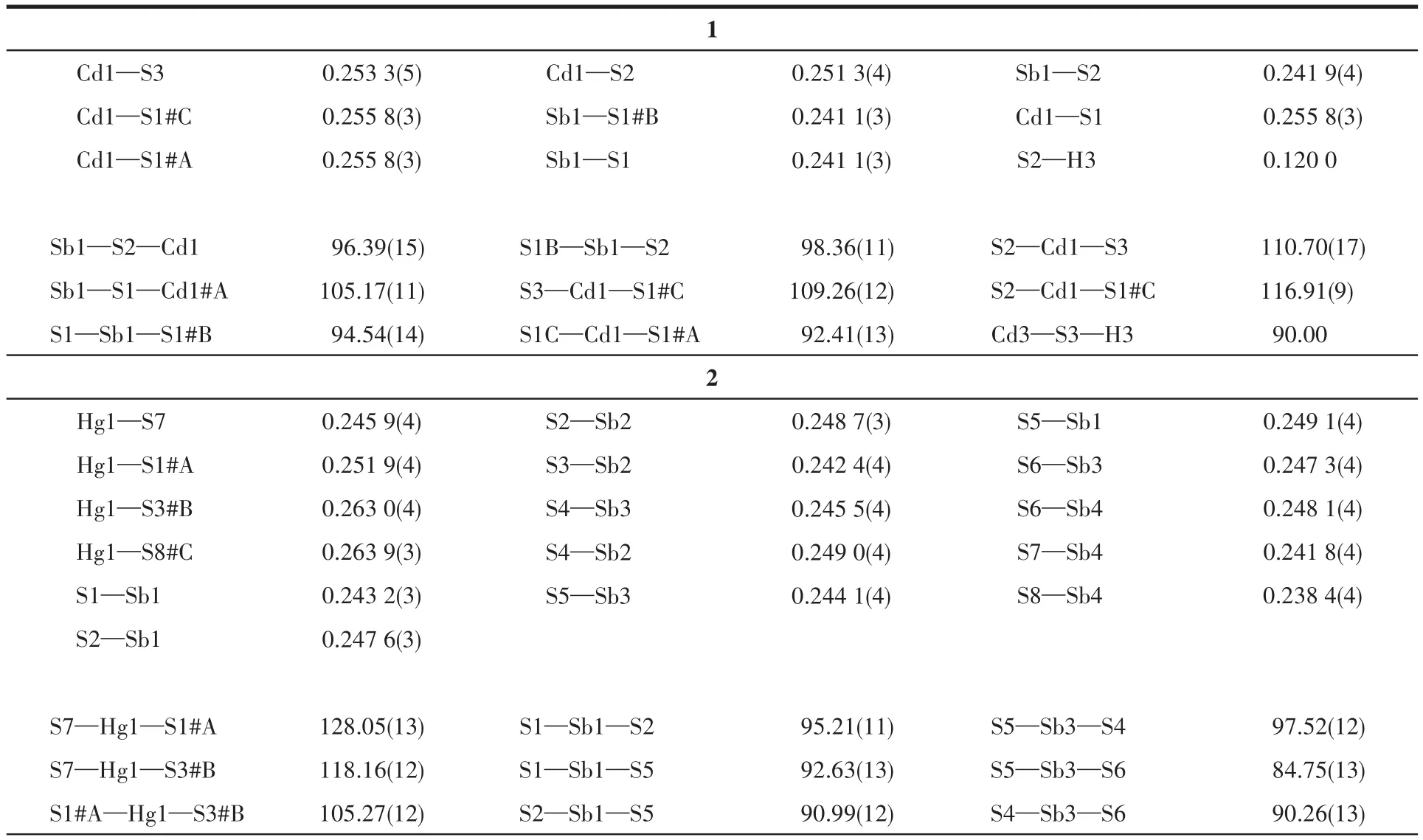
表2 化合物1和2的部分键长和键角Table 2 Selected bond lengths(nm)and angles(°)for compounds 1 and 2

续表2
CCDC:2040556,1;2040557,2。
2 结果与讨论
2.1 扫描电镜和能谱分析
化合物1和2的SEM图和EDS图见图S1~S4(Supporting information)。从能谱分析图可知,化合物1中的所有目标元素都存在,且各原子物质的量之比nRb∶nCd∶nSb∶nS=22.45∶13.56∶13.56∶51.67;化合物2中的所有目标元素都存在,且各原子物质的量之比nRb∶nHg∶nSb∶nS=12.72∶5.70∶25.40∶56.18。
2.2 结构描述
化合物1的分子结构椭球图见图1。X射线单晶衍射结果表明,1属于单斜晶系,空间群为P21/m。其结构为一维链状结构,由[CdSbS3(SH)]2-和Rb+组成(图2)。其中,Sb原子与3个S原子配位形成三角锥SbS3,Sb—S 键长在 0.241 1(3)~0.241 9(4)nm 之间,S—Sb—S 键角在 94.54(14)°~98.36(11)°之间(表 2);Cd原子与4个S原子配位形成四面体结构CdS4(其中S3原子上连着一个氢原子),Cd—S键长在0.251 3(4)~0.255 8(3)nm 之间 ,S—Cd—S键 角在92.41(13)°~116.91(9)°之间(表2)。Sb—S、Cd—S键长与化合物K2CdSbS3(SH)[20]和A2CdSn3S8(A=Cs、Rb、K、Na)[21]中的键长相似。2个SbS3三角锥和2个CdS4四面体交替连接形成[Cd2Sb2S8(SH)2]4-八元环(图3),而相邻的八元环之间通过共享2个S1原子进一步连接,沿着b轴方向形成一维[CdSbS3(SH)]n2n-阴离子链,Rb+阳离子位于链与链之间。化合物1中出现的一 维 链 与 [Cd2Sb2S6(SH)2]4-[20]、[In2Sb2S8]n4n-[26]、[HgAsSe3]nn-[27]、[Hg2M2S8]4-(M=Sn、Ge)[28]链相似。

图1 化合物1的椭球概率30%分子结构图Fig.1 Molecular structure of compound 1 with 30% probability ellipsoids

图2 化合物1沿a和b轴的结构示意图Fig.2 Schematic diagram of compound 1 along a and b axes
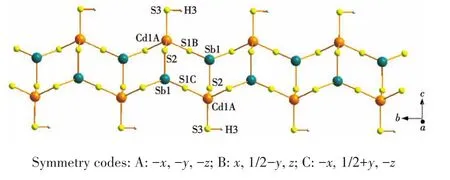
图3 化合物1沿b轴方向无限延伸的一维[CdSbS3(SH)]n 2n-阴离子链Fig.3 One-dimensional[CdSbS3(SH)]n 2n-anion chain extending infinitely along b axis of compound 1
对于化合物2,其分子结构椭球图见图4。X射线单晶衍射结果表明,2属于三斜晶系,空间群为。其结构为二维层状结构,由[HgSb4S8]2-阴离子和Rb+阳离子组成(图5)。其中,Sb原子与3个S原子配位形成SbS3三角锥,Sb—S键长在0.238 4(4)~0.249 1(4)nm范围内,S—Sb—S键角在84.75(13)°~99.64(12)°范围内(表2);Hg原子与4个S原子配位形成 HgS4四面体,Hg—S 键长在 0.245 9(4)~0.263 9(3)nm范围内,S—Hg—S键角在96.05(11)°~128.05(13)°范围内(表2),这些Sb—S、Hg—S键长与BaAgSbS3[16]、Cs2HgSb4S8[29]化合物中的键长相似。SbS3三角锥和HgS4四面体通过共享角连接形成[SbHgS5]n5n-链(图6a),3个SbS3三角锥通过共享角连接形成[Sb3S3]六元环(图 6b),而[SbHgS5]n5n-链与[Sb3S3]六元环通过共享S原子连接形成[HgSb4S8]n2n-带(图 6c),[HgSb4S8]n2n-带又通过共享S原子进一步连接,形成平行于ab平面的二维层状结构(图6d),Rb+阳离子位于层与层之间。虽然都是以Rb+阳离子作为结构导向剂,但化合物1和2分别形成了一维链状和二维层状结构。

图4 化合物2的椭球概率30%分子结构图Fig.4 Molecular structure of compound 2 with 30% probability ellipsoids

图5 化合物2的二维层状结构Fig.5 Two-dimensional layered structure of compound 2
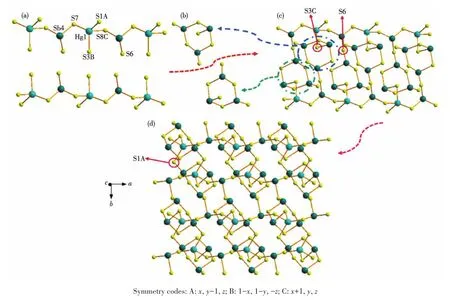
图6 化合物2的[SbHgS5]n5n-链 (a)、Sb3S3六元环 (b)、[HgSb4S8]n2n-带(c)和平行于ab平面的二维层状结构(d)Fig.6 [SbHgS5]n5n-chain(a),Sb3S3six-membered ring(b),[HgSb4S8]n2n-ribbon(c)and 2D layered structure parallel to ab plane(d)of compound 2
2.3 XRD分析
图7a和7b分别为化合物1和2的XRD图。从图中可知,1和2的主要衍射峰的位置与单晶数据拟合的结果基本一致,由此可以确定化合物1和2均为纯相。
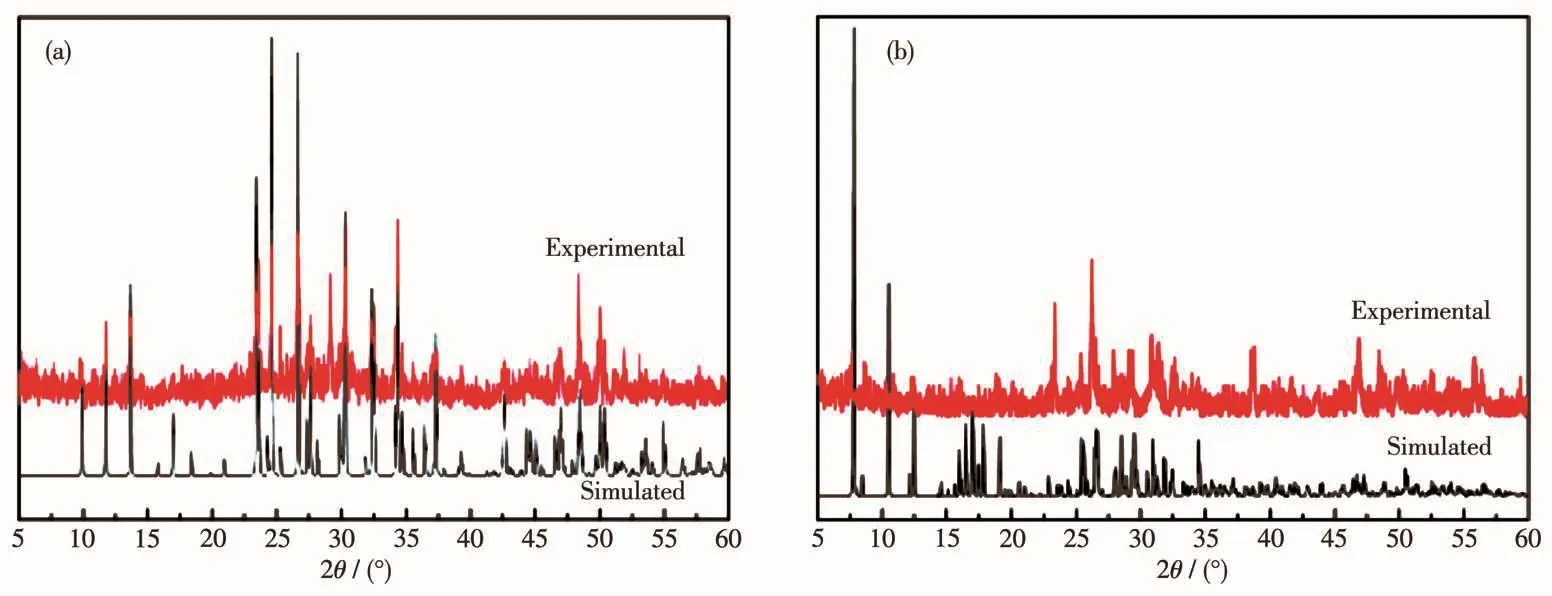
图7 化合物1(a)和2(b)的XRD图Fig.7 XRD patterns of compounds 1(a)and 2(b)
2.4 化合物1的XPS分析和红外光谱分析
由于Sb离子可以Sb3+和Sb5+的形式存在,因此我们对化合物1进行了XPS分析(图8、9)。如图9a所示,结合能为537.85和528.41 eV的峰分别对应Sb3+的 3d3/2和 3d5/2,这与 Sb2Se3[30]中的结合能相一致,因此,化合物1中Sb离子为+3价。图9b中结合能为410.67和403.91 eV的峰分别对应Cd2+的3d3/2和3d5/2。图9c中结合能为160.77和160.05 eV的峰分别对应S2-的2p1/2和2p3/2。图9d中结合能为111.21和110.47 eV的峰分别对应Rb+的3d3/2和3d5/2。因此,化合物 1中的 Rb、Cd、Sb、S的价态分别为+1、+2、+3、-2。为了证明化合物1中巯基的存在,进行了红外光谱分析。如图10所示,在2 541 cm-1处的吸收峰是由S—H伸缩引起的,这与硫醇和半胱氨酸中的2 590 cm-1处的S—H的吸收峰相似[31-32],这一结果表明确实存在巯基—SH。
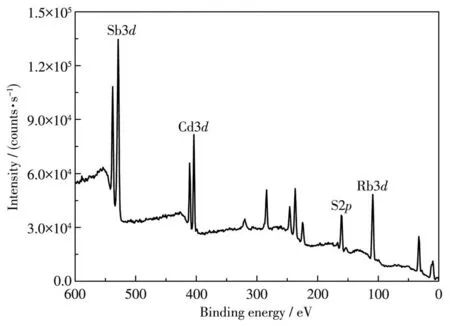
图8 化合物1的XPS谱图Fig.8 XPS spectra of compound 1

图9 化合物1中的Sb3d(a)、Cd3d(b)、S2p(c)和Rb3d(d)的XPS谱图Fig.9 XPS spectra of Sb3d(a),Cd3d(b),S2p(c)and Rb3d(d)of compound 1
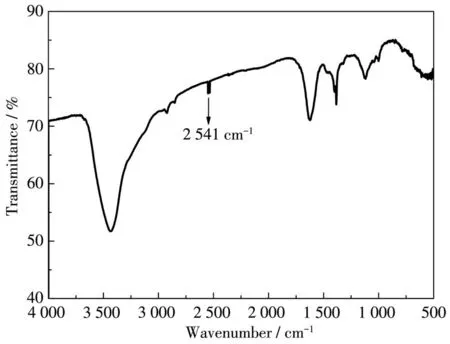
图10 化合物1的红外光谱图Fig.10 IR spectrum of compound 1
2.5 DTA和DSC分析
在通入N2的条件下从25到800℃对化合物1进行DTA分析,得到的DTA曲线如图11a所示。化合物1在420和470℃处均具有明显的吸热峰。在通入N2的条件下从25到500℃对化合物2进行了DSC分析(图11b),由图可见,化合物2在324和340℃处有明显的吸热峰。这2个化合物均出现吸热峰的主要原因可能是发生塌陷形成了无定型物质[33]。
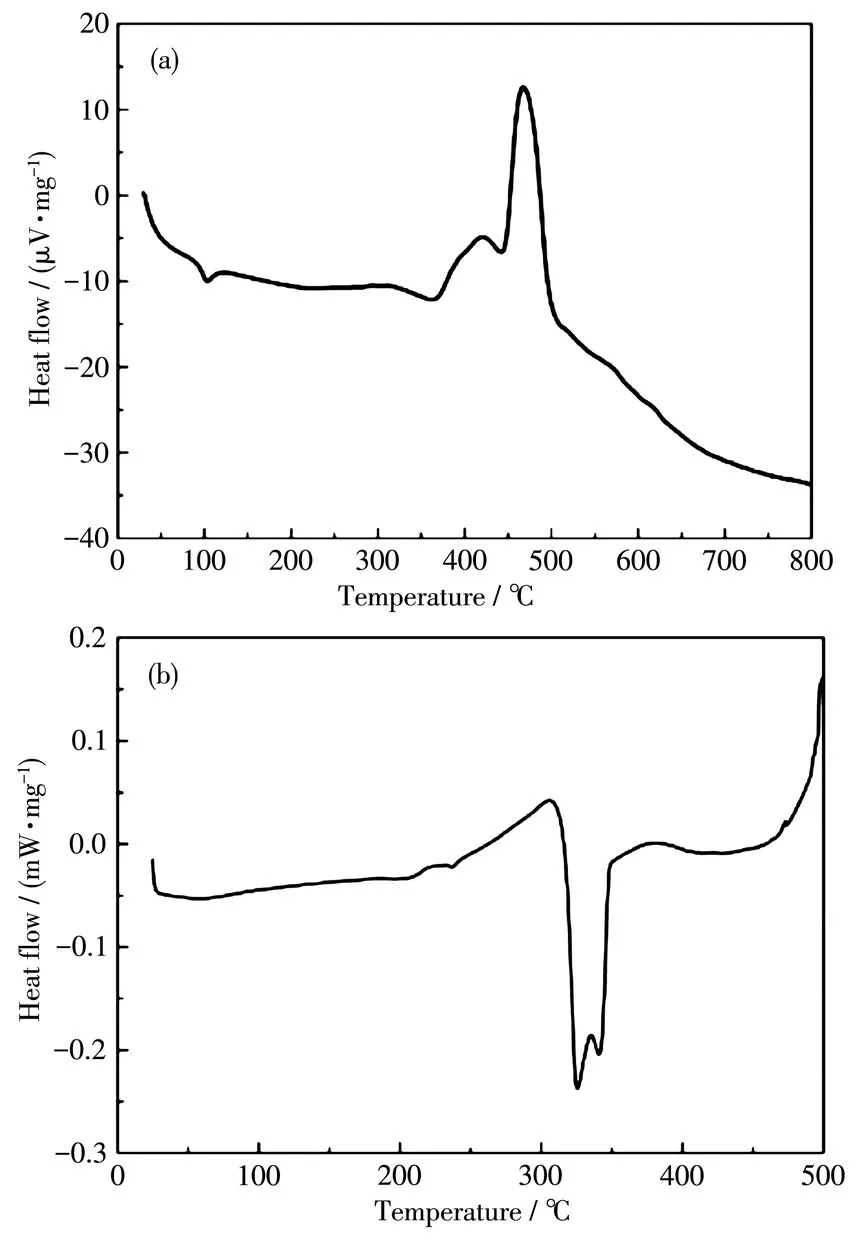
图11 化合物1的DTA曲线(a)和化合物2的DSC曲线(b)Fig.11 DTA curve of compound 1(a)and DSC curve of compound 2(b)
2.6 UV-Vis DRS分析
在室温下对化合物1和2分别进行了固体UV-Vis DRS分析。如图12a和12b所示,化合物1和2的带隙分别为2.06和2.15 eV,这与晶体颜色一致。这些数值与其他已报道的含过渡金属镉或汞的多元锑硫属化合物[Mn(phen)]2HgSb2S6(phen=1,10-菲咯啉,2.08 eV)[16]、K2CdSbS3(SH)(2.71 eV)[20]、Cs2HgSb4S8(2.13 eV)[28]、[enH2]0.5HgSbS3(2.49 eV)和[Ni(en)3]0.5HgSb S3(2.68 eV)[34]相类似,因此化合物1和2均具有半导体性质。
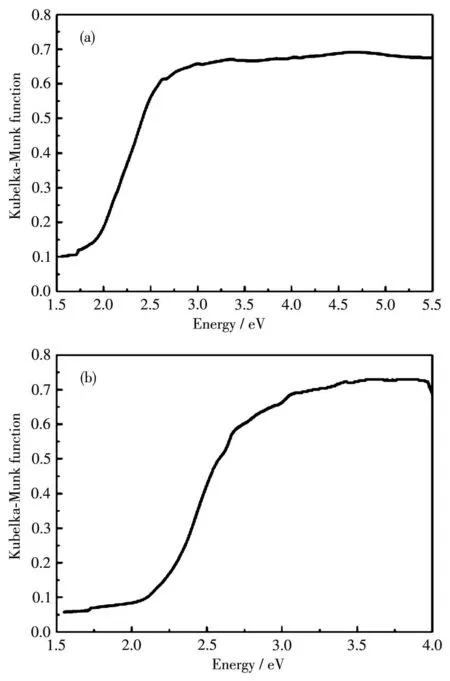
图12 化合物1(a)和2(b)的固体UV-Vis DRS谱图Fig.12 Solid-state UV-Vis DRS spectra of compounds 1(a)and 2(b)
2.7 荧光分析
如图13a和13b所示,当化合物1和2的激发波长分别为452和374 nm时,在599和551 nm处分别观察到较强的发射峰,峰值接近化合物1(2.06 eV)和2(2.15 eV)的带隙值。与文献报道的硫属化合物相比显示相似的荧光发射特性,如Ba8Zn4Ga2S15(黄色,593 nm)[35]、ACd4Ga5S12(A=K、Rb、Cs)(黄色,584~595 nm)[36]、Ba6Zn7Ga2S16(黄色,600 nm)[37]、BaCdSnS4(黄色,530 nm)和 Ba3CdSn2S8(黄,530 nm)[38]。因此,化合物1和2的发光区域均在黄光区,具有黄光发射特性。
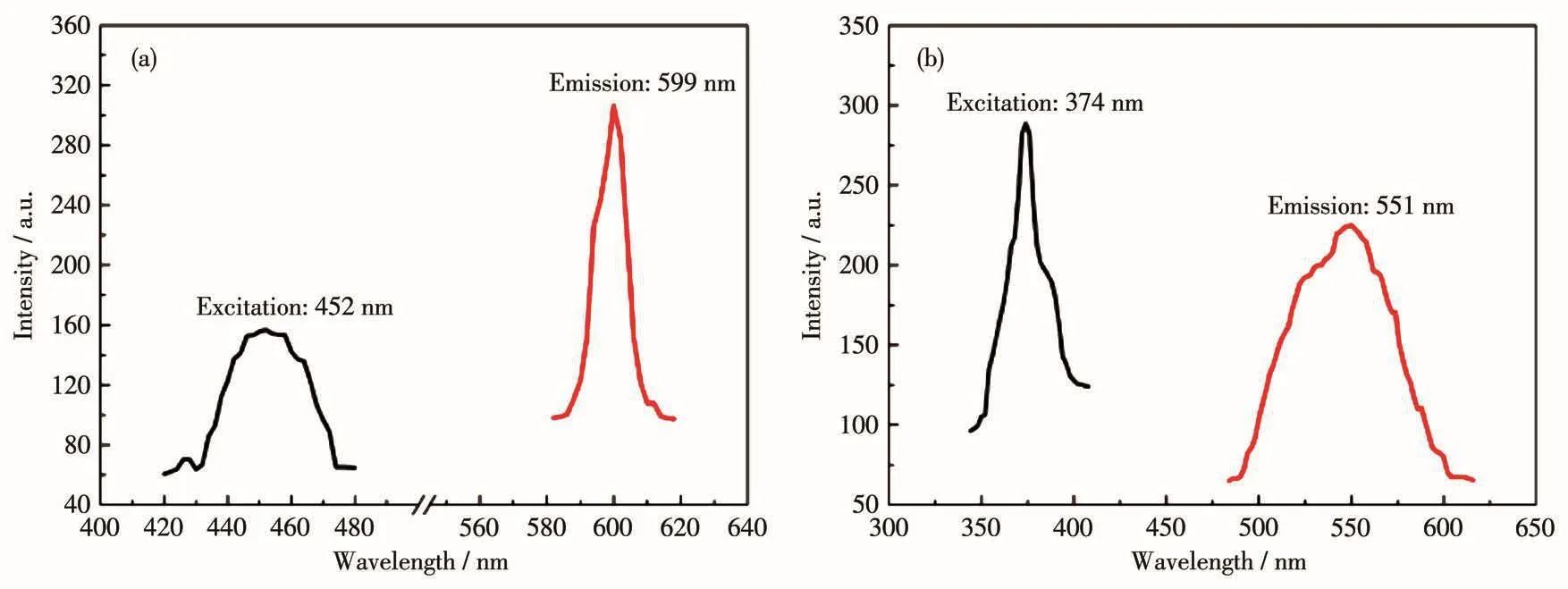
图13 化合物1(a)和2(b)的激发光谱和发射光谱图Fig.13 Excitation and emission spectra of compounds 1(a)and 2(b)
3 结论
综上所述,化合物1和2的成功合成表明,在1,2-丙二胺和水的溶剂热体系中可能获得更多的新型四元硫化物,这对于丰富硫属化合物的结构具有重要作用。对化合物1和2进行固体UV-Vis DRS分析的结果表明其均具有半导体性质,而荧光分析表明,化合物1和2均具有黄光发射特性。
Supporting information is available at http://www.wjhxxb.cn
