Gutmann规则及其应用
2016-01-09吕仁庆,赵欣,罗立文等
Gutmann规则及其应用
吕仁庆,赵欣,罗立文,于剑锋
(中国石油大学 (华东)理学院化学系,山东青岛266580)
[摘要]Gutmann将Lewis酸碱电子理论中的授体-受体相互作用的概念扩展推广到任何分子之间的相互作用研究中,结合计算量子化学方法,总结出了Gutmann规则.该规则不仅适用于两个分子之间的相互作用的研究中,还可以研究固相、液相和界面的相互作用.
[关键词]Lewis 酸碱理论;Gutmann规则;应用[收稿日期]2015-08-15
[基金项目]山东省教育厅资助项目(项目编号:2012149),大学化学改革立项项目(项目编号:KS-B201413).
[作者简介]吕仁庆(1969-),男,山东莱阳人,中国石油大学(华东)理学院化学系副教授,理学博士,主要从事无机及分析化学的教学及理论化学研究工作.
[中图分类号]O641.3 [文献标识码]A
0引言
1923年,美国著名化学家Lewis定义接受电子对的物质为酸,即酸为电子对受体(acceptor);给出电子对的物质为碱,即碱为电子对授体(donor).所谓的Lewis酸碱反应就是受体-授体相互作用形成加合物(adduct)的过程.Gutmann将受体-授体相互作用的概念扩展应用到任何分子间的相互作用,结合量子化学分析方法,得出了结构变化的规律,称为Gutmann规则[1-3].
1Gutmann规则
1.1第一键长变化规则(the first bond length variation rule)

图1 NH3与F2形成的络合物的电荷分布 图2 第一键长变化规则示意图
首先考察一个典型的受体-授体反应,D + A = D(A,在反应过程中,由于电荷转移和极化效应,电荷必然发生重排(rearrangement).如NH3与F2发生相互作用,从NH3向F2转移0.0483e(如图1),F(1)受体原子显示少量的正电荷(+0.0181),这是由于F(1)的负电荷溢出效应(spillover effect of negative charge)所致,而F(2)原子得到了少量的负电荷(-0.0664).授体N原子上失去的负电荷可以由吸引端基H原子的电荷作为补偿.授体N原子上负电荷的增大称为堆积效应(pileup effect).这种情况下,与授体-受体相互作用的紧邻的化学键(如N-H键、F-F键)发生了极化作用,键长增长,由此可以得到第一键长变化规则(the first bond length variation rule),即分子间相互作用的距离与其紧邻的授体、受体分子内键长具有相反的关系,也就是说,分子间相互作用的的距离越短,与其紧邻的化学键的键长越长,反之亦然,如图2所示.箭头表示电荷转移的方向及键长增长的化学键.第一键长变化规则还表现在晶体水合物中分子内O-H键长与分子间O-O相互作用的距离的关系上(如图3所示).由图3可以看出,分子间相互作用的距离(O-O)与分子内O-H键的键长彼此相关.O-O分子间的相互作用导致与其紧邻的分子内化学键键长的增长,且O-O相互作用的距离越短,化学键的键长增长就越大.另一个例子就是羰基化合物(如图4所示),金属-碳之间的距离视为分子间相互作用距离,而与其紧邻的C-O键受到影响,M-C作用距离越短,C-O键长就越长.


图3 晶体水合物中分子内O-H键长与分子间O-O相互作用距离的关系图4 铁的羰基配合物中F-C距离与C-O键长之间的关系
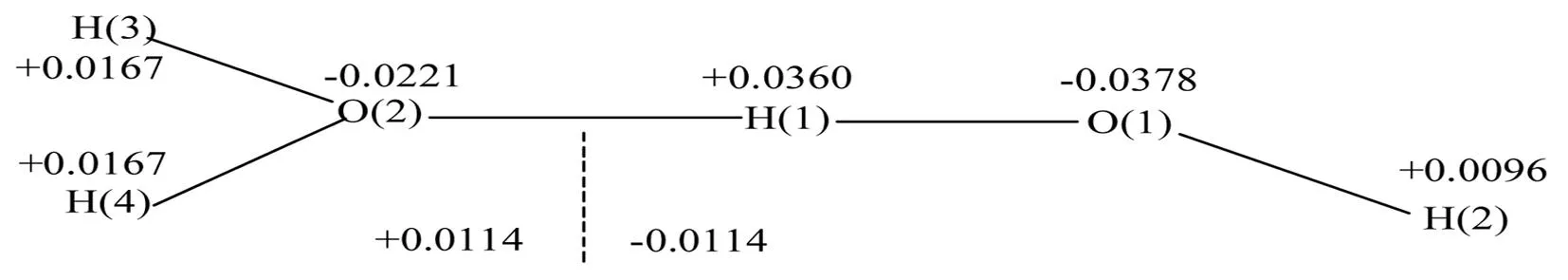
图5 水的二聚体的电荷分布图

图6 水分子二聚体的键长变化示意图
1.2第二键长变化规则(the second bond length variation rule)
键长变化不仅仅局限在与分子间相互作用的原子的紧邻的化学键,由于紧邻的化学键键长的变化导致电荷的重新分布,从而影响到其周围其它化学键的变化.若电荷从电负性小的原子转移到电负性大的原子时,这个化学键的键长要增长,相反,电荷从电负性大的原子转移到电负性小的原子,所对应的键长要缩短,这就是第二键长变化规则(the second bond length variation rule).在分子体系中,原子的电负性大小是交替分布的,所以键长的增长和缩短也是交替分布的.以水的二聚体加以说明(图5),由图5可见,水的二聚体的H原子的化学环境不再相同.授体中的两个H原子H(3)和H(4)的正电性比单体水分子中的两个H原子的正电性增强,受体中H(1)原子带有更多的正电荷,由于溢出效应(spillover effect)所致,而受体中的端基H(2)原子的正电荷变小.O-H键及O原子的化学环境也不相同,O(1)原子的负电荷比O(2)原子的负电荷更多,而H(3)-O(2)、H(4)-O(2)和H(1)-O(1)的键长增长(电荷从较小电负性的H原子转移到电负性较大的O原子),而O(1)-H(2)键长缩短(电荷从电负性较大的O原子转移到电负性较小的H原子).键长的变化规律可以通过图6表示(实箭头表示键长变长,虚箭头表示键长缩短).另一个例子就是如图7所示的乙酰胺的溶剂化效应.由图7可见,授体攻击发生在N-H键的H原子上,而受体攻击发生在C=O基团的O原子上.随着溶剂授体数量的增多,N-H键的键长增长越大;而C=O键的增长与溶剂受体数量有关,溶剂受体数量越多,C=O键的键长增长越明显.两种作用的结果均造成C-N键长的缩短(实线弯曲箭头表示表示电子转移的方向和相应键的键长增长,虚线弯曲箭头表示电子转移的方向和相应键的键长缩短).
2Gutmann规则的应用
2.1固体中结构变化特点
Gutmann规则不局限在授体-受体相互作用形成配位键的情况,任何分子间的相互作用所导致的的电荷重新分布和键长的变化均可视为授体-受体相互作用的结果.如空位缺陷(即Schottky缺陷)造成其周围键长缩短,紧邻区域晶格发生收缩.图8所示为NaCl型的TiC结构的缺陷示意图,缺陷周围的Ti-C键长比晶体内平均的Ti-C键长短.
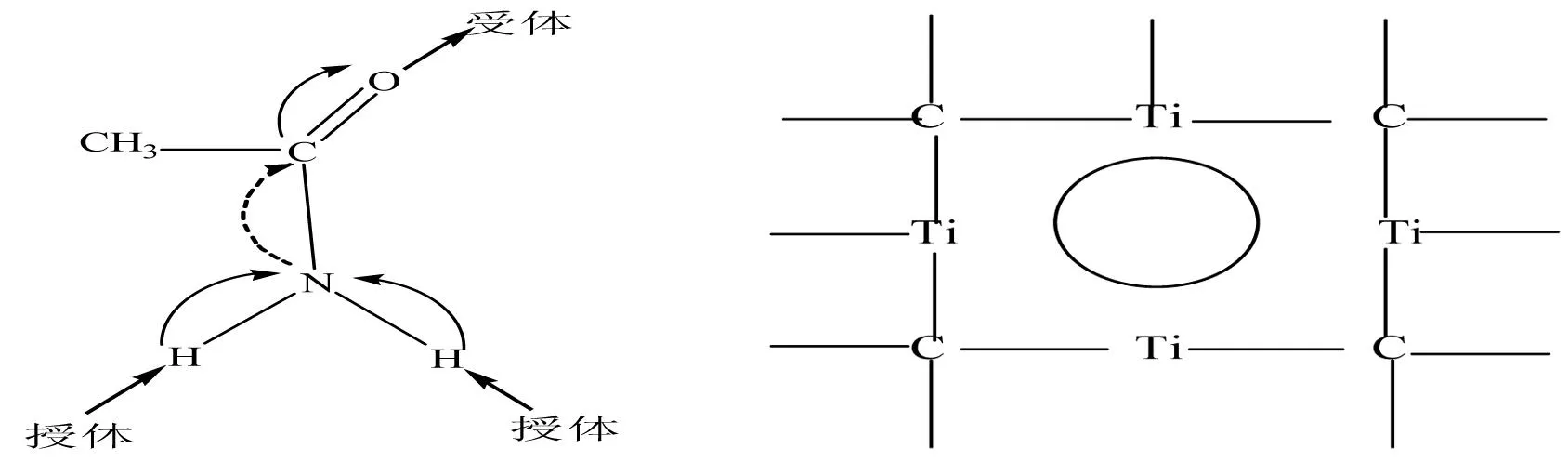
图7 乙酰胺溶剂化效应所造成的键长变化 图8 NaCl型的TiC结构的缺陷
2.2液相中结构变化的特点
溶质-溶剂相互作用也可以用Gutmann规则解释.溶质的浓度越大,可以与溶质分子相互作用的水分子(水为溶剂)的数量就越少,溶质分子的结构变化就越小.在给定的溶剂中,溶质的结构和性质与溶质的浓度有关.溶剂的结构也受溶质分子的本性及浓度的影响.原则上,这种结构变化不局限在一个有限的区域,可以延伸到整个液相,尽管影响程度随距离的增大而显著降低.内部溶剂化络合物的结构随着外围配位环境的改变而改变.如图9所示为金属离子水化层键长的变化示意图.金属离子第一水化层的配位导致水分子内O-H键的增长及H的正电荷增大;第一水化层与第二水化层的水分子间有氢键作用,这种作用比未配位的两个水分子之间的氢键作用要强.
2.3界面上结构变化特点
Gutmann规则可以用来考察界面上结构的变化.晶体表面可以看作晶体畸变区域,晶体表面原子的配位数小于晶体内部原子的配位数,这意味着晶体表面区域晶格的收缩,这种收缩效应通过发生吸附而抵消.实际上,吸附作用越强,即吸附分子与界面作用越强,界面紧邻的键长就越长(第一键长变化规则).如硅胶表面的羟基O-H受授体分子的攻击越多或越强烈,H-O键的键长增长就越大(图10).所以当吸附气体的压力改变,吸附分子数也随之改变,必然造成晶体表面的改变,因而晶体表面不是刚性的,而是可以改变的.
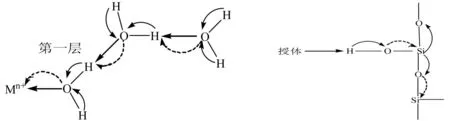
图9 金属离子水化层键长变化 图10 硅胶表面与授体的作用
3结语
Gutmann规则反映了任何分子间相互作用的结构变化特点,是Lewis酸碱理论中授体-受体相互作用的延伸.该规则可推广用来解释液相、固相体系中的键长变化规律,结构参数的改变是由于分子化学环境的改变所致.Gutmann规则还可用来解释溶液、真实晶体和界面的化学行为.
参考文献
[1]Gutmann V. The donor-acceptor approach to molecular interactions [M]. Plenum Press, New York and London, 1978: 68-70.
[2]Gutmann V. Empirical approach to molecular interactions [J]. Coordination Chemistry Reviews. 1975, 15, 207-237.
[3]Gutmann V, Resch G. Lecture notes on solution chemistry [M]. World Scientific, Singapore, 1995: 22-26.
[责任编辑:周峰岩]
The Gutmann's Rule and Its Application
LV Ren-qing, ZHAO Xin, LUO Li-wen, YU Jian-feng
(Department of Chemistry, College of Science, China University of Petroleum
(East China), Qingdao, 266580, China)
Abstract:Gutmann extended the donor-acceptor concept of Lewis acid-base theory to the study of any kind of molecular interactions. Combining with the quantum chemical approach, Gutmann put forward Gutmann's rules. The rules cannot only be employed to investigate the molecular interactions, but also be used to study the structural features in the solid phase, liquid phase and solid surfaces (interfaces).
Key words: lewis acid-base theory;gutmann's rule;application
