聚乙烯吡咯烷酮保护荧光铜纳米团簇制备及其对乙醇的快速准确检测
2021-12-09王佳伟霍俞锦孙彩凤张瀚月张彩凤
李 林 王佳伟 霍俞锦 孙彩凤 张瀚月 张彩凤
(1太原师范学院化学系,晋中 030619)
(2山西省腐植酸工程技术研究中心,晋中 030619)
作为一种有机溶剂,乙醇由于具有良好的化学还原性和反应活性,被广泛用于医学、生物、农业和食品工业等领域,尤其经常被用作酒品添加剂和中药溶解剂[1]。然而,过量使用乙醇会严重危害人体健康,导致人体的肝脏、肺脏、肾脏和神经系统严重受损。如许多无良商人为牟取暴利,经常在保健酒中添加过量乙醇,甚至还贩卖假酒,导致因酒致死的食品安全事件逐年递增[2]。因此,乙醇含量的精确定量检测对于环境监测、临床诊断、食品检测以及饮用酒水品质检测都至关重要。
乙醇含量的传统测定方法主要有近红外光谱法[3]、气相色谱法[4]、高效液相色谱法[5]、定量核磁共振法[6]等。虽然这些方法被广泛使用,但其存在仪器昂贵、操作繁琐、费用较高、耗时较长等缺陷,因此急需开发一种快捷简便的分析方法用于高效检测乙醇含量。
随着纳米技术的快速发展,纳米材料由于具有独特的物理化学性质、良好的生物相容性以及灵敏度高、响应快速并能够实时检测等优点,为食品中乙醇含量检测提供了新的发展思路[7-8]。Hooda等介绍了一种利用金纳米颗粒和酶偶联的PVC反应池构建的新型电流型生物传感器,用于检测商业样品中的乙醇含量[9]。Byoun等借助室温一锅微波辅助法合成了有孔的SWCNT-Sn/SnO2纳米复合物用于检测乙醇[10]。Peng等构建了一种基于聚(N-异丙基丙烯酰胺-共-丙烯酰胺)的智能水凝胶用于快速灵敏检测乙醇含量[11]。虽然生物传感器具有仪器价格低廉、选择性和重现性好、方便快捷且无破坏性等优点,但其建立时的长期不稳定性、可靠性、使用寿命时长性和批量生产工艺等方面的问题仍需进一步探索。
荧光纳米材料由于具有灵敏度高、响应快速并能够实时检测等优点,近年来被广泛用于食品检测、环境监测、癌症识别、细胞成像等领域[12-15]。铜纳米团簇与金属纳米团簇中的金、银纳米团簇相比,由于其原料廉价易得且具有非常好的物理化学性质(如电学、光学、磁性、荧光性以及良好生物相容性[16-17]等),在生物分析、生物成像、工业催化以及电子设备等方面被广泛运用[18-21]。如Wen等设计、合成了一种掺杂碳点的双发射(红/蓝)荧光铜纳米团簇用于可视化检测环境湿度[22];Wang等制备合成腺苷稳定的铜纳米团簇用于呋喃妥因的检测[23];Goswami等利用转铁蛋白作为稳定剂和保护剂制备得到发红色荧光铜纳米团簇[24]。虽然研究者采用各种保护剂、稳定剂和还原剂制备得到具有不同发射荧光的铜纳米团簇,但其水溶性和稳定性都较差,且迄今为止借助发橙色荧光铜纳米团簇对乙醇含量进行检测的报道较少[19,22]。
因此,为了获得合成简单且稳定性高的水溶性荧光铜纳米团簇,我们以氯化铜(CuCl2)为原料、聚乙烯吡咯烷酮(PVP)为保护剂、2-巯基苯并噻唑(MBT)为稳定剂、抗坏血酸(AA)为还原剂,合成了聚乙烯吡咯烷酮保护的具有橙色荧光的铜纳米团簇(PVP-Cu NCs)。与传统方法制备的铜纳米团簇相比,借助声化学还原一锅法制备的PVP-Cu NCs具有更好的稳定性。通过光学表征和光电子能谱测试证实PVP-Cu NCs成功制备。物质响应性实验发现该PVP-Cu NCs可作为检测乙醇的荧光探针,其荧光强度随着乙醇含量(体积分数)的增大而逐渐降低,且最终全部猝灭,该方法与文献中的乙醇检测方法相比,成本低廉、样品用量少,可以实现更快速、更准确的乙醇检测。此外,我们利用该方法对啤酒中乙醇含量进行定量分析,发现其具有良好的回收率,有望应用于食品检测领域。
1 实验部分
1.1 试剂与仪器
CuCl2购自天津市天力化学试剂有限公司。MBT(纯度不低于98.0%)购自上海阿拉丁试剂有限公司。PVP(K30)购自上海麦克林生物试剂有限公司。AA(纯度不低于98.0%)购自国药集团化学试剂有限公司。氢氧化钠(NaOH)、氯化钠(NaCl)、氯化钾(KCl)、氯 化 钙 (CaCl2)、草 酸 钠 (Na2C2O4)、硝 酸 钠(NaNO3)、碳酸钠(Na2CO3)均为分析纯,购于天津市科密欧化学试剂有限公司。异丁醇(Iso)、甲苯(Tol)、正丁醇(But)、甲醛(For)、正辛醇(Oct)、石油醚(Pet)、甲醇(Met)、乙醇(EtOH)购自天津市大茂化学试剂厂。高半胱氨酸(Hcy)、苯丙氨酸(Phe)、甘氨酸(Gly)、赖氨酸(Lys)、半胱氨酸(Cys)、酪氨酸(Tyr)、谷氨酸(Glu)等购自美国Fine-Scientific。所有试剂均未经再纯化。实验所用水均为18.2 MΩ去离子水。
所用仪器有电子分析天平(FA-1004,上海上平仪器有限公司)、数控超声波清洗器(KQ-300DE,昆山市超声仪器有限公司)、酸度计(FE-20,上海梅特勒-托利多仪器有限公司)、荧光分光光度计(F-7000,日本日立)、暗箱式三用紫外分析仪(ZF-7ND,上海嘉鹏科技有限公司)、紫外可见分光光度计(S-600,德国耶拿)、透射电子显微镜(TEM,Tecnai G2 F20 S-TWIN,美国FEI公司,工作电压:200 kV)、纳米粒度及电位分析仪(ZS-90,英国Malvern公司)、X射线光电子能谱仪(XPS,ThermoFisher ESCALAB 250Xi,美国赛默飞公司)。
1.2 PVP-Cu NCs的制备及条件优化
在文献[20]方法的基础上稍许改变步骤制备得到PVP-Cu NCs,具体如下:首先取一支洁净的25 mL比色管,随后依次加入 2.0 mL CuCl2(1.0 mmol·L-1)、6.0 mL MBT(0.1 mmol·L-1)、1.0 mL PVP(0.069 mmol·L-1)和4.0 mL AA(0.1 mmol·L-1),并用超纯水定容到刻度线,混合均匀,然后放入超声清洗器中密封反应,反应参数:20℃、50 W、20 min。待反应完成后,将反应液转移到30 kDa的超滤管,以4 500 r·min-1的转速离心纯化,然后置于4℃冰箱避光保存备用。此外,为了探究制备PVP-Cu NCs的最优条件,分别改变试剂(CuCl2、PVP、MBT、AA)用量、超声功率、反应温度、反应时间和pH并控制其他条件一致时制备PVP-Cu NCs,将制得的PVP-Cu NCs在340 nm激发波长下,测定发射波长580 nm处的荧光强度。
1.3 PVP-Cu NCs的稳定性测试
为了探究所制备的PVP-Cu NCs的稳定性,我们分别研究了时间效应、紫外辐射效应和盐效应对其荧光强度的影响。
时间效应:将制备好的PVP-Cu NCs保存于5.0 mL的EP管中,置于4℃冰箱中避光保存,每隔一段时间测定其在激发波长为340 nm,发射波长为580 nm下的荧光光谱。
紫外辐射效应:将制备好的PVP-Cu NCs分别放置于12管5.0 mL EP管中进行不同时间紫外照射,然后测其在340 nm激发波长、580 nm发射波长下的荧光光谱。
盐效应:分别用1.8 mL不同浓度(0.05、0.1、0.2、0.25、0.5 mol·L-1)的 NaCl溶液稀释 0.2 mL PVP-Cu NCs,然后测其在340 nm激发波长、580 nm发射波长下的荧光光谱。
1.4 PVP-Cu NCs荧光法检测乙醇
取2.0 mL EP管若干进行编号,分别加入200 μL制备好的PVP-Cu NCs和1.8 mL无水乙醇,此时得到的PVP-Cu NCs中乙醇体积分数为90%,静置5 min,测定其在发射波长580 nm处的荧光光谱。重复上述步骤,在保证总体积为2.0 mL的条件下改变PVP-Cu NCs中乙醇的体积分数,依次测得当乙醇体积分数为5%~90%时,PVP-Cu NCs在发射波长580 nm下的荧光光谱,其中空白对照为200 μL PVP-Cu NCs和1.8 mL超纯水。
1.5 PVP-Cu NCs比色法检测乙醇
首先,用剪刀将滤纸裁剪成正方形(如:1.0 cm×1.0 cm)[21],随后将滤纸浸入PVP-Cu NCs溶液中。干燥后,获得基于PVP-Cu NCs的荧光试纸。随后,将不同浓度的乙醇溶液滴加到PVP-Cu NCs试纸上并干燥。设置空白对照组(PVP-Cu NCs未浸泡滤纸),将不同处理试纸放置于暗箱紫外仪中于365 nm紫外灯下照射,观察试纸颜色变化并拍照记录。
1.6 PVP-Cu NCs对啤酒样品的检测
为了检测酒精饮品中乙醇含量,从超市购买不同类型啤酒,在测量前,用超纯水进行稀释,随后借助1.4中方法进行乙醇含量检测。
2 结果与讨论
2.1 PVP-Cu NCs的合成
借助一步声化学还原法合成了PVP-Cu NCs,设计思路如图1所示。在此方法中,AA作为还原剂,可将Cu(Ⅱ)还原为Cu(Ⅰ)和Cu(0),随后Cu与作为稳定剂的MBT分子中的S形成Cu—S键,从而形成铜纳米团簇,但由于其极易发生氧化,因此选择PVP作为保护剂,从而制备得到具有良好稳定性的PVP-Cu NCs。
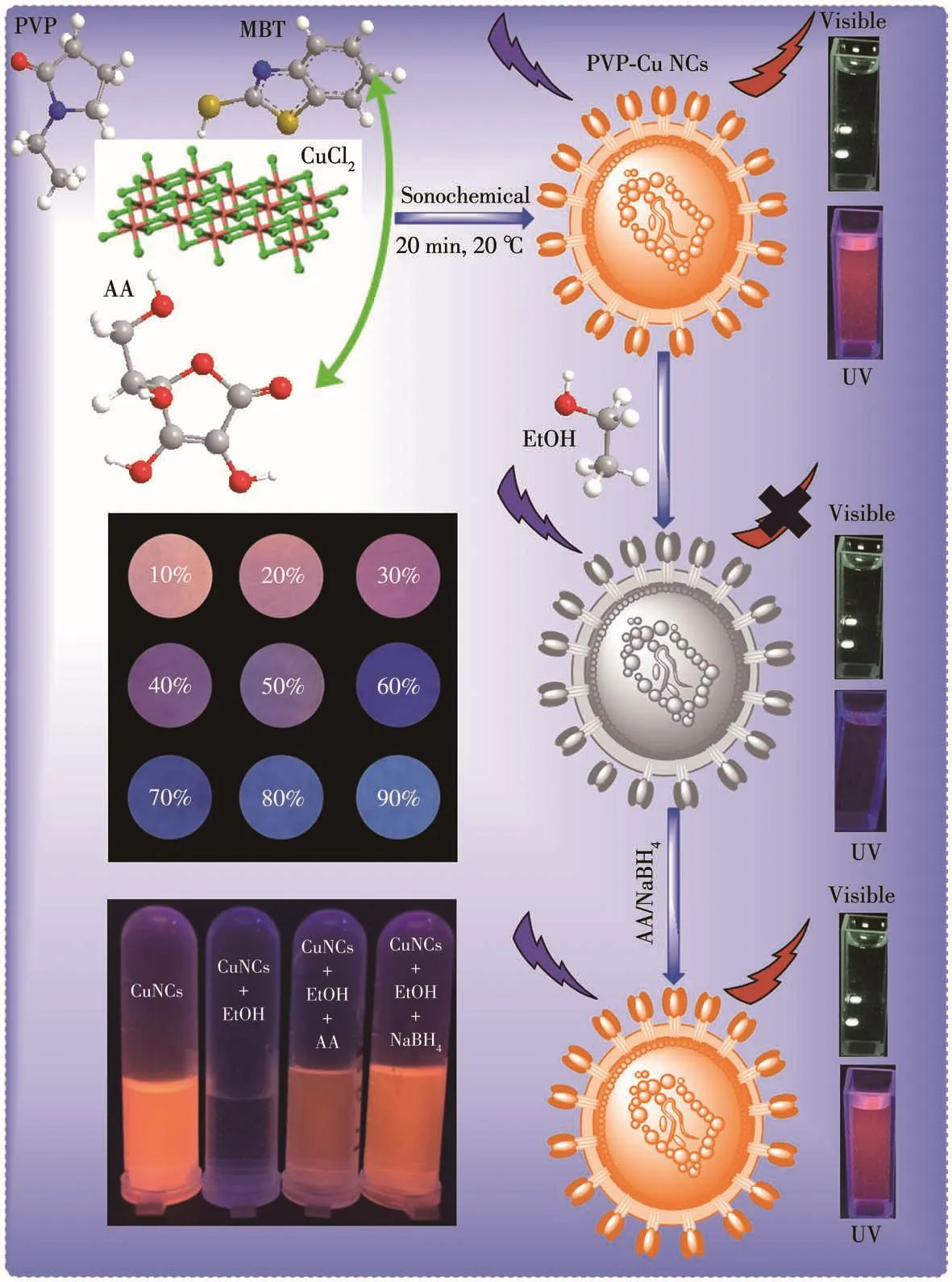
图1 PVP-Cu NCs的合成以及其用于荧光比色法检测乙醇Fig.1 Synthesis of PVP-Cu NCs and its application in fluorescence colorimetric detection of EtOH
由于原料用量、反应介质的pH、反应温度和反应时间都对PVP-Cu NCs的尺寸、结构以及光学性质有重要影响,因而我们以荧光强度为标准,对其合成条件进行优化探究。如图2A所示,随着CuCl2用量的增加,荧光强度先上升后下降,当CuCl2用量为2.0 mL时,合成的PVP-Cu NCs荧光最强。图2B显示出当PVP体积为1.0和6.0 mL时,其荧光强度相差不大,为了节约药品,故PVP最佳用量选取1.0 mL。由图2C得出,随着MBT用量的增加,荧光强度越来越强,而后趋于稳定,当MBT用量为6.0 mL时,PVP-Cu NCs的荧光强度最强。由图2D可知,AA用量与PVP-Cu NCs的荧光强度的关系呈正态分布,当AA用量为4.0 mL时,所制备的样品荧光强度最强。这一系列的用量探究,说明原材料的用量对PVP-Cu NCs的荧光有影响。
除了各原料会影响所制备的PVP-Cu NCs荧光强度,超声功率、超声反应时间、反应温度、反应介质也可能使PVP-Cu NCs的荧光强度有所变化。由图2E可看出,超声功率对其无太大影响,选用50 W为最佳功率。超声时间过短或者过长同样也会降低其荧光强度,由图2F可知20 min为最佳。由图2G可看出超声温度对PVP-Cu NCs影响也较大,随着温度的上升,荧光强度越来越弱,但是15℃低于室温,故选择超声温度为20℃时进行反应。溶液pH可以说是制备PVP-Cu NCs时最为重要的一个因素,由图2H可知,pH=11时最佳,pH大于或小于11都会导致PVP-Cu NCs的荧光发生猝灭或减弱。所以用该方法合成PVP-Cu NCs的最佳超声功率、超声时间、反应温度、溶液pH值分别为50 W、20 min、20℃、11。综上,根据最优条件,我们可制备出荧光强度较强的PVP-Cu NCs。

图2 合成条件对PVP-Cu NCs的荧光强度的影响:(A)CuCl2(1.0 mmol·L-1)用量、(B)PVP(0.069 mmol·L-1)用量、(C)MBT(0.1 mmol·L-1)用量、(D)AA(0.1 mmol·L-1)用量、(E)超声功率、(F)超声时间、(G)反应温度、(H)pHFig.2 Effect of preparation condition on fluorescence intensity of PVP-Cu NCs:(A)volume of CuCl2(1.0 mmol·L-1),(B)volume of PVP(0.069 mmol·L-1),(C)volume of MBT(0.1 mmol·L-1),(D)volume of AA(0.1 mmol·L-1),(E)ultrasonic power,(F)ultrasonic time,(G)reaction temperature,(H)pH
2.2 PVP-Cu NCs的表征
图3A显示了PVP-Cu NCs的紫外可见吸收光谱,从图中可以观察到其在340 nm左右出现紫外吸收峰,而反应原料在此处无吸收峰,此外,在520 nm处没有明显的铜纳米颗粒的表面等离子体共振峰,说明合成的铜纳米团簇中没有大粒径的铜纳米颗粒生成。图3B则显示在340 nm的光激发下,各反应原料在580 nm处并无荧光发射峰,而PVP-Cu NCs出现了明显的荧光发射峰,并且发射光谱窄而对称,且与内源性荧光的光谱区域充分分离。插图为PVP-Cu NCs和各反应原料混合物在日光灯和紫外灯(λmax=365 nm)下所拍照片,可看到在365 nm紫外灯的照射下,PVP-Cu NCs呈现出明亮的橙色荧光。如图3C所示,与有机染料相比,PVP-Cu NCs有着大的斯托克斯位移,这避免了发射和激发信号的相互干扰,同时表明PVP-Cu NCs可以作为极好的荧光探针用于生物传感和成像。图3D为PVP-Cu NCs的红外光谱,3 427和1 767 cm-1处为羧基中—OH和—C=O的特征峰,因此PVP-Cu NCs具有良好的水溶性;2 500 cm-1附近没有出现明显吸收峰,表明有S—Cu键的形成,说明PVP-Cu NCs已成功制备。
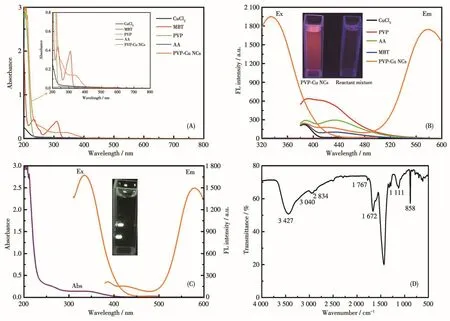
图3 PVP-Cu NCs和反应物的(A)紫外可见吸收光谱图和(B)荧光激发和发射光谱图(插图:PVP-Cu NCs或反应原料混合物在365 nm的紫外灯下照片);PVP-Cu NCs的(C)紫外吸收光谱和荧光光谱图(插图:PVP-Cu NCs在可见光下照片)以及(D)红外光谱图Fig.3 (A)UV-Vis absorption spectra and(B)fluorescence excitation and emission spectra(Inset:photographs of PVP-Cu NCs and the reactant mixture under UV light irradiation of 365 nm)of PVP-Cu NCs and the reactant;(C)UV-Vis absorption spectra and fluorescence spectra of PVP-Cu NCs(Inset:photograph of PVP-Cu NCs under visible light)as well as(D)FTIR spectra
随后通过XPS对PVP-Cu NCs进行表征,结果如图4所示。图4A显示了构成PVP-Cu NCs的主要元素。图4B中Cu2p的XPS谱图证实存在Cu2p1/2和Cu2p3/2的峰,一个在951.65 eV,另一个在931.73 eV,分别归属于Cu(0)和Cu(Ⅰ)。另外,通过TEM和动态光散射(DLS)表征PVP-Cu NCs的形态和大小。TEM图像显示PVP-Cu NCs是球形的,平均尺寸约为6.0 nm(图4F),与DLS测定的流体动力学直径相一致(图4F插图)。
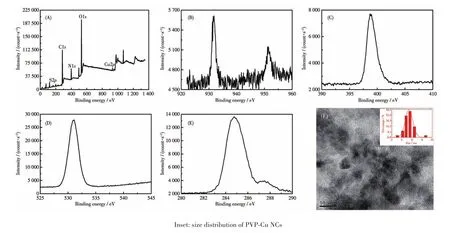
图4 PVP-Cu NCs的XPS谱图:(A)PVP-Cu NCs、(B)Cu2p、(C)N1s、(D)O1s、(E)C1s;(F)PVP-Cu NCs的TEM图Fig.4 XPS spectra of PVP-Cu NCs:(A)PVP-Cu NCs,(B)Cu2p,(C)N1s,(D)O1s,(E)C1s;(F)TEM image of PVP-Cu NCs
2.3 PVP-Cu NCs的稳定性
我们选择硫酸奎宁(量子产率为54%)作为标准物质,测定PVP-Cu NCs的荧光量子产率为15.1%。图5A为在一段时间内,PVP-Cu NCs的最大发射峰荧光强度随时间的变化。由图可见PVP-Cu NCs的荧光强度并无明显降低,表明PVP-Cu NCs具有良好的储存稳定性。图5B为PVP-Cu NCs试纸不同储存时间后在365 nm的紫外灯下的照片,可以看出在放置8 d后,荧光强度略微减弱,但没有大幅猝灭。图5C为1 h内PVP-Cu NCs的紫外辐射荧光光谱,可观察到PVP-Cu NCs的荧光强度较为稳定,证明PVPCu NCs的紫外辐射稳定性良好。为了研究离子强度对PVP-Cu NCs的影响,将PVP-Cu NCs置于0.05~0.5 mol·L-1的NaCl溶液中,由图5D观察到伴随着氯化钠浓度从低到高的变化,PVP-Cu NCs荧光强度呈现增强趋势,但整体比较稳定,表明PVP-Cu NCs的耐盐性良好。
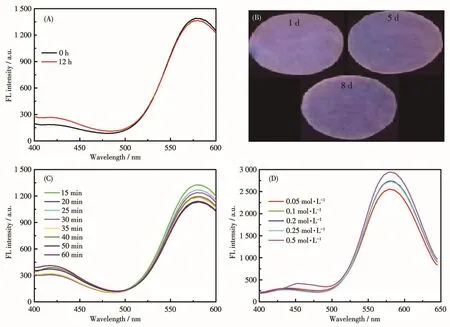
图5 PVP-Cu NCs的稳定性测试:(A)PVP-Cu NCs荧光强度随时间的变化;(B)储存时间对PVP-Cu NCs试纸响应性能的影响;(C)紫外辐射时间对PVP-Cu NCs荧光强度的影响;(D)NaCl溶液浓度对PVP-Cu NCs荧光强度的影响Fig.5 Stability tests of PVP-Cu NCs:(A)changes of fluorescence intensity of PVP-Cu NCs with time;(B)effect of storage time on response performance of PVP-Cu NCs test paper;(C)effect of UV radiation time on fluorescence intensity of PVP-Cu NCs;(D)effect of concentration of NaCl solution on fluorescence intensity of PVP-Cu NCs
2.4 PVP-Cu NCs选择性检测乙醇
为了评价PVP-Cu NCs对乙醇的响应性,在pH=11、340 nm的激发光下对具有干扰性的代表阴离子、氨基酸(10 μmol·L-1)和其它醇类物质进行了检测,包括C2O42-、CO32-、Cl-、NO3-、Hcy、Phe、Gly、Lys、Cys、Tyr、Glu、Ca2+、Na+、K+、Iso、Tol、But、For、Oct、Pet、Met。如图6A所示,只有乙醇能够引起PVP-Cu NCs的荧光强度显著降低,而其他的物质并没有引起PVP-Cu NCs荧光强度的明显变化。显然,PVP-Cu NCs可以作为对乙醇具有高度选择性的荧光探针。

图6 PVP-Cu NCs对乙醇的响应性和灵敏性测试:(A)PVP-Cu NCs与不同分析物共存时的荧光强度变化;(B)不同乙醇含量对PVP-Cu NCs荧光强度的影响;(C)PVP-Cu NCs荧光强度随乙醇含量变化的曲线;(D)PVP-Cu NCs荧光强度与乙醇含量线性关系图Fig.6 Responsiveness and sensitivity tests of PVP-Cu NCs to EtOH:(A)changes of fluorescence intensity of PVP-Cu NCs in the presence of various analytes;(B)effect of different EtOH contents on fluorescence intensity of PVP-Cu NCs;(C)plot of fluorescence intensity of PVP-Cu NCs vs EtOH content;(D)liner relationship of fluorescence intensity of PVP-Cu NCs vs EtOH content
由于PVP-Cu NCs对乙醇有明显的选择性,为了研究PVP-Cu NCs对乙醇检测的灵敏度,定量探究了不同乙醇含量对PVP-Cu NCs荧光强度变化的影响,所得荧光光谱如图6B所示。结果显示随着乙醇含量(体积分数)的增大,PVP-Cu NCs的荧光强度随之减弱,当乙醇含量达到80%时,PVP-Cu NCs的荧光完全猝灭,说明PVP-Cu NCs对乙醇有较好的响应性(图6C)。图6D为PVP-Cu NCs荧光强度与乙醇含量的线性关系,其线性方程为y=3 283.37-65.884 6x,R2=0.991 7,检出限(LOD)为3.42%,与文献报道的乙醇检测方法相比,我们的方法实现了良好的灵敏度和准确性检测,如表1所示。
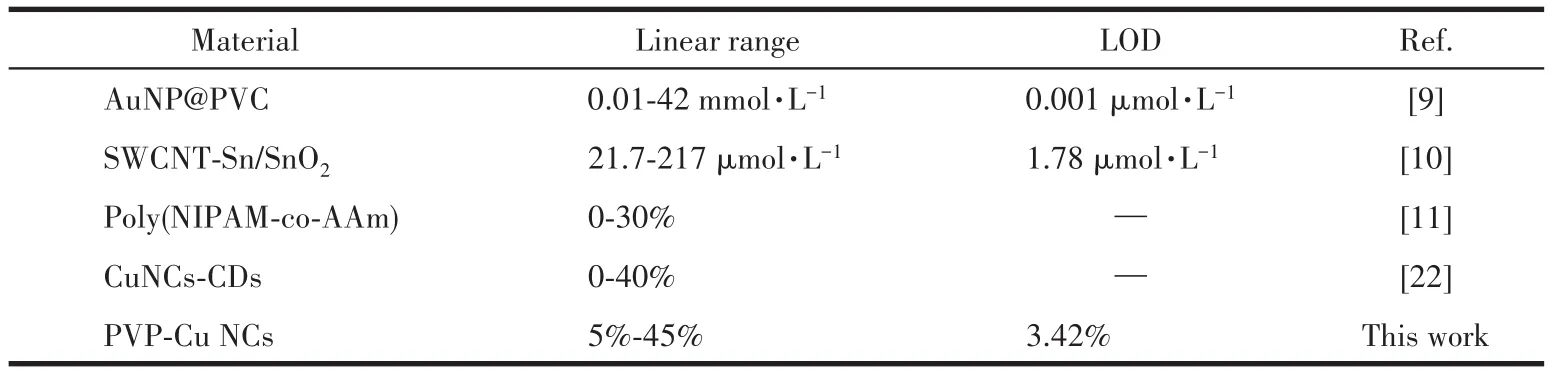
表1 不同材料对乙醇检测的对比Table 1 Comparison of different nanomaterials for EtOH sensing
2.5 PVP-Cu NCs比色法检测乙醇
为了考察PVP-Cu NCs对乙醇的响应性,将PVP-Cu NCs溶液浸泡滤纸并干燥后,用365 nm的紫外灯照射。如图7A所示,与空白对照(d)相比,滤纸发出强烈的橙色荧光(e),然后在滤纸上滴加乙醇溶液,橙色荧光猝灭(f)。图7B展示了将不同含量的乙醇溶液滴加到PVP-Cu NCs滤纸上后颜色的变化,可以看出随乙醇含量的增加,滤纸颜色逐渐由橙色向蓝色变化。此现象表明可利用PVP-Cu NCs设计一种检测乙醇溶液或者蒸汽的可视化检测试纸。为了更进一步明确温度和时间对PVP-Cu NCs检测乙醇的影响,我们进行了详细测试,如图8所示。由图8A可知,温度在20~35℃范围内,PVP-Cu NCs溶液检测乙醇没有受明显影响。图8B则表明向PVP-Cu NCs溶液中加入乙醇1 min后,荧光强度就会迅速下降,但二者作用3 min左右,荧光强度几乎不再发生改变,表明PVP-Cu NCs溶液检测乙醇响应时间需要约3 min。图8C为PVP-Cu NCs试纸检测乙醇的响应时间,由于裸眼观察与仪器测试的差别,试纸检测乙醇响应时间相对滞后,约为4 min。

图7 (A)(a、d)空白滤纸、(b、e)浸染PVP-Cu NCs的滤纸及(c、f)其加入乙醇后在365 nm紫外光照射时的颜色变化;(B)浸染PVP-Cu NCs的滤纸加入不同含量乙醇后在365 nm紫外光照射时的颜色变化Fig.7 (A)(a,d)Color changes of blank filter paper,filter paper stained by PVP-Cu NCs in the(b,e)absence and(c,f)presence of EtOH under UV light at 365 nm;(B)Color changes of filter paper stained by PVP-Cu NCs after adding various contents of EtOH under UV light at 365 nm
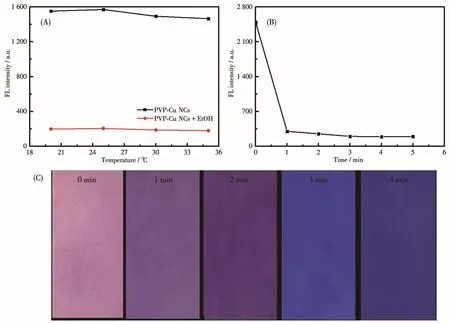
图8 温度(A)和时间(B)对PVP-Cu NCs溶液检测乙醇的影响;(C)PVP-Cu NCs试纸对乙醇的响应时间Fig.8 Effect of temperature(A)and time(B)on detection of EtOH by PVP-Cu NCs solution;(C)Response time of PVP-Cu NCs test paper to EtOH
2.6 PVP-Cu NCs检测乙醇机理探讨
为了探究PVP-Cu NCs检测乙醇的机制,我们首先测试了加入乙醇后PVP-Cu NCs的形貌和粒径大小,如图9所示。未加乙醇之前,PVP-Cu NCs为球形,且平均尺寸约为6.0 nm(图4F);加入乙醇之后,其TEM图呈现不规则分布结构(图9A),且经DLS测试,发现粒径增大到约100 nm(图9B),这一现象表明乙醇与PVP之间可能形成氢键,而氢键可诱使铜纳米团簇稳定性降低,从而使荧光猝灭。为了证实这一猜测,随后设计了如下实验:在荧光猝灭的PVPCu NCs+EtOH体系中,我们分别加入还原剂AA和NaBH4(10 mmol·L-1),发现该检测体系的荧光可以恢复,如图10所示。这种现象可能是由于AA可以将乙醇分解为酯和水,NaBH4则与乙醇发生反应:NaBH4+4C2H5OH=B(OC2H5)3+4H2+NaOC2H5,从 而 使PVP-Cu NCs荧光恢复。这证实了乙醇诱导PVP-Cu NCs荧光猝灭是由于其改变了铜纳米团簇结构,使PVP-Cu NCs稳定性降低后发生了聚集,从而诱导荧光猝灭。

图9 检测乙醇后PVP-Cu NCs的TEM图(A)和粒径分布(B)Fig.9 TEM image(A)and size distribution(B)of PVP-Cu NCs after EtOH detection
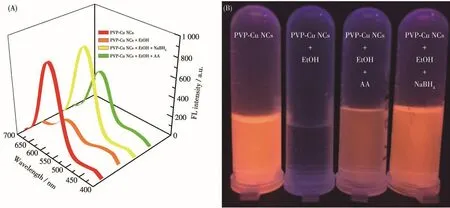
图10 PVP-Cu NCs、PVP-Cu NCs+EtOH、PVP-Cu NCs+EtOH+NaBH4和PVP-Cu NCs+EtOH+AA的(A)荧光光谱图及(B)在365 nm紫外灯下的照片Fig.10 (A)Fluorescence emission spectra and(B)photos under UV light at 365 nm of PVP-Cu NCs,PVP-Cu NCs+EtOH,PVP-Cu NCs+EtOH+NaBH4and PVP-Cu NCs+EtOH+AA
2.7 酒精饮料中乙醇的检测
为验证该方法的实用性,将其应用于啤酒中乙醇含量的测定。利用上述建立的检测乙醇的方法来实现对于实际样品的检测,并通过建立的回归方程曲线计算啤酒中的乙醇含量。如表2所示,啤酒中的回收率为100.2%~106.1%。实验结果表明PVP-Cu NCs对各种酒品饮料中乙醇的定量检测分析有着巨大的潜力。
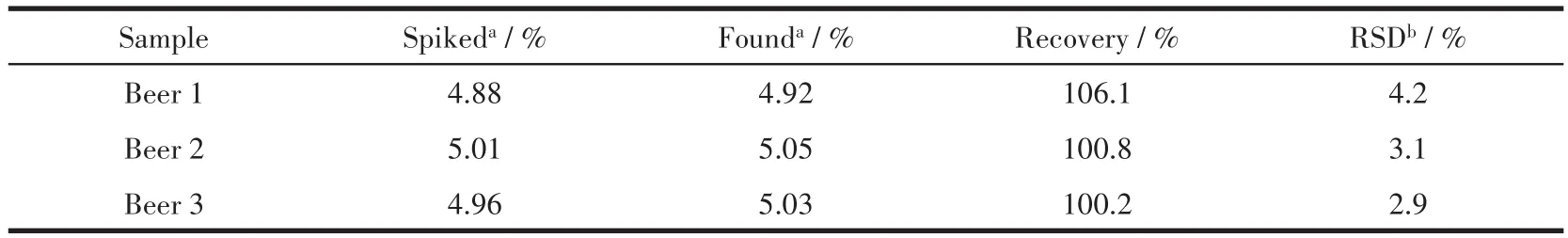
表2 PVP-Cu NCs对加标啤酒稀释样品中乙醇含量的检测Table 2 Detection of EtOH content in spiked beer diluent sample by PVP-Cu NCs
3 结论
以CuCl2为原料、PVP为保护剂、MBT为稳定剂、AA为还原剂合成简单化且稳定性高的水溶性荧光铜纳米团簇(PVP-Cu NCs)。利用紫外光谱和荧光光谱对PVP-Cu NCs的光学性质进行了表征,结果证明其在300~350 nm处出现吸收峰,在激发波长为340 nm时测得最大发射峰为580 nm。实验结果表明PVP-Cu NCs的荧光强度受时间、紫外辐射和盐效应影响不大,说明其具有良好的耐光漂白性和耐盐性。物质响应测试发现PVP-Cu NCs对乙醇有较好的响应性,且可制作为乙醇检测试纸,对50%的乙醇溶液可进行可视化检测,有可能用于开发乙醇检测试纸。
