GLP-1受体激动剂利拉鲁肽在糖尿病肾病治疗中的疗效观察
2021-12-03张晓飞
张晓飞,杨 丽,杨 光
0 引言
糖尿病肾病(Diabetic kidney disease,DKD)是慢性肾脏疾病(Chronic kidney disease,CKD)和终末期肾病(End-stage kidney disease,ESKD)的主要病因,也是糖尿病患者最常见的微血管并发症和死亡原因[1]。DKD发病机制复杂,临床以肾小球滤过率(Glomerular filtration rate,GFR)降低和超过3个月以上的持续蛋白尿为主要诊断特征,大约33%的DKD患者最终将需要肾脏替代疗法(Renal replacement therapy,RRT)[2],甚至有部分DKD患者在向终末期肾病进展过程中即死于突发的心血管意外[3]。目前,除常规应用降血压、降血脂、降血糖药物外,DKD的有效治疗手段仍很有限。因此,寻找新的防治方法已成为肾内科临床研究的重要方向。有研究发现,胰高血糖素样肽1受体激动剂(Glucagon-like peptide 1 receptor agonist,GLP-1RAs)具有不依赖于血糖的肾脏保护作用,而且在DKD形成早期应用GLP-1RAs可有效防止蛋白尿的发生,并有助于延缓2型糖尿病患者GFR的进一步下降[4-5]。因此,本研究将我院肾内科收治的糖尿病肾病患者作为研究对象,其中观察组在常规治疗基础上加用GLP-1RAs利拉鲁肽,以探讨GLP-1RAs在糖尿病肾病治疗中的临床效果。
1 资料与方法
1.1 一般资料 选取2018年9月-2019年12月我院肾内科收治的糖尿病肾病患者。入组标准:18~80岁;1个月内无重大外科手术史;无心、脑、肾、眼等器官严重并发症;无胰腺、甲状腺等疾病;无相关药物过敏史及精神系统疾病;意识清,配合治疗。排除标准:怀孕及哺乳期妇女;1型糖尿病、继发性糖尿病;重度DKD[eGFR≤30 ml /(min>·1.73m2)]、透析、严重肾功能损伤;急性胰腺炎,甲亢等。共入选患者116例,男62例,年龄(57±10)岁;女54例,年龄(54±10)岁。所有患者均签署自愿参与同意书,按随机数字表法将患者分为对照组和观察组,每组58例。两组患者体重、血糖及DKD相关生化指标(肾小球滤过率、尿总蛋白;尿微量白蛋白/尿肌酐)的基线水平差异无统计学意义(P>0.05),两组具有可比性,见表1。

表1 两组患者一般情况及DKD相关生化指标基线水平比较
1.2 实验治疗方案 两组患者均进行降血糖、降血脂、降血压等常规抗DKD治疗,且两组患者均给予缬沙坦口服(80 mg,qd),低盐饮食并每日适量补充优质蛋白质;观察组每日上午10点皮下注射利拉鲁肽注射液[诺和力,诺和诺德(中国)制药有限公司,18 mg/3 ml,国药准字J20160037],为避免胃肠道反应,第1周每日注射0.6 mg,第2周加量至1.2 mg,共治疗10周;若观察组患者联合使用磺酰脲类降糖药,为避免低血糖发生,磺酰脲类降血糖药剂量减半。研究期间严密监测患者有无恶心、呕吐、视物模糊等,以防止发生胰腺以及甲状腺损伤。
1.3 实验观察指标 空腹采血,离心后取上清分装,-80 ℃保存。无污染条件下收集24 h尿液,4 ℃保存,全自动生化检测仪检测评估两组患者生化指标。酶联免疫吸附法测定肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素- 6(Interleukin-6,IL-6)水平,转化生长因子β1(Transforming growth factor-β1,TGF-β1),放射免疫法检测血清内皮素水平。

2 结果
2.1 两组患者血糖及肾功能比较 治疗10周后,两组患者血糖及肾功能各项生化检测指标均较治疗前显著改善,差异有统计学意义(P<0.05)。治疗后,观察组的餐后血糖、UTP均显著低于对照组,差异有统计学意义(P<0.01);观察组的空腹血糖、ACR、eGFR略低于对照组,但差异无统计学意义(P>0.05)。结果见表2。
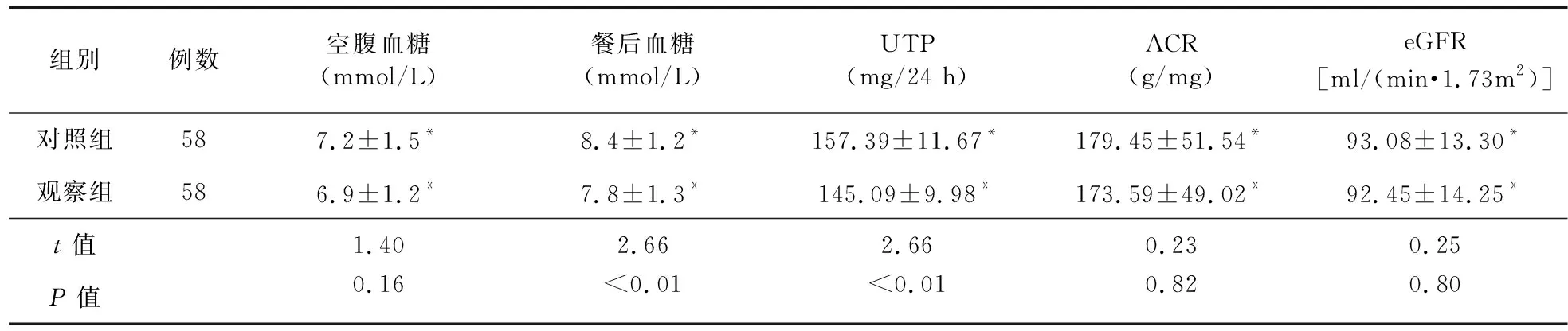
表2 治疗后两组患者生化指标比较
2.2 两组患者炎症细胞因子比较 治疗后,两组患者的血清炎症细胞因子水平均显著低于治疗前的基线水平,差异有统计学意义(P<0.05);观察组患者血清内皮素水平略低于对照组,但差异无统计学意义(P>0.05);观察组TNF-α、IL-6、TGF-β1的含量显著低于对照组,差异有统计学意义(P<0.05)。结果见表3。
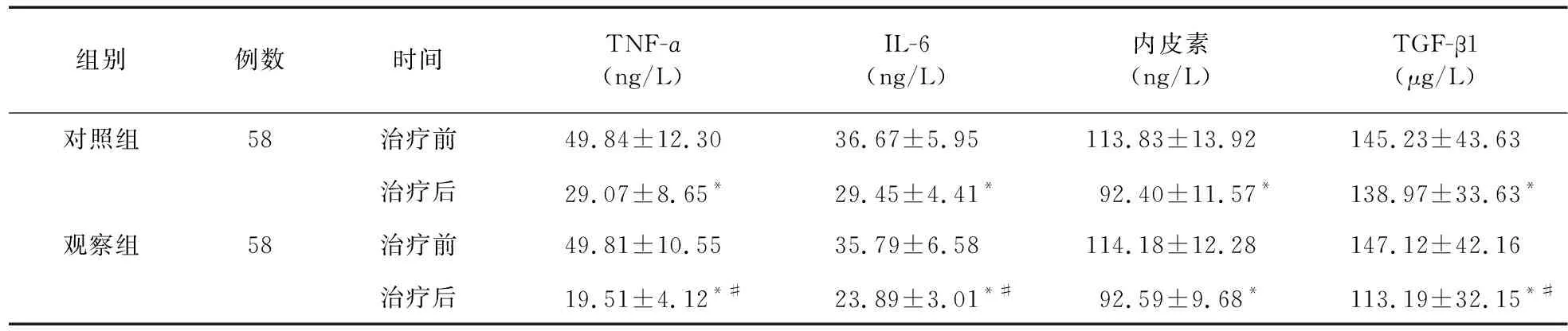
表3 两组患者治疗前后炎症细胞因子比较
2.3 两组患者治疗前后体重与炎症细胞因子相关性分析 治疗10周后,观察组患者体重降低约2.7 kg,与对照组相比差异有统计学意义(P<0.05)。两组患者体重与炎症细胞因子TNF-α、IL-6、TGF-β1进行相关性分析后显示,观察组体重与TNF-α、IL-6、TGF-β水平呈正相关(r分别为0.515、0.447、0.435,P<0.05)。见表4。
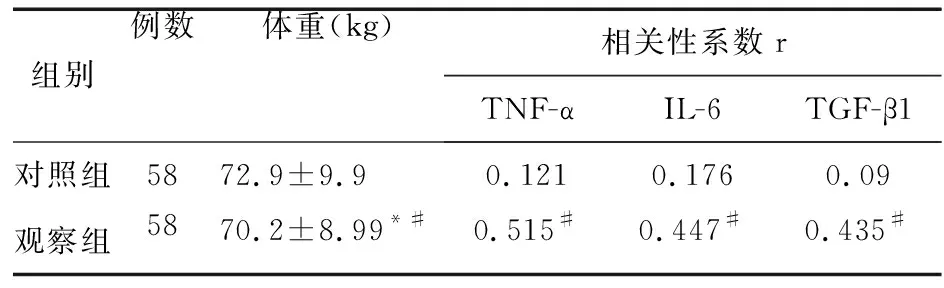
表4 两组患者治疗前后体重与炎症细胞因子相关性分析
3 讨论
目前,糖尿病已成为影响人类健康的一大负担和难题[6]。DKD是糖尿病人群中最常见的并发症之一,同时DKD也是ESKD的主要发病原因。因此,近年来临床致力于探索和发现干预糖尿病的肾脏损伤或延缓糖尿病肾病向终末期肾病进展的各种有效治疗手段。
目前的研究认为,由于糖尿病的发病机制是慢性低级别炎症和先天性免疫系统的激活[7],所以,炎症反应也成为糖尿病患者肾组织损伤发生发展的潜在影响因素之一[8]。有文献报道,无论是来自糖尿病肾病模型的动物实验还是临床DKD患者,血液循环中的炎症介质水平及肾脏的免疫细胞浸润均增多[9],同时,黏附分子和趋化因子在DKD患者中也有所上调[10]。还有研究发现,TNF-α能上调肾脏内皮细胞间黏附分子1(Intercellular cell adhesion molecule-1,ICAM-1)的表达,而过表达的ICAM-1可促使巨噬细胞进入肾脏释放各种炎症细胞因子,但敲除了ICAM-1基因的小鼠,其肾脏炎症可得到改善[11],表明ICAM-1参与了DKD的发病机制。由于进入肾脏的巨噬细胞会进一步释放TNF-α,从而造成TNF-α在巨噬细胞与肾脏内皮细胞之间形成恶性循环[12]。TNF-α诱导的肾脏炎症反应主要发生在糖尿病伴有并发症的阶段,如2型糖尿病时,血清和尿中TNF-α的水平会随着尿蛋白的增加而显著升高[13],即糖尿病肾损害的发生也伴随着炎症细胞因子TNF-α的上调。由此可预测,糖尿病诱导炎症介质TNF-α增高,TNF-α通过上调ICAM-1,吸引和募集循环血中的炎症细胞向肾脏组织迁移渗透,释放更多的炎症细胞因子,加剧肾脏内炎症反应,使TNF-α等炎症因子在肾脏表达持续升高,直接或间接破坏内皮细胞的完整性,内皮细胞受损又会释放更多的炎症因子,如IL-6、TGF-β1等,最终导致肾组织损伤。
动物实验研究表明,脂肪细胞TNF-α等炎症因子的水平与肾脏疾病高度相关,敲除TNF-α基因的肥胖小鼠可避免炎症对肾组织的损伤[14]。然而,脂肪组织中TNF-α等炎症因子的含量与肾脏组织损伤程度的关系尚不明确。
有文献报道,应用利拉鲁肽52周,可显著提高超重(肥胖)2型糖尿病伴3期肾损伤患者的肾小球滤过率并降低50%的蛋白尿水平[15]。同时,利拉鲁肽通过降压、降低血糖的作用,也减少了血管内皮损伤,减少肾脏炎性反应,从而降低了炎症细胞因子的水平[16]。
本研究中,接受治疗10周后,两组患者空腹血糖水平均低于基线水平,观察组与对照组比较差异无统计学意义,但观察组餐后血糖低于对照组。治疗后,两组患者肾功能各项指标均较治疗前有所改善,治疗后两组肾小球滤过率比较差异无统计学意义,但尿蛋白水平观察组显著低于对照组。两组炎症细胞因子水平均较治疗前降低,且观察组治疗后血清TNF-α、IL-6、TGF-β1水平低于对照组,表明利拉鲁肽能显著降低糖尿病肾病患者循环血中炎症细胞因子的水平。此外,观察组经利拉鲁肽治疗后体重明显降低,与对照组比较差异有统计学意义。体重与炎症细胞因子的相关性分析显示,观察组体重与炎症细胞因子TNF-α、IL-6、TGF-β1水平呈正相关。
综上所述,GLP-1 受体激动剂利拉鲁肽可减少机体TNF-α、IL-6、TGF-β1等细胞因子含量,推测可使肾脏ICAM-1的表达下调,进入肾脏的巨噬细胞数量减少,炎症细胞因子水平进一步降低这可能使肾脏内皮细胞损伤减轻,蛋白渗出减少,从而起到修复和保护肾脏的作用。
由于本研究是无创低损伤级别的研究项目,有关利拉鲁肽与炎症细胞因子的相互关系,以及利拉鲁肽对肾脏的保护作用,还有待于临床特殊病理组织活检以及动物模型等方面的不断探索和支持。另外,虽然利拉鲁肽已进入国家医保范围内用药,但个人自付比例仍较高,因经济因素仍未在临床广泛应用。利拉鲁肽在糖尿病DKD患者中所发挥的独特的不依赖于降血糖作用的肾脏保护作用可为临床治疗提供一些参考。
