胰腺癌靶向的碳纳米管超声造影剂的制备及体内外评价
2021-12-03胡楚玲顾芬芬台宗光张敏敏
胡楚玲,顾芬芬,台宗光,高 申,张敏敏
0 引言
胰腺癌起病隐匿,诊断和治疗困难,且预后极差。早期根治性切除是胰腺癌最有效的治疗方法,但切除率仅为10%~20%,五年生存率仅为0.4%~3.4%[1-2]。因此,早期诊断和早期治疗是改善胰腺癌预后的关键[3]。
超声造影增强技术是近年来发展起来的,与CT、MRI等其他影像学方法相比,具有价格低、安全性高、操作简便、实时观察等优点[4-5]。主要通过静脉注射微泡造影剂,利用界面回声阻抗差,将肿瘤从周围组织凸显出来,在胰腺癌诊断中的敏感性高达94%,已成为诊断胰腺疾病的主要方法[6-8]。但是,这种微泡仍然存在许多问题,例如对病变的部位无亲和力。微泡的直径较大(2~6 μm),无法穿透血管壁到达靶细胞[9]。此外,由于半衰期短,有效维持时间只能持续数十秒或几分钟[10]。因此,寻找一种新型、理想、高效、体积小、穿透力强的新型理想靶向造影剂是肿瘤靶向成像领域最重要的研究方向。
多壁碳纳米管(Multi-wall carbon nanotubes,MWCNT)具有高吸附性及光和高回声的特征,可以将成像技术和药物输送结合起来用于疾病的诊断[11]。同时碳纳米管可以穿过许多生物屏障,可用于纳米医学领域,例如诊断、疾病治疗、生物成像和组织工程[12-13]。碳纳米管具有许多独特的特性,但由于其不溶于水和大多数有机溶剂,从而阻碍了其在生物医学领域的应用。因此,非常有必要进行碳纳米管的功能修饰,以改善生物相容性和分散性。
Hedgehog信号通路是胰腺癌形成中的重要信号通路。2003年《自然》杂志报道了Hedgehog蛋白在胰腺癌细胞中高表达[14-15]。Hedgehog与肿瘤细胞的生长密切相关,几乎所有胰腺癌中都高表达Hedgehog,并且在早期肿瘤中就出现了高表达状态,而正常成年人的Hedgehog蛋白几乎不表达[16-17]。Hedgehog蛋白的表达随疾病的进展而增加[18]。这些结果表明,Hedgehog对于胰腺癌的早期诊断非常重要,Hedgehog蛋白可以作为胰腺癌分子成像的理想标记[19-20]。基于以上认识,本研究构建一种Hedgehog单克隆抗体修饰的超声造影剂,用于CE-EUS以实现胰腺癌的特异性靶向。
在本研究中,将聚乙二醇(Polyethylene glycol,PEG2000)共价修饰到活化的碳纳米管表面,然后与Hedgehog单克隆抗体(mAb-Hedgehog)结合。形成的受体特异性靶向的MWCNT-PEG-HH纳米递送系统用于US成像和药物递送。制备的MWCNT-PEG-HH纳米靶向造影剂,与普通微泡造影剂相比,具有高分辨率、半衰期长、良好的渗透性、安全性和稳定性的特性。
1 材料与方法
1.1 仪器与试剂 Zeta sizer ZS90电位粒径分析仪(英国Malvern公司);透射电镜(JEM-2010,日本JEOL公司);傅里叶红外仪(美国Thermo公司);荧光显微镜(德国Leica公司);FACSCalibur流式细胞仪(美国BD公司);多壁碳纳米管(美国Brattleboro 公司);双功能聚乙二醇(NH2-PEG-COOH,平均分子量2 000,嘉兴博美生物技术有限公司);Hedgehog单克隆抗体(英国Abcam公司);DMEM培养液、胎牛血清FBS(美国Gibco公司),其他试剂均为分析纯。胰腺癌细胞株SW1990购自美国ATCC公司。BALB/c裸鼠(雄性,4周龄),购于中科院上海实验动物中心,第二军医大学实验动物中心SPF洁净室精心饲养。实验按照第二军医大学实验动物伦理委员会规定开展。
1.2 MWCNT-PEG-HH的合成
1.2.1 MWCNTs的氧化 将2 g多壁碳纳米管与体积比1∶3的浓硫酸∶浓硝酸混合(80 ml)。混合液在40 ℃ 40 kHz超声条件下超声7 h,继续搅拌24 h。将反应后的多壁碳纳米管离心,冻干,备用。
1.2.2 MWCNTs-PEG-2000合成 将60 mg MWCNT-COOH溶于200 ml甲醇中,分别加入EDC和NHS 0.6 g和0.4 g,以活化羧基,混合物在室温下搅拌3 h。所得产物氮气吹干,洗涤,冻干。将10 mg PEG-2000与活化的MWCNT-COOH 20 mg共同溶解于甲醇中,继续搅拌24 h。所得产物氮气吹干,洗涤,离心,冻干。合成的聚合物用红外光谱(FT-IR)进行检测。
1.2.3 MWCNT-PEG-HH的合成 将0.3 g EDC 和0.2 g NHS加入到20 mg MWCNT-PEG-COOH磷酸盐缓冲液中,继续搅拌3 h,加入50 μl Hedgehog mAb (HH),室温下避光搅拌24 h,洗涤,离心,冻干,得到MWCNT-PEG-HH(图1)。合成的MWCNT-PEG-HH用红外光谱(FT-IR)进行检测。将hedgehog mAb用FITC标记,其在波长490~495 nm处有紫外吸收,故通过紫外光谱仪对合成的MWCNT-PEG-HH进行检测。

图1 MWCNT-PEG-HH合成示意图
1.3 MWCNT-PEG-HH超声纳米造影剂的形态观察和电位测定 将适量的MWCNT-PEG-HH溶液滴于覆盖有碳膜的铜网上,用滤纸吸干剩余溶液,干燥后,利用透射电镜观察形态。另取MWCNT-PEG-HH溶液20 μl,加入PBS溶液中,利用粒径分析仪测定MWCNT-PEG-HH的电位,测定条件为25 ℃、固定角90°。
1.4 MWCNT-PEG-HH超声纳米造影剂的体外细胞学评价
1.4.1 流式细胞术考察细胞摄取能力 采用流式细胞术考察超声碳纳米管(MWCNT-PEG-HH)造影剂在人胰腺癌细胞SW1990的摄取能力。将处于对数生长期的SW1990细胞按2×105个/孔接种到12孔板,置于37 ℃、5%CO2孵箱中培养24 h。培养24 h后更换为无血清培养基,之后每孔加入Cy5标记的MWCNT-PEG-HH(碳纳米管浓度:10、100、200 μg/ml),培养板放入孵箱中继续培养4 h。细胞利用PBS润洗3次,胰酶消化,离心后PBS重悬。利用流式细胞仪检测细胞对纳米复合物的摄取情况。
1.4.2 共聚焦显微镜考察细胞内分布情况 采用共聚焦显微镜考察超声碳纳米管(MWCNT-PEG-HH)造影剂在人胰腺癌细胞SW1990的细胞内分布情况。将处于对数生长期的SW1990细胞按5×104个/孔接种到覆盖有圆形玻璃片的24孔板,置于37 ℃、5%CO2孵箱中培养24 h。培养24 h后更换为无血清培养基,之后每孔加入Cy5标记的MWCNT-PEG-HH(碳纳米管:10、100、200 μg/ml),培养板放入孵箱中继续培养4 h。吸掉培养基,每孔加入500 μl 4%的多聚甲醛溶液,置于4 ℃冰箱中固定1 h,PBS润洗3次,将每孔中的圆形玻璃片取出,吸取1滴封片液(含DAPI)滴到载玻片上,将圆形玻片细胞生长面朝下盖于载玻片上。利用激光共聚焦显微镜观察细胞对碳纳米管的摄取及胞内分布情况,并拍照记录。
1.4.3 CCK-8法考察超声碳纳米管细胞毒性 采用CCK-8法对碳纳米管超声造影剂(MWCNT-PEG-HH)的细胞毒性进行考察。将处于对数生长期的人胰腺癌细胞SW1990按8×103个/孔接种到覆盖有圆形玻璃片的96孔板,置于37 ℃、5%CO2孵箱中培养24 h。培养24 h后更换为无血清培养基,之后每孔加入不同溶度的碳纳米管超声造影剂,继续培养24 h、48 h,吸掉培养基,PBS润洗3次,每孔加入含CCK-8的新鲜培养基,继续1 h,振荡30 s后,酶标仪450 nm测定OD值,以未处理细胞为对照,未接种细胞的孔为空白孔,计算各孔的细胞活力。
1.5 考察碳纳米管超声造影剂体外显影情况 采用超声造影仪(Mylab 90 scanner)考察碳纳米管的体外造影能力。将不同浓度MWCNT及MWCNT-PEG-HH加入2 ml EP管中,以PBS为对照。在6.0 MHz超声频率下,用耦合剂涂覆于超声探头表面,在纯化水介质中考察碳纳米管的体外显影情况。
1.6 考察碳纳米管超声造影剂体内显影情况
1.6.1 人胰腺癌裸鼠移植瘤模型的构建 将处于对数生长期的SW1990细胞利用胰酶消化,离心后用4%培养基重悬至1×108个/ml的细胞悬液,加入相等体积的基质胶溶液,在冰浴中吹打均匀。选取4周龄的BALB/c裸鼠(16~17 g),用1 ml注射器将100 μl细胞接种液接种到裸鼠右上肢背部皮下,继续饲养2周后,选取18只肿瘤直径10 mm的裸鼠,作为动物模型用于下一步研究。
1.6.2 考察碳纳米管超声造影剂的体内显影 将构建的移植瘤裸鼠随机分为3组,每组6只。按照Wu等[21]多壁碳纳米管偶联前列腺干细胞的抗原抗体用于靶向超声增强与药物递送中的给药剂量,经尾静脉分别注射10 mg/kg (200 μl溶液)的MWCNT-PEG、MWCNT-PEG-HH,并以PBS为对照。注射后1 h、8 h、24 h,用超声造影仪考察碳纳米管在肿瘤、心脏、肾脏的显影情况。
2 结果
2.1 合成材料的红外、紫外光谱图 通过傅里叶变换红外光谱对合成产物进行分析,结果显示(图2A),MWCNT-COOH在1 704 cm-1出现了吸收峰,这主要归因于羧基上的羰基。当用PEG-2000共价修饰后,新的吸收带出现在2 928 cm-1和2 854 cm-1处,这属于-CH2对称拉伸振动。959 cm-1处的吸收峰归因于-C-O-C面内形变振动,而1 410 cm-1处的吸收峰属于-CH2的弯曲振动。此外,从图中可以看出,1 704 cm-1处的吸收带强度显著降低,表明MWCNT-COOH裸露的COOH基团通过共价键成功地与PEG2000结合。紫外光谱显示(图2B),MWCNT-PEG-HH在波长490~495 nm处有紫外吸收,表明Hedgehog抗体连接成功。

图2 MWCNT-PEG-HH的表征注:A.MWCNT-PEG-HH、MWCNT-PEG红外光谱图;B.MWCNT-PEG-HH、MWCNT-PEG紫外可见光谱图
2.2 多壁碳纳米管超声造影剂的形态、电位 将制备的碳纳米管造影剂于透射电子显微镜下观察,多壁碳纳米管具有良好的分散性,长度在400 nm左右(图3A)。电位粒径分析仪测得碳纳米管造影剂的电位为(-38.9±4.28) mV(图3B)。

图3 MWCNT-PEG-HH的表征注:A.MWCNT-PEG-HH的Zeta电位;B.MWCNT-PEG-HH的透射电镜图
2.3 多壁碳纳米管超声造影剂的体外摄取能力评价 通过流式细胞术观察胰腺癌细胞对靶向纳米造影剂的摄取情况。如图4A和4B所示,MWCNT-PEG-HH的摄取呈浓度依赖性,当浓度为100 μg/ml时,阳性Cy3细胞接近100%,平均荧光强度为578。说明人胰腺癌细胞可以高效摄取载Hedgehog抗体的多壁碳纳米管超声造影剂。
利用激光共聚焦显微镜观察多壁碳纳米管超声造影剂在人胰腺癌细胞内的分布情况。图4C中蓝色表示DAPI深染的细胞核,红色表示的是细胞内分布的Cy5荧光染料。从图中可以看出,MWCNT-PEG-HH组红色荧光出现在蓝色的细胞核周围,较Cy5组荧光强,说明Cy5被成功递送到SW1990细胞内。

图4 MWCNT-PEG-HH的细胞摄取情况注:A.流式细胞数据(MWCNT-PEG-HH浓度分别为10、100、200 μg/ml);B.平均荧光强度和百分比;C.激光共聚焦显微镜观察MWCNT-PEG-HH在细胞内的分布情况(a.Cy5;b.MWCNT-PEG-HH-Cy5)
2.4 多壁碳纳米管超声造影剂的细胞毒性 我们采用CCK-8考察多壁碳纳米管超声造影剂的细胞毒性。从图5可以看出,处理24 h、48 h后,多壁碳纳米管超声造影剂对SW1990细胞未见明显毒性。只有当碳纳米管浓度达到300 μg/ml时,SW1990细胞活力在处理后48 h约降至80%,说明多壁碳纳米管本身毒性较低。

图5 CCK-8法考察不同浓度条件下MWCNT-PEG-HH对SW1990细胞的细胞毒性(n=3)
2.5 考察碳纳米管超声造影剂体外显影情况 采用超声造影仪考察碳纳米管的体外造影能力。从图6可以看出,PBS溶液在体外基本无显影。而碳纳米管溶液在10 μg/ml时,即出现显影,当浓度达到200 μg/ml时,可以看到显影非常明显,且MWCNT-PEG-HH和MWCNT-PEG无显著差别。说明多壁碳纳米管超声造影剂在体外具有较好的显影效果。
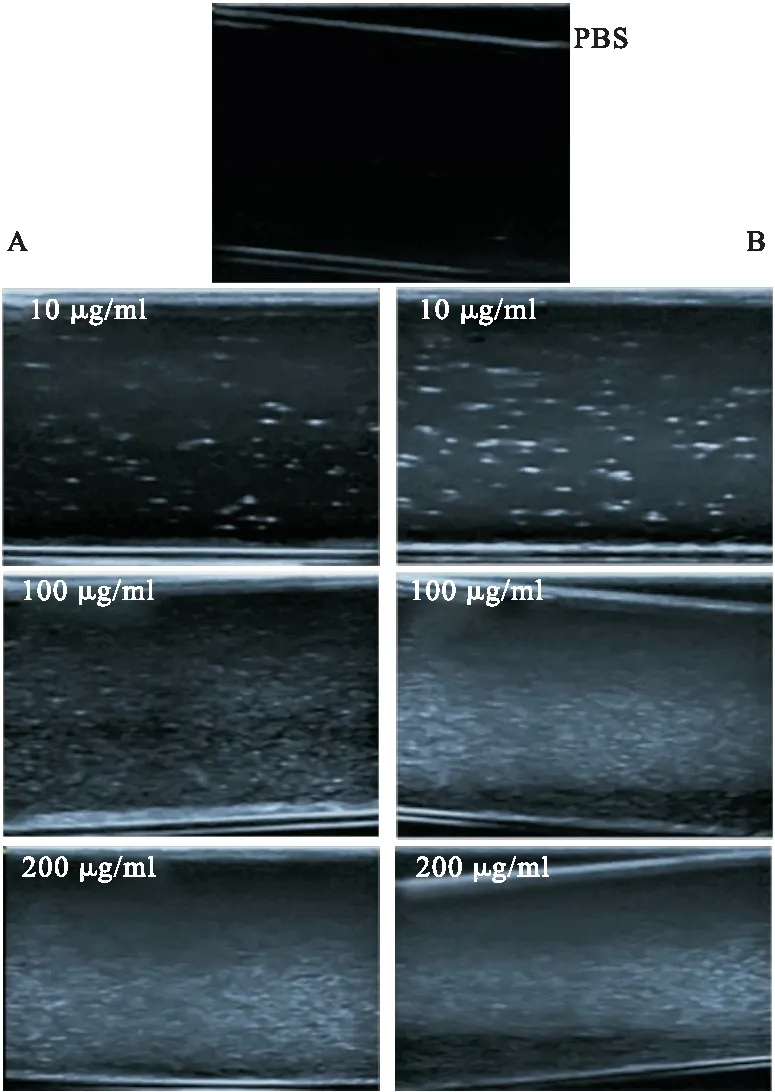
图6 MWCNT-PEG-HH、MWCNT-PEG-HH在不同浓度条件下体外显影图注:A.MWCNT-PEG;B.MWCNT-PEG-HH
2.6 考察碳纳米管超声造影剂的体内显影 给药前,分别用超声造影仪记录各组肿瘤、肾脏和心脏的显影成像并记录。如图7所示,与未治疗的小鼠相比,经尾静脉注射MWCNT-PEG-HH 8 h后,可以明显观察到超声造影剂在肿瘤部位的增强作用,表明碳纳米管超声造影剂在体内具有较高的超声增强作用。与MWCNT-PEG-HH高US信号增强相反,MWCNT-PEG处理组的US成像仅观察到轻微的增强。此外,肿瘤部位成像显示峰谷效应。随着注入时间的增加,增强作用先增加,然后逐渐变弱,并且增强作用可以维持很长时间,这可以为碳纳米管的诊断和治疗提供整合条件。
同时,我们研究了碳纳米管在肾脏和心脏中的分布,以评估体内的分布和代谢。如图7所示,肾脏在1 h时可出现轻微的US信号增强,而在8 h时可出现较高的US信号增强,然后减弱,表明碳纳米管具有肾脏代谢的特征。但是,在心脏中,各时间点,无论是二维模型还是CF模式,都没有增强信号,表明碳纳米管不会在心脏中积聚并产生毒性。
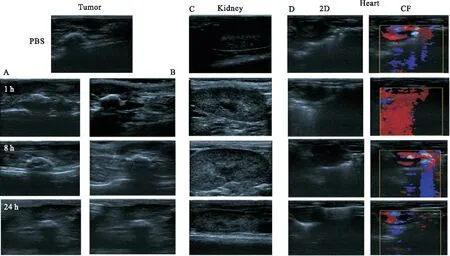
图7 MWCNT-PEG-HH体内显影图注:A.MWCNT-PEG在肿瘤组织中的显影;B.MWCNT-PEG-HH在肿瘤组织中的显影;C.MWCNT-PEG-HH在肾脏中的显影;D.2D及CF模式下MWCNT-PEG-HH在心脏中的显影
3 讨论
在本研究中,我们通过酰胺化反应合成了MWCNT-PEG-HH聚合物。在合成过程中,使用H2SO4和HNO3氧化MWCNT。细胞摄取结果表明,MWCNT-PEG-HH的细胞摄取效率明显高于MWCNT-PEG,这可能是由于抗体的修饰所致。细胞毒性研究表明,MWCNT-PEG-HH和MWCNT-PEG具有高度的生物相容性。这可能是由于碳纳米管的化学修饰增加了水溶性和生物相容性。本研究设计了用于肿瘤靶向成像的多壁碳纳米管。PEG修饰可以增加水溶性和多壁碳纳米管的稳定性[22]。Hedgehog单克隆抗体被用作胰腺癌的特定靶标。制备的MWCNT-PEG-HH具有良好的生物相容性,抗体的结合增强了细胞的摄取能力。在体外和体内研究中,制备的纳米靶标造影剂具有巨大的潜力,可以作为靶向CE-EUS造影剂。
综上所述,本研究选用PEG修饰多壁碳纳米管得到纳米级超声造影剂,在表面连接Hedgehog单克隆抗体以实现胰腺癌的靶向性,体内外评价表明其具有成为胰腺癌靶向的新型造影剂的潜力,后期我们将进一步包裹难溶性化疗药物以实现诊断与治疗的双重目的。
