芳酰基亚甲基丙二酸酯的无催化两步一锅法合成
2021-12-02陈文龙杨高升
齐 春, 陈文龙, 杨高升
(安徽师范大学 化学与材料科学学院 功能性分子固体安徽省高校重点实验室 分子基材料安徽省重点实验室,安徽 芜湖 241002)
芳酰基亚甲基丙二酸酯是一类重要的有机合成中间体,其作为Michael受体的共轭加成反应已被广泛用于喹喔啉、咪唑、苯并[1,4]-噻嗪[1]、2,4,5-三取代恶唑衍生物[2]、吡咯并苯并恶嗪[3]、色烯并吡咯[4]等杂环化合物的合成。2020年,Vilwanathan等报道了以盐酸苯甲脒与苯甲酰基亚甲基丙二酸酯的共轭加成为关键反应,合成的(2,5-二苯基咪唑-4-基)乙酸酯具有肺癌组蛋白脱乙酰酶抑制活性[5]。
近年来,芳酰基亚甲基丙二酸酯的合成研究主要聚焦于芳酰基亚甲基丙二酸酯作为Michael受体的不对称Michael加成及其应用[6-7]。Johnson等以硝基乙烷或硫醇与芳酰基亚甲基丙二酸酯的对映选择性共轭加成为关键反应,高对映选择性、高产率合成了具有3个相邻手性中心的多功能内酰胺[8]或内酯[9]。
关于芳酰基亚甲基丙二酸酯的制备,最早见诸报道的方法是芳酰甲基三苯基膦叶立德与酮基丙二酸酯的Wittig反应[10]。近期报道的方法包括trans-2-芳基-3-硝基环丙烷-1,1-二羧酸酯在BF3作用下的开环重排反应[1];醋酸铑催化芳基环氧乙烷与丙二酸酯的反应[8];铱配合物Ir(dFCF3ppy)2(dtbbpy)PF6作用下的2-芳基-2-环丙烯-1,1-二羧酸酯的光催化氧化[11];I2、 CuO和二甲亚砜(DMSO)作用下的芳基甲基酮与丙二酸酯的氧化偶联[7]。其中最直接的方法是芳基乙酮醛与丙二酸酯的缩合反应[6],但产率较低。此外,现有合成芳酰基亚甲基丙二酸酯方法还存在原料不易得、需要贵/重金属催化、产率不高等缺点。
芳基乙酮醛一般由芳基甲基酮的二氧化硒氧化[12]或α-卤代/羟基芳基乙酮的Kornblum氧化[13]制备,前者因涉及剧毒的硒氧化物而受限。我们设想将Kornblum氧化与Knoevenagel缩合放在一个反应体系(Scheme 1),用DMSO氧化α-溴代芳基乙酮(1),原位形成的芳基乙酮醛(2)立即与丙二酸酯缩合,发展芳酰基亚甲基丙二酸酯(3)的简易、高效合成方法。
Scheme 1
1 实验部分
1.1 仪器与试剂
XT-4A型显微熔点仪;Bruker Avance 500 MHz型核磁共振仪(CDCl3为溶剂、TMS为内标);Agilent 6100B型质谱仪。
α-溴代芳基乙酮、丙二酸酯、DMSO等试剂均为分析纯。
1.2 合成
将α-溴代芳基乙酮(0.5 mmol)溶于5 mL DMSO中,于60 ℃(浴温)搅拌一定时间(t1),TLC跟踪,溶液变为黄褐色。向反应体系中加入丙二酸酯(2.0 eq.)和4Å分子筛(500 mg),搅拌下反应一定时间(t2),溶液颜色变淡,TLC跟踪至反应结束。冷却至室温,向体系中加入乙酸乙酯,多次提取,合并提取液,用饱和食盐水洗涤3次,无水硫酸钠干燥,经硅胶硅胶柱层析纯化得芳酰基亚甲基丙二酸酯(3)。
2-(2-苯基-2-氧代亚乙基)丙二酸二乙酯(3a)[1]: 硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=15/1]纯化得黄色油状液体,产率73%;1H NMR(CDCl3, 500 MHz)δ: 8.03~7.92(m, 2H), 7.83(s, 1H), 7.67~7.58(m, 1H), 7.55~7.45(m, 2H), 4.34(q,J=7.1 Hz, 2H), 4.28(q,J=7.2 Hz, 2H), 1.35(t,J=7.1 Hz, 3H), 1.24(t,J=7.2 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 189.1, 164.5, 162.9, 136.5, 136.0, 135.3, 134.2, 128.9, 128.8, 62.5, 62.0, 14.0, 13.7; HR-MS(ESI-TOF)m/z: calcd for C15H17O5{[M+H]+}277.1071, found 277.1065。
2-(2-对甲基苯基-2-氧代亚乙基)丙二酸二乙酯(3b)[1]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=20/1]纯化得黄色油状液体,产率81%;1H NMR(CDCl3, 500 MHz)δ: 7.86(d,J=8.1 Hz, 2H), 7.83(s, 1H), 7.29(d,J=8.1 Hz, 2H), 4.34(q,J=7.1 Hz, 2H), 4.29(q,J=7.1 Hz, 2H), 2.43(s, 3H), 1.35(t,J=7.1 Hz, 3H), 1.25(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.6, 164.6, 163.0, 145.4, 136.2, 135.4, 133.7, 129.6, 129.0, 62.4, 61.9, 21.8, 14.0, 13.7; HR-MS(ESI-TOF)m/z: calcd for C16H19O5{[M+H]+}291.1227, found 291.1231。
2-(2-对甲氧基苯基-2-氧代亚乙基)丙二酸二乙酯(3c)[1]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=8/1]纯化得黄色油状液体,产率73%;1H NMR(CDCl3, 500 MHz)δ: 7.93(dd,J=9.3 Hz, 2.4 Hz, 2H), 7.81(s, 1H), 6.94(dd,J=9.3 Hz, 2.4 Hz, 2H), 4.39~4.22(m, 4H), 3.86(s, 3H), 1.33(t,J=7.1 Hz, 3H), 1.24(t,J=7.2 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 187.3, 164.7, 164.5, 163.0, 136.0, 135.4, 131.3, 129.2, 114.2, 62.4, 61.9, 55.6, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C16H19O6{[M+H]+}307.1176, found 307.1168。
2-(2-间甲氧基苯基-2-氧代亚乙基)丙二酸二乙酯(3d)[7]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=10/1]纯化得黄色油状液体,产率76%;1H NMR(CDCl3, 500 MHz)δ: 7.80(s, 1H), 7.53(d,J=7.6 Hz, 1H), 7.47(d,J=1.7 Hz, 1H), 7.44~7.35(m, 1H), 7.21~7.12(m, 1H), 4.33(q,J=7.1 Hz, 2H), 4.28(q,J=7.1 Hz, 2H), 3.84(s, 3H), 1.34(t,J=7.1 Hz, 3H), 1.25(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.9, 164.5, 162.9, 160.1, 137.4, 136.5, 135.2, 129.9, 121.7, 121.1, 112.4, 62.4, 62.0, 55.5, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C16H19O6{[M+H]+}307.1176, found 307.1184。
2-(2-邻甲氧基苯基-2-氧代亚乙基)丙二酸二乙酯(3e)[7]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=10/1]纯化得黄色油状液体,产率78%;1H NMR(CDCl3, 500 MHz)δ: 7.82(s, 1H), 7.79~7.71(m, 1H), 7.59~7.47(m, 1H), 7.08~6.94(m, 2H), 4.38~4.26(m, 4H), 3.91(s, 3H), 1.33(t,J=7.1 Hz, 3H), 1.29(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 189.7, 165.1, 163.4, 159.5, 139.3, 135.2, 133.4, 131.1, 126.7, 121.0, 111.8, 62.1, 61.8, 55.8, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C16H19O6{[M+H]+}307.1176, found 307.1174。
2-(2-对溴苯基-2-氧代亚乙基)丙二酸二乙酯(3f)[6-7]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=20/1]纯化得黄色蜡状固体,产率70%;1H NMR(CDCl3, 500 MHz)δ: 7.82(d,J=8.6 Hz, 2H), 7.77(s, 1H), 7.65(d,J=8.6 Hz, 2H), 4.34(q,J=7.1 Hz, 2H), 4.29(q,J=7.1 Hz, 2H), 1.35(t,J=7.1 Hz, 3H), 1.26(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.2, 164.3, 162.7, 136.9, 134.8, 134.7, 132.3, 130.2, 129.7, 62.6, 62.1, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C15H16O5Br{[M+H]+}355.0176, found 355.0173。
2-(2-对氯苯基-2-氧代亚乙基)丙二酸二乙酯(3g)[1]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=20/1]纯化得黄色油状液体,产率67%;1H NMR(CDCl3, 500 MHz)δ: 7.89(dd,J=8.8 Hz, 2.1 Hz, 2H), 7.77(s, 1H), 7.46(dd,J=8.8 Hz, 2.1 Hz, 2H), 4.33(q,J=7.1 Hz, 2H), 4.28(q,J=7.2 Hz, 2H), 1.33(t,J=7.1 Hz, 3H), 1.24(t,J=7.2 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.0, 164.3, 162.7, 140.8, 136.9, 134.7, 134.4, 130.2, 129.3, 62.5, 62.0, 14.0, 13.7; HR-MS(ESI-TOF)m/z: calcd for C15H16O5Cl{[M+H]+}311.0681, found 311.0687。
2-(2-对氟苯基-2-氧代亚乙基)丙二酸二乙酯(3h)[6]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=15/1]纯化得黄色油状液体,产率85%;1H NMR(CDCl3, 500 MHz)δ: 8.06~7.95(m, 2H), 7.79(s, 1H), 7.23~7.13(m, 2H), 4.34(q,J=7.1 Hz, 2H), 4.29(q,J=7.1 Hz, 2H), 1.34(t,J=7.1 Hz, 3H), 1.25(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 187.6, 166.4(d,1JFC=257.0 Hz), 164.4, 162.8, 136.7, 135.0, 132.6, 131.6(d,3JFC=9.6 Hz), 116.2(d,2JFC=22.0 Hz), 62.5, 62.0, 14.0, 13.7; HR-MS(ESI-TOF)m/z: calcd for C15H16O5F{[M+H]+}295.0976, found 295.0973。
2-(2-对硝基苯基-2-氧代亚乙基)丙二酸二乙酯(3i)/硅胶柱层析[V(石油醚)/V(乙酸乙酯)=6/1]纯化得黄色油状液体,产率58%;1H NMR(CDCl3, 500 MHz)δ: 8.34(d,J=8.8 Hz, 2H), 8.12(d,J=8.8 Hz, 2H), 7.78(s, 1H), 4.35(q,J=7.1 Hz, 2H), 4.30(q,J=7.1 Hz, 2H), 1.35(t,J=7.1 Hz, 3H), 1.26(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 187.9, 164.0, 162.5, 150.8, 140.3, 137.8, 134.1, 129.8, 124.1, 62.8, 62.2, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C15H16NO7{[M+H]+}322.0921, found 322.0915。
2-(2-间硝基苯基-2-氧代亚乙基)丙二酸二乙酯(3j)[7]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=20/1]纯化得黄色油状液体,产率77%;1H NMR(CDCl3, 500 MHz)δ: 8.78(d,J=1.8 Hz, 1H), 8.48(dd,J=7.8 Hz, 1.6 Hz, 1H), 8.29(d,J=7.8 Hz, 1H), 7.81(s, 1H), 7.74(t,J=8.0 Hz, 1H), 4.37(q,J=7.1 Hz, 2H), 4.31(q,J=7.1 Hz, 2H), 1.37(t,J=7.1 Hz, 3H), 1.28(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 187.2, 164.1, 162.5, 148.6, 138.0, 137.3, 134.2, 133.8, 130.3, 128.3, 123.6, 62.8, 62.2, 14.0, 13.8; HR-MS(ESI-TOF)m/z: calcd for C15H16NO7{[M+H]+}322.0921, found 322.0916。
2-(2-邻硝基苯基-2-氧代亚乙基)丙二酸二乙酯(3k)/硅胶柱层析[V(石油醚)/V(乙酸乙酯)=6/1]纯化得黄色油状液体,产率65%;1H NMR(CDCl3, 500 MHz)δ: 8.17(d,J=8.2 Hz, 1H), 7.77(t,J=7.5 Hz, 1H), 7.74~7.65(m, 1H), 7.58~7.48(m, 1H), 7.27(s, 1H), 4.29(q,J=7.1 Hz, 2H), 4.21(q,J=7.1 Hz, 2H), 1.30(t,J=7.1 Hz, 6H);13C NMR(CDCl3, 125 MHz)δ: 189.6, 164.2, 162.4, 146.2, 136.1, 135.4, 134.53, 134.48, 131.8, 129.2, 124.4, 62.6, 62.2, 13.9, 13.8; HR-MS(ESI-TOF)m/z: calcd for C15H16NO7{[M+H]+}322.0921, found 322.0925。
2-(2-对三氟甲基苯基-2-氧代亚乙基)丙二酸二乙酯(3l)/硅胶柱层析[V(石油醚)/V(乙酸乙酯)=20/1]纯化得黄色油状液体,产率74%;1H NMR(CDCl3, 500 MHz)δ: 8.07(d,J=8.1 Hz, 2H), 7.84~7.72(m, 3H), 4.35(q,J=7.1 Hz, 2H), 4.29(q,J=7.1 Hz, 2H), 1.35(t,J=7.1 Hz, 3H), 1.26(t,J=7.1 Hz, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.4, 164.2, 162.6, 138.6, 137.4, 135.3(q,2JFC=33.0 Hz), 134.4, 129.1, 126.0(q,3JFC=3.6 Hz), 123.4(q,1JFC=272.7 Hz), 62.6, 62.2, 14.0, 13.7; HR-MS(ESI-TOF)m/z: calcd for C16H16O5F3{[M+H]+}345.0944, found 345.0937。
2-(2-氧代-2-苯基亚乙基)丙二酸二甲酯(3m)[11]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=10/1]纯化得黄色油状液体,产率72%;1H NMR(CDCl3, 500 MHz)δ: 8.00~7.93(m, 2H), 7.88(s, 1H), 7.68~7.58(m, 1H), 7.56~7.45(m, 2H), 3.88(s, 3H), 3.81(s, 3H);13C NMR(CDCl3, 125 MHz)δ: 188.9, 165.0, 163.2, 136.0, 135.6, 134.3, 129.0, 128.8, 53.3, 52.9; HR-MS(ESI-TOF)m/z: calcd for C13H13O5{[M+H]+}249.0757, found 249.0753。
2-(2-氧代-2-苯基亚乙基)丙二酸二异丙酯(3n)[11]: 硅胶柱层析[V(石油醚)/V(乙酸乙酯)=10/1]纯化得黄色油状液体,产率70%;1H NMR(CDCl3, 500 MHz):δ7.97(dd,J=8.2 Hz, 1.0 Hz, 2H), 7.79(s, 1H), 7.62(t,J=7.4 Hz, 1H), 7.50(t,J=7.8 Hz, 2H), 5.26~5.12(m, 2H), 1.33(d,J=6.3 Hz, 6H), 1.25(d,J=6.3 Hz, 6H);13C NMR(CDCl3, 125 MHz)δ: 189.2, 164.0, 162.5, 137.2, 136.2, 134.7, 134.1, 128.89, 128.86, 70.3, 69.7, 21.6, 21.4; HR-MS(ESI-TOF)m/z: calcd for C17H21O5{[M+H]+}305.1384, found 305.1389。
2 结果与讨论
2.1 反应条件的优化
以α-溴代苯乙酮(1a)与丙二酸二乙酯的反应为模型反应,优化反应条件。鉴于α-溴代苯乙酮发生Kornblum氧化反应使用的氧化剂为DMSO[13-15],故选择DMSO作为反应的溶剂。
首先尝试一锅反应,将α-溴代苯乙酮(1a)和丙二酸二乙酯(2.0 eq.)溶于DMSO中,在室温下反应24 h,TLC跟踪发现有苯乙酮醛生成,但没有观察到2-苯甲酰基亚甲基丙二酸二乙酯(3a)生成,Knoevenagel缩合没有发生。而添加4Å分子筛、提高反应温度,可以形成2-苯甲酰基亚甲基丙二酸二乙酯(3a),但反应体系复杂,分离困难。

Scheme 2
接着,尝试了两步一锅法反应,第一步进行Kornblum氧化,将α-溴代苯乙酮(1a)与过量DMSO混合,室温下搅拌1 h,使α-溴代苯乙酮完全溶解,然后在60 ℃下加热6 h(t1),生成苯乙酮醛;第二步进行Knoevenagel缩合,直接向第一步反应结束的体系中加加入丙二酸二乙酯(2.0 eq.)和适量4Å分子筛,继续在60 ℃下加热28 h(t2),以两步73%的总产率得到2-苯甲酰基亚甲基丙二酸二乙酯(3a)。
2.2 底物普适性
苯环上存在不同取代基的α-溴代苯乙酮(1)与不同丙二酸酯的反应情况见表1。由表1可知,取代基的电子效应和空间效应对反应有一定的影响。α-溴代苯乙酮苯环上的给电子基对其Kornblum氧化影响很小(t1相近),相应苯乙酮醛与丙二酸二乙酯的Knoevenagel缩合时间(t2)较短,且总产率较高(Table 1, entries 2~5);α-溴代苯乙酮苯环上的吸电子基对其Kornblum氧化有利(t1明显较短),相应苯乙酮醛与丙二酸二乙酯的Knoevenagel缩合较快(t2明显较短),总产率有高有低(Table 1, entries 6~10, 12)。
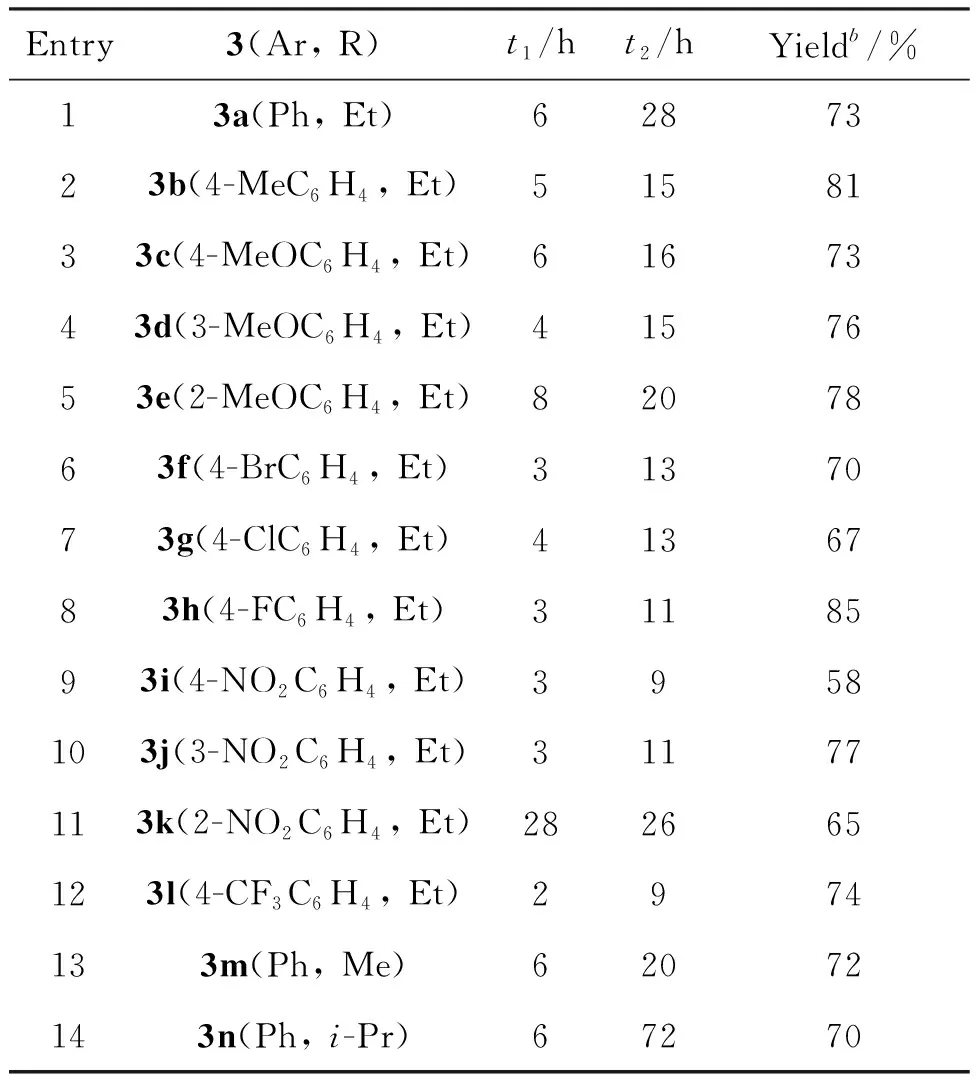
表1 芳酰基亚甲基丙二酸酯的合成
苯环对位存在氟原子时的总产率最高(Table 1, entry 8),可能与氟有较强的给电子共轭效应有关;苯环对位存在硝基时的总产率最低(Table 1, entry 9),可能缘于硝基强的吸电子共轭效应;苯环邻位存在硝基的α-溴代苯乙酮的Kornblum氧化和Knoevenagel缩合都较慢(Table 1, entry 11),可能是邻位硝基的位阻所致。
不同丙二酸酯与苯乙酮醛的Knoevenagel缩合显著受到丙二酸酯中烷基位阻的影响,丙二酸二甲酯最快(Table 1, entry 13),丙二酸二乙酯次之(Table 1, entry 1),丙二酸二异丙酯最慢(Table 1, entry 14)。
综上可见,取代基的兼容性很好,两步反应的总产率大多超过70%,苯环上4-位有强吸电子的硝基时两步反应的总产率低于60%。
2.3 反应机理
DMSO先与α-溴代芳基乙酮发生亲核取代,再在碱作用下消除,生成芳基乙酮醛[16];然后,烯醇化的丙二酸酯与芳基乙酮醛发生亲核加成,加成产物脱水,生成芳酰基亚甲基丙二酸酯。
用DMSO将α-溴代芳基乙酮氧化,生成的芳基乙酮醛不用分离,直接与丙二酸酯在无催化剂存在下缩合,以中等到好的总产率制得芳酰基亚甲基丙二酸酯,实现Kornblum氧化和Knoevenagel缩合的两步一锅反应,发展了芳酰基亚甲基丙二酸酯的简易、高效制备方法。
