姜黄素通过调节Bcl-2/Bax/Caspase-3信号通路活性保护脑出血大鼠神经细胞的实验研究
2021-12-01潘飞豹蒋丝丽蒋世杰
潘飞豹,柯 莉,蒋丝丽,蒋世杰
脑出血是脑卒中的一种常见类型,发病率高,死亡率高,多数病人在发病后会导致长期的神经功能缺损[1]。脑出血发生后,脑血管渗出的血液在实质内形成血肿,进而引起局部压力,导致原发性脑损伤[2]。手术清除血肿治疗可以消除这种结构性损伤。脑出血后继发性脑损伤是由血肿降解的血液成分和产物触发的,可引起细胞毒性、氧化应激和炎症,进而导致细胞死亡、脑水肿和神经行为缺陷[3]。目前,越来越多的证据表明,氧化应激是脑出血继发性脑损伤的关键因素,其原因是活性氧(ROS)的产生,通过直接氧化细胞脂质、蛋白质和DNA而导致细胞损伤[4];抗氧化酶类,包括谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性会随之下降。姜黄素是从姜科、天南星科中一些植物的根茎中提取的一种化学成分,是植物界很稀少的具有二酮的色素,为二酮类化合物[5]。姜黄素能够抗氧化、抗炎、抑制线粒体级联活性,并在阿尔茨海默病、癫痫、认知障碍、帕金森病等各种中枢神经系统疾病的临床前模型中显示出神经保护活性。有报道显示,姜黄素可通过其抗凋亡、抗氧化和抗炎活性,在实验性蛛网膜下腔出血后的早期脑损伤中起到神经保护作用[6]。但是,姜黄素在脑出血后脑损伤中是否具有神经保护活性尚不清楚。因此,本研究探讨了姜黄素对脑出血后氧化应激和神经细胞凋亡的保护作用,旨在为临床治疗提供更多参考。
1 材料与方法
1.1 实验动物与实验设计 30只无特定病原体(SPF)级雄性SD大鼠,10周龄,体质量320~350 g,购自浙江省农业科学院[实验动物生产许可证号:SCXK(浙)2017-0001]。实验开始前至少1周,大鼠被安置在温度(23±2)℃、12 h光照/黑暗周期交替、湿度50%~60%的动物饲养笼中。将30只大鼠随机分为假手术组(Sham组)、脑出血+溶媒组(CH+V组)、脑出血+姜黄素组(CH+Cur组),每组均为10只。通过尾状核注射胶原酶制备大鼠脑出血模型,大鼠用戊巴比妥钠腹腔注射麻醉后,利用立体定向仪将24G静脉留置针进针至尾状核中心并固定于颅骨。将0.3个单位的Ⅳ型胶原酶,溶解于1.0 mL生理盐水中,用Hamilton微量注射器以1.1 mL/min的速度注入右侧尾状体内,留针10 min,然后慢慢拔出。颅骨钻孔是用骨蜡封闭的。实验大鼠可自由饮水和进食。Sham组:Hamilton微量注射器抽取药物为等量生理盐水,其余操作步骤同上。术后24 h行Rosenberg评分[7],>10分者入选。大鼠苏醒后Sham组及CH+V组予以等量生理盐水灌胃,CH+Cur组予以姜黄素100 mg/kg灌胃,术后2 h、24 h、48 h各注射1次。
1.2 原代神经元培养 从E18大鼠胚胎中获得原代皮层神经元。用磷酸缓冲盐溶液(PBS)机械粉碎分离皮层组织。将分离的皮层神经元按105个/皿的密度加入含1%胎牛血清、1%谷氨酰胺和0.3%葡萄糖的神经基础培养液中进行培养。神经元细胞在37 ℃、含5% CO2的培养箱中培养至第12天准备实验,3 d更换1次细胞培养液。
1.3 细胞活力、乳酸脱氢酶(LDH)和末端脱氧核苷酸转移酶修饰的dUTP缺口末端标记(TUNEL)检测 从大鼠动脉血中提取溶血物[8]。将全血中的红细胞在干冰上冷冻20 min进行裂解。之后,将溶血液保存在-80 ℃待测。用不同浓度的姜黄素(0 mmol/L、10 mmol/L、100 mmol/L、300 mmol/L)或不同浓度(0、0.100、0.020、0.010、0.005)的溶血物在神经基础培养液中处理24 h,再用100 mmol/L的姜黄素或0.100的溶血剂在神经基础培养液中处理0 h、12 h、24 h、48 h和72 h。每孔加入10 μL细胞计数试剂盒(CCK-8),37 ℃孵育2 h,在450 nm处测定吸光度。此外,神经元用0.100溶血产物或与100 mmol/L姜黄素共同作用于神经基础培养液中24 h。收集每孔培养液100 mL。LDH细胞毒性检测试剂盒按照制造商说明书(南京建成生物工程研究所)进行测定。另外,TUNEL检测细胞凋亡。在荧光显微镜下观察照片,并对凋亡神经元的数量进行定量。
1.4 病变体积及脑含水量检测 在术后72 h评估脑损伤体积。在戊巴比妥钠深度麻醉下,大鼠先经心灌注PBS,再灌注4%多聚甲醛。然后取脑连续切片(2 mm,针入口处前后各2 mm),照相。血肿面积由2人独立地应用Image J软件定量计算。大鼠在术后72 h进行断头,取出大脑,分成同侧和对侧皮质。将分离的组织样品称重,获得湿重,然后在100 ℃烘干48 h确定干重。脑组织含水量百分比=(湿重-干重)/湿重×100%。
1.5 蛋白印迹法(Western Blot) 取下大鼠脑组织后,在RIPA裂解缓冲液中制备匀浆,在4 ℃条件下以13 000×g/min的速度离心,使用Bradford蛋白分析试剂盒测量蛋白质浓度。在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳胶中负载等量的蛋白质(每个样品20 μg),并转移到硝酸纤维素膜上。用抗 Kelch样环氧氯丙烷相关蛋白-1(Keap1)抗体、抗核因子E2相关因子2(Nrf2)抗体、抗血红素加氧酶-1(HO-1)抗体、抗β-actin抗体、抗Bcl-2抗体、抗Bax抗体、抗活性Caspase-9抗体或抗活性Caspase-3抗体孵育过夜,然后与辣根过氧化物酶连接的二级抗体孵育3 h。TBST缓冲液洗涤,化学发光液(ECL)发光显影。采用Image J软件对图像进行分析。
1.6 免疫荧光和TUNEL染色 大鼠在戊巴比妥钠深度麻醉下,术后72 h经心内灌注4%多聚甲醛/PBS进行免疫荧光染色。取下脑组织,4%多聚甲醛/PBS固定1 d。用冰冻切片机获得8 mm厚的冠状面。冠状切片用0.5% Triton X-100/PBS孵育,用5%山羊血清封闭,然后与抗神经元核抗体(稀释1∶200)或兔抗活性Caspase-3抗体(稀释1∶200)在4 ℃孵育过夜。切片用PBS洗涤,与羊抗鼠IgG或羊抗兔IgG(稀释1∶400)二抗孵育。根据制造商的说明书,使用原位细胞死亡检测试剂盒(德国罗氏)进行TUNEL染色以检测神经元凋亡。最后,用PBS洗涤切片,在荧光显微镜下观察。
1.7 生化分析 在戊巴比妥钠深度麻醉下于术后72 h处死大鼠。取脑,取同侧皮质血肿段。取组织匀浆于冰冷Tris-HCl缓冲液(pH 7.4)中,4 ℃离心,离心速度为13 000×g/min,采用Bradford蛋白分析试剂盒(北京Solarbio)测定蛋白质浓度。利用ROS、SOD和GSH-Px试剂盒(北京Solarbio)测定ROS、GSH-Px、SOD表达水平。用南京建成生物工程研究所生产的商品化试剂盒检测8-羟色胺(8-OHDG)、3-硝基酪氨酸、丙二醛(MDA)含量。
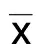
2 结 果
2.1 姜黄素抑制血肿溶解物诱导的原代皮层神经元凋亡 1 mmol/L、10 mmol/L、100 mmol/L、300 mmol/L姜黄素对原代皮层神经元细胞活力无影响(见图1A)。在72 h内,100 mmol/L姜黄素对原代皮层神经元的细胞活力也无影响(见图1B)。用不同浓度溶血产物处理24 h,原代皮层神经元细胞存活率明显降低(见图1C)。当溶血产物浓度为0.100时,原代皮层神经元在12 h、24 h、48 h和72 h细胞存活率明显降低(见图1D)。基于以上结果,本实验选择100 mmol/L姜黄素和浓度为0.100的溶血产物进行后续实验。与对照组相比,大脑皮层神经元经0.100溶血产物处理24 h后,细胞存活率明显下降,LDH水平和细胞凋亡率明显增加,而经100 mmol/L姜黄素处理可有效减弱这一效应(见图1E~图1G)。
图1 姜黄素抑制血肿溶解物诱导的原代皮层神经元细胞活力及凋亡情况
2.2 姜黄素对脑出血后72 h脑含水量的影响 CH+V组与CH+Cur组的血肿体积分别为(35.5±6.2)mm3、(32.6±5.7)mm3,差异无统计学意义(P>0.05),详见图2。在脑出血后72 h评估血肿周围脑水肿情况,与Sham组相比,脑出血大鼠同侧皮层脑组织含水量增加,姜黄素可明显降低脑出血后72 h脑组织含水量,见图3。

图2 姜黄素对脑出血后72 h脑血肿体积的影响

图3 姜黄素对脑出血后72 h脑组织含水量的影响
2.3 姜黄素对脑出血后72 h血肿周围组织氧化应激的影响 与Sham组相比,脑出血大鼠脑组织ROS、8-OHDG、3-硝基酪氨酸、MDA水平明显升高(P<0.05),而姜黄素干预可降低脑出血后72 h ROS、8-OHDG、3-硝基酪氨酸、MDA水平。与Sham组比较,CH+V组GSH-Px和SOD活性降低,而姜黄素减轻了GSH-Px和SOD的活性下降。详见表2。为了进一步探讨姜黄素在脑出血后氧化应激中的作用,利用Western Blot法检测了Keap1-Nrf2信号通路相关蛋白变化。结果表明,与Sham组相比,脑出血后Keap1表达降低,Nrf2和HO-1表达增加;与CH+V组相比,CH+Cur组Keap1、Nrf2和HO-1的表达明显增加。详见图4。

表2 姜黄素对脑出血后72 h血肿周围组织氧化应激指标的影响(±s)
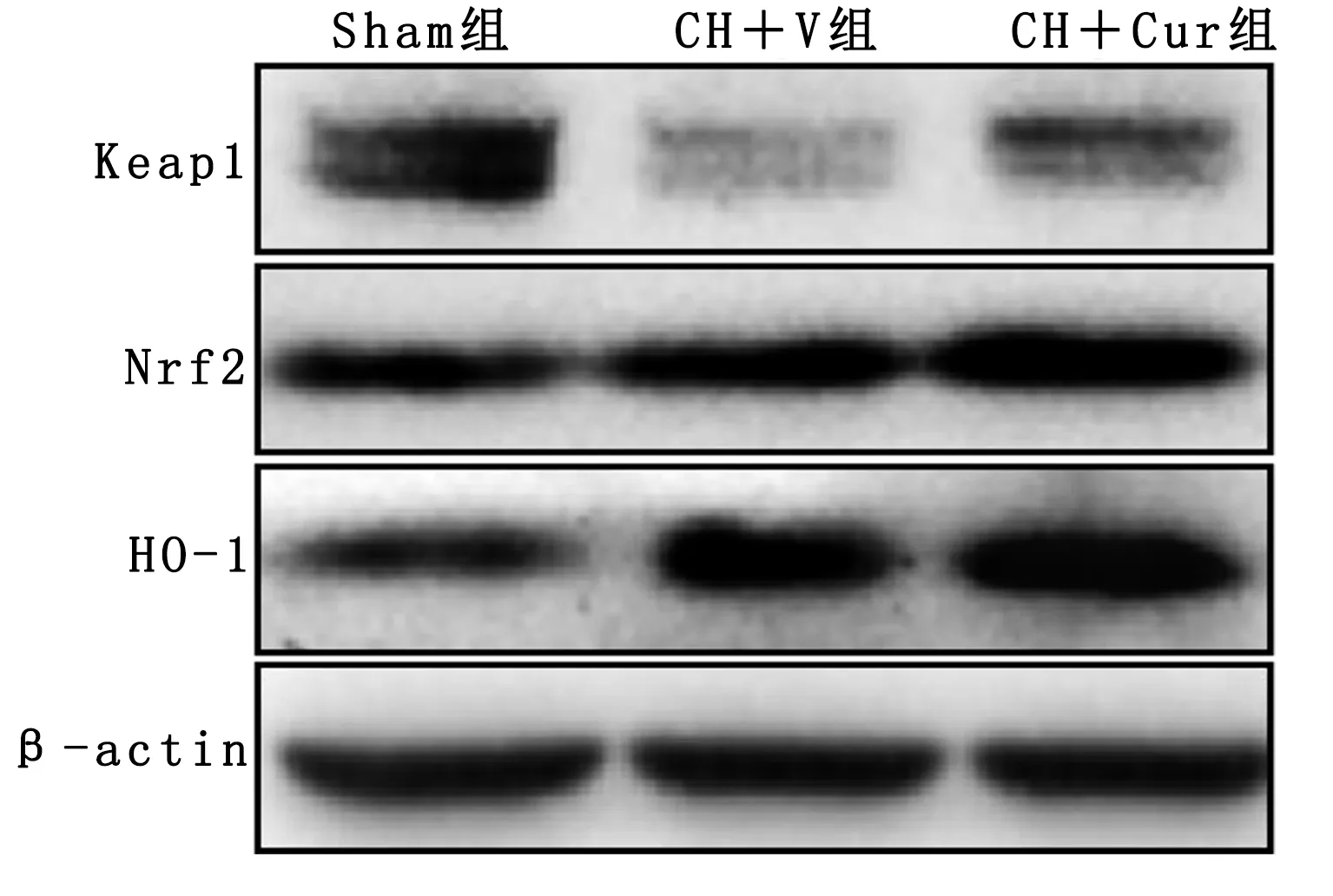
图4 Keap1-Nrf2信号通路相关蛋白表达
2.4 姜黄素对脑出血后Bcl-2/Bax/Caspase信号通路活性的影响 Western Blot结果显示,与CH+V组相比,CH+Cur组Bcl-2表达明显增加;CH+V组的Bax、活化Caspase-9和活化Caspase-3水平明显高于Sham组,而CH+Cur组Bax、活化Caspase-9和活化Caspase-3的表达明显低于CH+V组。详见图5。
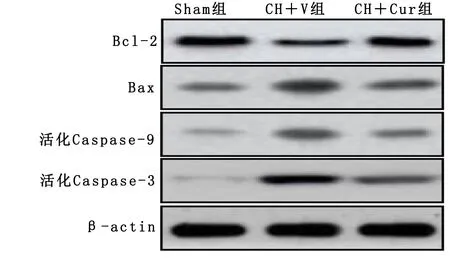
图5 姜黄素对脑出血后Bcl-2/Bax/Caspase信号通路活性的影响
2.5 姜黄素对脑出血后神经细胞凋亡的影响 采用活化Caspase-3或TUNEL/Neun染色方法检测脑出血后72 h神经细胞凋亡情况,与Sham组相比,脑出血诱导的Caspase-3和TUNEL阳性神经元数量明显增加。然而,与CH+V组相比,姜黄素能明显减少活化Caspase-3和TUNEL阳性神经元的数量。详见图6。

图6 姜黄素对脑出血后神经细胞凋亡的影响
3 讨 论
本研究发现,姜黄素(<300 mmol/L)对原代皮层神经元的细胞活力没有影响,提示姜黄素对神经元没有毒性。有报道表明,血肿溶解液诱导的皮层神经元细胞凋亡是一种模拟蛛网膜下腔出血临床病理生理过程的体外模型,在该体外模型中,血肿溶解液诱导的神经元凋亡是一种剂量依赖的方式[9],与本研究一致。本研究发现血肿溶解液可导致皮层神经元细胞凋亡。胶原酶诱导的脑出血大鼠模型能够复制人脑出血模型中观察到的病理反应,利用胶原酶消化血管胶原,并导致出血进入周围脑组织[10]。在实验性的脑出血大鼠模型中,血肿周围脑水肿在24~72 h达到高峰。本研究结果也显示,脑出血后72 h,同侧皮质的脑含水量明显增加,而姜黄素减轻了脑出血引起的血肿周围脑水肿,这一点得到了以往报道的支持。
氧化应激是脑出血后继发性脑损伤的重要因素,ROS的产生导致脂质、蛋白质和核酸的损伤[11]。本研究发现,姜黄素可明显降低脑出血后72 h升高的ROS水平,也可降低脑出血后72 h由脑出血引起的脂质(MDA)、蛋白质(3-硝基酪氨酸)和核酸(8-OHDG)氧化损伤标志物的增加。Keap1/Nrf2信号通路在脑出血后脑组织的氧化损伤保护中起着至关重要的作用。姜黄素可通过上调多种抗氧化酶的表达来对抗脑出血诱导的氧化应激。有研究表明,在脑出血损伤状态下Nrf2、HO-1蛋白表达升高可发挥对机体的自我保护机制,减轻脑出血损伤[12]。本研究中,CH+V组Nrf2、HO-1表达水平明显升高,而姜黄素治疗后Nrf2、HO-1表达明显上调,说明姜黄素可能加强了这种保护作用。此外,本研究还发现姜黄素明显提高了SOD和GSH-Px的活性,提示姜黄素具有拮抗脑出血诱导的氧化应激的作用。
尽管凋亡过程的详细机制尚不完全清楚,但是已经确定Caspase在凋亡执行过程中起着至关重要的作用,而且细胞凋亡的过程实际上是Caspase被活化并发生凋亡蛋白酶的级联反应[13]。Caspase家族蛋白存在于胞浆中,其同源性很高,结构相似,均含有一个半胱氨酸激活位点,特异性地断开天冬氨酸残基后的肽键,目前被发现的Caspases有14种,参与调节多种生物学过程,与细胞凋亡密切相关,还参与细胞的生长、分化、增殖和运动[14]。同时,Caspase依赖性程序性死亡在脑出血氧化应激导致线粒体内膜损伤、线粒体通透性转变中起关键作用,这一过程受Bcl-2/Bax相对比例的调控[15]。随后,凋亡诱导因子从线粒体释放到胞浆,进而激活Caspasse-9和Caspase-3。本实验中,姜黄素在脑出血后72 h增加了Bcl-2的表达,而降低了Bax的表达及Caspase-9和Caspase-3的活性,也减少了活跃的Caspase-3和TUNEL阳性神经元的数量。这表明姜黄素对脑出血相关的神经元细胞凋亡有明显的抑制作用。
综上所述,姜黄素可以减轻脑出血后继发性脑损伤的氧化应激和神经细胞凋亡。
