骨髓间充质干细胞外泌体对高血压大鼠血管内皮的影响及机制研究
2021-12-01杨东伟
郑 茜,张 勇,杨东伟
高血压是以体循环动脉血压升高为特征的慢性病,可伴有心、脑、肾等全身重要器官功能和器质性损伤,是心脑血管病重要的危险因素[1]。血管内皮功能受损是高血压的重要发病机制,也是导致各靶器官损害的重要原因,因此,改善血管内皮功能是治疗高血压的重要步骤[2-3]。外泌体(exosome,exo)是能被多数细胞分泌的微小膜泡,可携带来源细胞的特征,与靶细胞受体结合,通过其携带和传递的蛋白、微小核糖核酸(microRNA,miRNA)、信使核糖核酸(messengerRNA,mRNA)等内容物影响受体细胞功能[4]。研究证实,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可分化为血管内皮细胞,促进心肌梗死后新血管的形成,并有分化为心肌细胞的能力[5],因此,BMSCs-exo成为心血管疾病治疗研究的热点。miRNA是外泌体发挥功能的重要物质,miR-132-3p是具有血管形成能力的特异性miRNA,可调控血管内皮功能,且经Exocarta数据库检索发现BMSCs-exo含有miR-132-3p的表达[6]。目前关于BMSCs-exo在心肌梗死、脑缺血缺氧性损伤等方面的研究较多,但在高血压方面的研究鲜见。故本研究通过分离培养诱导BMSCs-exo,干预自发性高血压大鼠(SHR),分析BMSCs-exo对高血压大鼠血管内皮的影响及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 无特定病原体(SPF)级雄性SHR 40只,12周龄,体质量260~280 g;SPF级雄性WKY大鼠10只,12周龄,体质量260~280 g;SPF级WKY大鼠5只,2~3周龄,体质量40~50 g。购自广州市白云区龙归兴科动物养殖场,生产许可证号:SCXK(粤)2017-0042。
1.1.2 药物、主要试剂和仪器 EBM-2、L-DMEM培养液、胰蛋白酶(美国Gibco公司),Ⅱ型胶原酶、双抗(美国Hy Clone公司),miR-132-3p高表达组慢病毒颗粒/空载体慢病颗粒(上海吉满生物科技有限公司),兔抗鼠CD63、CD81、CD34、CD45一抗,辣根过氧化物酶标记的山羊抗兔二抗(德国默克公司),内皮素-1(endothelin-1,ET-1)、一氧化氮(nitric oxide,NO)、血栓素B2(thromboxane B2,TXB2)、前列环素(prostacyclin,PGI2)试剂盒(上海碧云天生物技术有限公司),7500实时荧光定量聚合酶链式反应(qRT-PCR)系统(美国Applied Biosystems公司)、CheniDoc XRS化学发光成像分析系统(美国Bio-rad公司),日立HITACHI透射电子显微镜(日本株式会社日立制作所),M500荧光显微镜(赛默飞世尔科技中国有限公司),moorLAB-NIBP小动物无创血压测量仪(北京吉安得尔科技有限公司)。
1.2 实验方法
1.2.1 大鼠BMSCs体外分离培养[7]及鉴定 脱颈法处死2~3周龄WKY大鼠,浸泡于75%乙醇中10 min,将双下肢股骨、胫骨、肱骨取出放置于4%双抗的无菌培养皿内,暴露骨髓腔,以无菌注射器抽吸L-DMEM培养基反复冲洗获取骨髓细胞,放置于离心管中,800×g离心5 min,去上清,L-DMEM完全培养基重悬,放置于培养瓶中,于37 ℃、5%二氧化碳(CO2)培养箱中培养,每2 d更换培养液1次,至细胞融合到80%~90%,传代培养。
选取P3细胞,磷酸缓冲盐溶液(PBS)重悬细胞,调整细胞密度1×106个/mL,分装为5管,1管为对照组,剩余4管分别加入CD63、CD81、CD34、CD45,室温避光孵育0.5 h,PBS洗涤后重悬细胞,以流式细胞技术鉴定细胞免疫表型。
1.2.2 BMSCs-exo培养及鉴定 应用差速离心法提取BMSCs-exo,取生长良好的P3 BMSCs,弃培养基,PBS洗涤2次,更换15%不含外泌体的胎牛血清配制L-DMEM培养基,继续培养48 h,收集上清液,4 ℃、500×g离心8 min,2 000×g离心20 min,取上清液,微孔滤过膜过滤后加入超速离心管中,4 ℃、120 000×g离心2 h,弃上清液,PBS冲洗管壁,更换新的超速离心管,4 ℃、120 000×g离心70 min,去上清,保存于-80 ℃备用。取外泌体悬液50 μL,2.5%戊二醛固定于100目碳膜铜网,滤纸吸去边缘液体,加入3%磷钨酸室温下负染1 min,滤纸吸干后于烤灯下烤干,铜网置于样品槽中,透射电镜下调节焦距及亮度,观察外泌体形态。
应用20 μL RIPA裂解液提取胶质瘤干细胞分泌的外泌体(GSCs-exo)蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离转移至聚偏氟乙烯(PVDF)膜,封闭液封闭2 h,加入CD63、CD81一抗(1∶500),4 ℃孵育过夜,TBST洗膜后加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000),孵育、曝光、显影,以图像分析软件分析目的条带灰度值,以目的条带与内参条带β-actin比值表示目的蛋白的表达水平。
1.2.3 SHR分组及干预方法 SHR适应性饲养1周,随机分为BMSCs-exo组(10只)、对照组(10只)、miR-132-3p高表达组(10只)、miR-132-3p空载组(10只),WKY大鼠为健康组(10只)。BMSCs-exo组以BMSCs-exo尾静脉注射,每次30 μg,隔日1次,连续注射7次,miR-132-3p高表达组与miR-132-3p空载组分别以miR-132-3p高表达慢病毒颗粒和空载体慢病毒颗粒尾静脉注射,每次0.1 mL,3 d注射1次,至BMSCs-exo组干预结束,对照组和健康组与BMSCs-exo组同法注射生理盐水。
1.2.4 qRT-PCR检测大鼠主动脉miR-132-3p表达情况 于-80 ℃保存主动脉,液氮中研磨后,采用Trizol法提取组织中总RNA,逆转录获得cDNA,产物经琼脂糖凝胶电泳法鉴定后,进行qRT-PCR,按照试剂盒说明书操作设置反应体系,反应条件:94 ℃预变性7 min,95 ℃变性20 s,58 ℃退火40 s,72 ℃延伸50 s,重复40个循环。以U6为管家基因,2-△△ct为目的基因的相对表达强度,所有实验重复3次取Ct平均值。引物序列见表1。

表1 引物序列
1.2.5 血压检测 末次注射后6 h测量大鼠血压,大鼠放置于鼠袋中,尾巴套入传感器,信号稳定后测量尾动脉收缩压(systolic blood pressure,SBP),连续测量3次取平均值。
1.2.6 血管内皮功能指标ET-1、NO、TXB2、PGI2水平检测 检测血压后,禁食不禁水12 h,眶静脉取血2 mL,4 ℃静置2 h,3 500 r/min离心10 min,离心半径10 cm,取上层血浆,以酶联免疫吸附实验(ELISA)检测ET-1、TXB2、PGI2含量,以化学一步法检测NO含量,严格按照试剂盒说明书操作。
1.2.7 苏木素-伊红(HE)染色观察主动脉病理变化 眶静脉取血后迅速开胸,分离胸主动脉,PBS冲洗,以4%多聚甲醛固定,石蜡包埋,制成4 μm厚度切片,HE染色,光镜下观察病理变化。
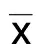
2 结 果
2.1 BMSCs形态观察及鉴定 倒置显微镜下观察,原代BMSCs培养1 d开始贴壁,形态以圆形或梭形多见;培养5 d,可见贴壁细胞形态较为一致,各集落细胞呈旋涡状排列,逐渐融合成片;P3细胞形态为梭形或多角形,形态均一,增殖较快,成旋涡状分布。详见图1。流式细胞术鉴定P3 BMSCs表面标志物结果显示CD63、CD81表达阳性,表达率分别为99.9%、58.6%,CD34、CD45表达阴性,表达率分别为0.3%、1.2%,符合BMSCs表面抗原表达。详见图2。

图1 BMSCs形态观察(×40)
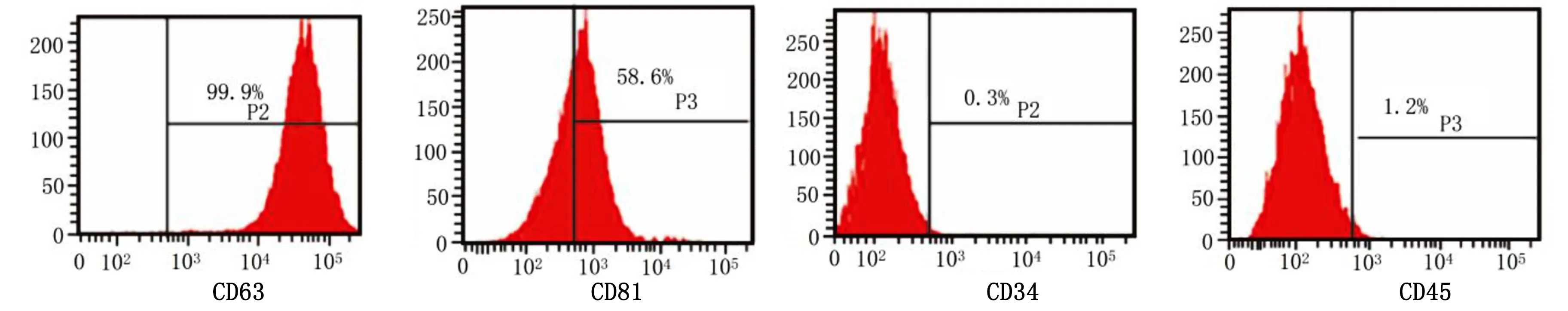
图2 流式细胞术鉴定P3 BMSCs表面标志物
2.2 BMSCs-exo形态观察鉴定 透射电镜观察,BMSCs-exo为类圆形、脂质膜结构的囊泡状小泡,腔内可见低密度亮光区,详见图3。蛋白印迹法(Western Blot)检测外泌体膜CD81、CD63蛋白阳性,详见图4。
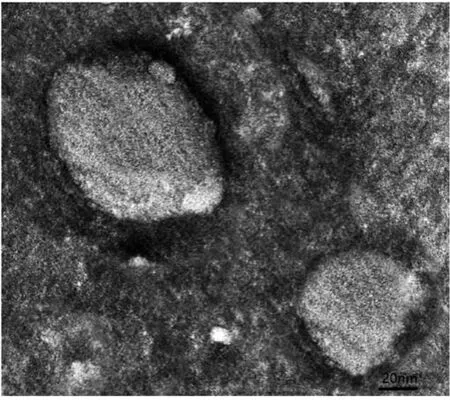
图3 透射电镜观察BMSCs-exo形态(×50 000)
图4 Western Blot检测BMSCs-exo膜蛋白表达
2.3 各组miR-132-3p相对表达量比较 各组miR-132-3p相对表达量比较差异有统计学意义(P<0.05);与健康组比较,对照组、BMSCs-exo组、miR-132-3p空载组miR-132-3p相对表达量降低,miR-132-3p高表达组相对表达量升高,差异均有统计学意义(P<0.05);与对照组比较,BMSCs-exo组、miR-132-3p高表达组miR-132-3p相对表达量升高,差异均有统计学意义(P<0.05);与BMSCs-exo组比较,miR-132-3p高表达组miR-132-3p相对表达量升高,miR-132-3p空载组相对表达量降低,差异均有统计学意义(P<0.05);对照组miR-132-3p相对表达量与miR-132-3p空载组比较,差异无统计学意义(P>0.05)。详见表2。

表2 各组miR-132-3p相对表达量比较(±s)
2.4 各组尾动脉收缩压比较 各组尾动脉收缩压比较差异有统计学意义(P<0.05);与健康组比较,对照组、BMSCs-exo组、miR-132-3p高表达组、miR-132-3p空载组尾动脉收缩压均升高,差异均有统计学意义(P<0.05);与对照组比较,BMSCs-exo组、miR-132-3p高表达组尾动脉收缩压降低,差异均有统计学意义(P<0.05);与BMSCs-exo组和miR-132-3p高表达组比较,miR-132-3p空载组尾动脉收缩压升高,差异均有统计学意义(P<0.05);BMSCs-exo组与miR-132-3p高表达组尾动脉收缩压比较差异无统计学意义(P>0.05);对照组与miR-132-3p空载组尾动脉收缩压比较差异无统计学意义(P>0.05)。详见表3。

表3 各组尾动脉收缩压比较(±s) 单位:mmHg
2.5 各组血浆ET-1、NO、TXB2、PGI2水平比较 各组血浆ET-1、NO、TXB2、PGI2比较差异均有统计学意义(P<0.05);与健康组比较,对照组、BMSCs-exo组、miR-132-3p高表达组、miR-132-3p空载组ET-1、TXB2水平升高,NO、PGI2水平降低,差异均有统计学意义(P<0.05);与对照组比较,BMSCs-exo组、miR-132-3p高表达组ET-1、TXB2水平降低,NO、PGI2水平升高,差异均有统计学意义(P<0.05);与BMSCs-exo组和miR-132-3p高表达组比较,miR-132-3p空载组血浆ET-1、TXB2水平升高,NO、PGI2水平降低,差异均有统计学意义(P<0.05);BMSCs-exo组ET-1、NO、TXB2、PGI2与miR-132-3p高表达组比较差异均无统计学意义(P>0.05);对照组与miR-132-3p空载组ET-1、NO、TXB2、PGI2比较差异均无统计学意义(P>0.05)。详见表4。

表4 各组血浆ET-1、NO、TXB2、PGI2水平比较(±s)
2.6 各组主动脉病理变化观察 健康组主动脉血管壁结构正常,无明显的内膜增生,细胞结构排列整齐;对照组大鼠胸主动脉血管壁增厚明显,血管壁面积增大,管腔狭窄,动脉壁中层平滑肌细胞肥大,细胞结构排列紊乱;BMSCs-exo组、miR-132-3p高表达组有血管内膜增厚及管腔缩小表现,细胞结构排列不齐,病理变化较对照组轻,但BMSCs-exo组、miR-132-3p高表达组病理变化相当;miR-132-3p空载组主动脉血管壁结构病理变化与对照组相当。详见图5、图6。
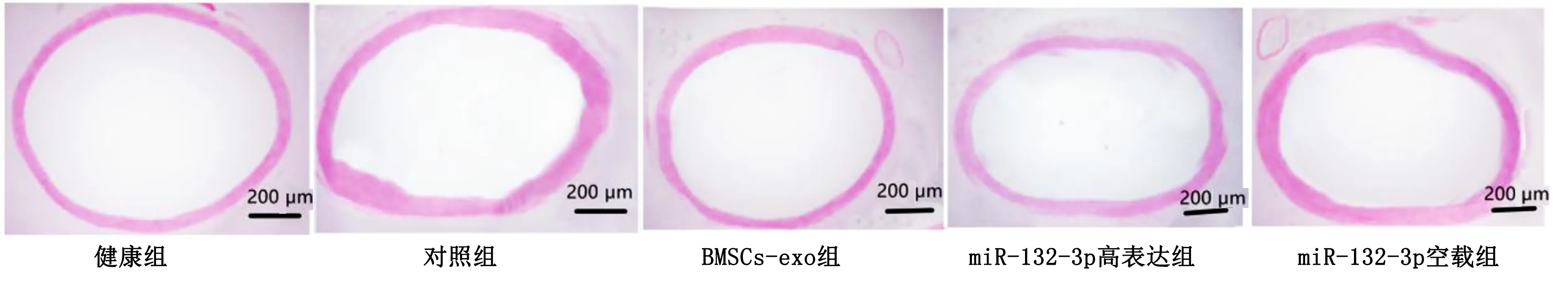
图5 各组大鼠主动脉血管腔HE染色图(×40)

图6 各组大鼠主动脉血管壁HE染色图(×400)
3 讨 论
原发性高血压是由遗传和环境因素综合作用的临床综合征,为临床常见的慢性病之一[8]。长期动脉血压升高可增加靶器官的压力负荷,并触发血管重塑与血管内皮功能异常,直接影响心、脑、肾等器官的灌注,并造成交感神经、肾素-血管紧张素系统的过度激活、代谢异常及炎症会加重对靶器官的损害[9]。近年来细胞旁分泌效应成为研究热点,外泌体是旁分泌效应中发挥作用的关键物质。研究发现,BMSCs-exo参与调控血管内皮细胞的增殖,其携带和传递的内容物可影响血管内皮细胞功能[10]。因BMSCs旁分泌效应强,且有体外易分离培养、增殖速率快、扩增能力强的优势,是提取外泌体的理想细胞。通过探索BMSCs-exo对高血压大鼠血管内皮的影响及机制,可为高血压病的分子机制和治疗研究提供新的思路。
外泌体是细胞间通信通路的重要媒介,含有来源细胞形式功能的关键分子。BMSCs具有多向分化功能,能够分化为血管内皮细胞,应用于心血管疾病、糖尿病肾病等疾病的治疗[11]。李红岩等[12]研究发现,BMSCs移植可降低野百合碱诱导的肺动脉高压大鼠的肺动脉压。Varela 等[13]研究发现,间充质干细胞可诱导新生血管的形成,降低肾血管性高血压大鼠的血压水平,改善肾功能,为BMSCs-exo治疗高血压奠定了基础。内皮细胞损伤导致的功能障碍与高血压的发生密切相关。ET-1、NO、TXB2、PGI2是由血管内皮细胞产生的血管活性物质,可反映血管内皮功能[14]。NO与PGI2是血管张力的主要调节因子,各种病理因素导致的内皮依赖性血管舒缩功能障碍,可使NO与PGI2合成释放性下降,血压升高[15];ET-1与TXB2具有收缩血管作用,其水平的升高是导致血压升高的重要原因[16-17]。本研究中显微镜下可观察BMSCs培养过程中的形态变化,流式细胞术鉴定P3 BMSCs表面标志物表达符合特征;透射电镜下可见BMSCs-exo为类圆形、脂质膜结构的囊状小泡,Western Blot检测表达相关标志蛋白,提示BMSCs-exo提取成功;BMSCs-exo组尾动脉收缩压及血浆ET-1、TXB2水平均低于对照组,血浆NO、PGI2水平均高于对照组,主动脉病理变化观察显示BMSCs-exo组存在血管内膜增厚及管腔缩小表现、细胞结构排列不齐等病理改变,且病理变化较对照组轻,说明BMSCs-exo可降低高血压大鼠血压,改善血管内皮功能,减轻血管病理改变。
本研究结果还显示BMSCs-exo组、miR-132-3p高表达组的miR-132-3p相对表达量均高于对照组;miR-132-3p高表达组的尾动脉收缩压及血浆ET-1、TXB2水平均低于对照组,血浆NO、PGI2水平均高于对照组;BMSCs-exo组尾动脉收缩压及血浆NO、PGI2、ET-1、TXB2水平与miR-132-3p高表达组比较差异均无统计学意义(P>0.05),说明BMSCs-exo组可能通过调节miR-132-3p的表达,降低高血压大鼠的尾动脉压,改善血管内皮功能,减轻病理变化。miR-132是具有组织特异性的多功能miRNA,具有内皮细胞特异性。miR-132-3p是miR-132家族成员,在内皮靶向p120RasGAP,诱导新血管形成,改善血管内皮功能[18]。Wang 等[19]研究发现老年SHR存在miRNA谱失调,包括miR-132-3p。杜东辉等[20]研究发现,高表达的miR-132-3p间充质干细胞外泌体可修复缺氧受损脑微血管内皮细胞功能。以上分析与研究证实,BMSCs-exo可能通过上调miR-132-3p的表达,降低高血压大鼠血压,改善血管内皮功能,缓解动脉血管病理变化。
综上所述,BMSCs-exo具有调节高血压大鼠血压、改善血管内皮功能、减轻动脉血管病变的作用,其机制可能与升高miR-132-3p的表达有关。在今后高血压疾病的治疗中,可考虑将BMSCs-exo作为研究方向。
