p53基因治疗联合TACE和射频消融在兔VX2肝癌模型中的疗效研究
2021-11-29尚华刘博赵晓东胡宁戚诚
尚华 刘博 赵晓东 胡宁 戚诚
肝癌是我国最常见的恶性肿瘤之一,根据国家癌症中心发布的数据,2014年我国肝癌新发病例 36.5万例,肝癌新死亡病例约 31.9万例[1]。肝切除术是早期肝癌的首选治疗方法,但肝癌早期诊断困难,患者就诊时多属中晚期,失去手术机会。对于不可切除的肝癌,治疗方法有局部消融治疗、经导管动脉化疗栓塞术(transarterial chemoembolization,TACE)、放射治疗和全身治疗[2]。虽然肝癌的治疗手段多样,但疗效有限,5年相对生存率仅12.1%[3]。作为抑癌基因,p53与肿瘤的发生发展密切相关,p53基因治疗制品也已在临床使用多年。本研究联合不同作用机制的治疗方式,探讨TACE联合p53基因治疗和射频消融用于肝癌治疗的可行性。
1 材料与方法
1.1 实验动物 新西兰大白兔26只,体重2.5~3.0 kg,雌雄不限,由河北医科大学动物中心提供[实验动物合格证号:SYXK(冀)2018-008]。
1.2 材料与仪器 超液态碘油(法国Guerbet公司),Ad-p53(深圳赛百诺基因技术有限公司),p53抗体(北京中杉金桥生物技术有限公司),射频治疗仪[安隽医疗科技(南京)有限公司],CT机(西门子股份有限公司),生物光学显微镜(日本电子株式会社)。
1.3 模型建立和动物分组 VX2肿瘤株复苏后800 r/min离心5 min,去除上清液后加入 PBS 液继续离心5 min,去除上清液后再次加入PBS液,玻璃棒搅匀,取悬液进行台盼蓝染色计数,将细胞液浓度调至109个/L。随机选取2只大白兔作为肿瘤传代兔,取VX2瘤细胞悬液0.5 ml接种于兔后腿外侧肌肉内,2周后待瘤体细胞发育完成,取出瘤体,剔除肌肉组织和坏死组织,将瘤体组织剪成约 1 mm3大小的碎块浸泡于0.9%氯化钠溶液中备用。24只拟荷瘤兔全麻后无菌条件下逐层开腹,眼科剪刺破肝左叶较厚处,剪开约5 mm深度的“烧瓶样”窦道,直接植入2~3块瘤体组织,明胶海绵填埋瘘口,逐层关腹。术后3 d肌内注射青霉素105 U·kg-1·d-1预防感染。术后14 d行CT检查,观察肿瘤生长情况,计算肿瘤体积。24只成功建模的实验兔随机分为A、B、C组进行后续治疗。(1)A组(8只):第1天瘤内注射rAd-p53(5×106/VP),经肝动脉灌注超液态碘油(0.5 ml/只),第2天射频消融(治疗时间5 min,功率135 W);(2)B组(8只):第1天经肝动脉灌注rAd-p53(5×106/VP)和超液态碘油(0.5 ml/只),第2天射频消融(治疗时间5 min,功率135 W);(3)C组(8只):经肝动脉灌注超液态碘油(0.5 ml/只),第2天射频消融(治疗时间5 min,功率135 W)。
1.4 检测指标 治疗后第3天检测p53蛋白表达量。治疗后1、2、3、4周行CT检查,观察肿瘤生长情况,计算肿瘤体积。最后处死实验兔,观察肿瘤大小及坏死情况并对标本行HE染色。治疗前、治疗后1 d、3 d、1周和2周,兔耳缘静脉采血2~3 ml行肝功能检查,比较治疗前后各时间点血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)两项指标变化情况。
1.5 Western blot检测p53水平 治疗后第3天,细针针吸法取肝癌中心组织,粉碎,用含蛋白酶抑制剂的RIPA-buffer提取总蛋白,SDS-PAGE电泳,转膜,封闭,一抗4℃孵育过夜,二抗室温孵育1 h,显色,定影,显影。以β-actin为内参蛋白,以目标蛋白吸光度与内参蛋白的比值表示目标蛋白相对表达量。
1.6 免疫组化染色 切片常规脱蜡水化,乙醇浸泡,苏木精染色,盐酸乙醇分色,自来水洗,伊红染色,蒸馏水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片后光镜下观察。

2 结果
2.1 组织病理学 术后组织形态观察,肝癌组织标本坏死灶为类椭圆形,呈灰白色,边界清晰,与周围组织间有纤维包膜,瘤体中央可见凝固性坏死,部分液化。其中C组组织标本的毁损中心区较A组和B组略小,边缘均有肿瘤残存。HE染色显示大片凝固性坏死,凝固性坏死区周围有包膜形成。见图1。

图1 凝固性坏死区(HE×200)
2.2 3组肿瘤体积比较 经治疗后,A组和B组肿瘤体积呈持续缩小趋势,C组肿瘤体积在治疗后的前2周先缩小,治疗后3周逐渐恢复增长。治疗后1周3组肿瘤体积差异无统计学意义,治疗后2、3、4周A组和B组肿瘤体积均较C组小,差异有统计学意义(P<0.05)。见表1。
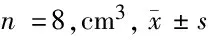
表1 3组不同时间肿瘤体积比较
2.3 3组治疗ALT水平比较 治疗前3组瘤兔肝功能差异无统计学意义(P>0.05),治疗后1 d 3组ALT水平均达到峰值,较治疗前显著升高,组间差异无统计学意义(P>0.05);治疗后3 d、治疗后1周及治疗后2周3组的ALT在治疗后1 d的基础上持续下降,其中A组和B组的下降趋势更显著,治疗后3 d和治疗后1周时,A组和B组的ALT水平较C组更低,治疗后2周时A组和B组ALT基本恢复至术前水平,且低于同期C组水平,差异均有统计学意义(P<0.05)。见表2。

表2 3组治疗前后ALT变化
2.4 3组治疗前后AST水平比较 治疗前3组的AST比较,差异无统计学意义(P>0.05);3组在治疗后1 d、3 d及1周后,AST水平均较治疗前高(P<0.05),治疗后2周,A组和B组基本恢复至术前水平,但C组仍显著高于治疗前,明显高于A、B组(P<0.05)。见表3。

表3 3组治疗前后AST水平比较
2.5 3组p53蛋白表达比较 A组和B组p53表达明显低于C组,差异有统计学意义(P<0.05)。见图2,表4。
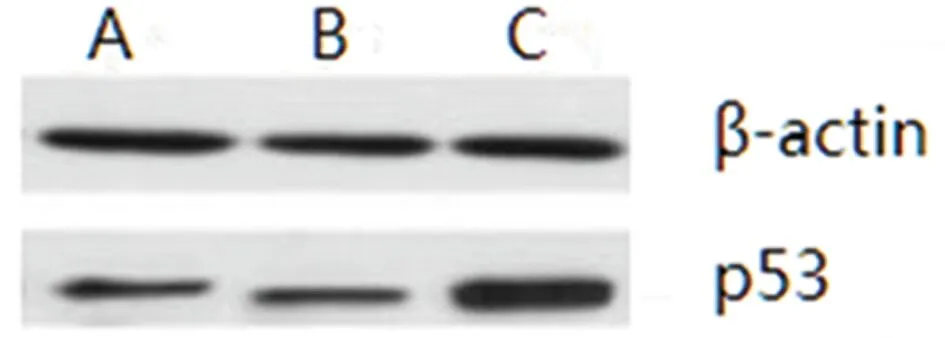
图2 p53蛋白表达

表4 3组p53蛋白表达比较
3 讨论
肝癌是我国第四位常见的恶性肿瘤,病死率仅次于肺癌,对人民生命健康造成严重威胁[1]。肝癌患者就诊时多为中晚期,失去手术机会,局部消融治疗、TACE、放疗和全身治疗是不适合外科手术的进展期肝癌的首选方法。TACE是公认的最常用的肝癌非手术治疗方法之一,尤其是TACE与局部消融治疗联合应用,协同效应明显,逐渐替代TACE单一治疗模式,但对中晚期肝癌患者生存率的改善仍有限[2]。近年来,基因治疗迅猛发展,陆续有多项基因治疗产品上市,与传统疗法相比,基因治疗更有针对性,有望成为当前恶性肿瘤生物治疗的主要手段[4]。
p53是一种肿瘤抑制基因,主要参与细胞周期调节,人类 p53基因所编码的蛋白有野生型(wtp53)和突变型(mtp53)两种形式, wtp53可诱导细胞凋亡。研究发现,50%的恶性肿瘤存在p53基因的突变[5]。mtp53能与wtp53形成复合物,使wtp53与DNA结合能力下降,与这些结合位点相关的基因转录调节受影响,最终引起癌细胞生长失控[6]。
p53应用于恶性肿瘤基因治疗是以野生型 p53基因导入肿瘤细胞,以替代突变型p53基因。本研究中使用的rAd-p53是以5型腺病毒为载体,与人野生型p53进行基因重组形成有活性的基因工程重组腺病毒颗粒,通过外源性导入野生型p53基因,诱导肿瘤细胞凋亡而发挥抗肿瘤作用,临床上被批准与放射治疗联合可试用于现有治疗方法无效的晚期鼻咽癌的治疗[7]。p53基因经肝动脉灌注化疗治疗中晚期肝癌与未联合使用p53基因相比,总缓解率更高并有效缩小肿瘤直径[8]。
肝细胞癌90%以上的血供来自肝动脉,通过TACE可切断病灶主要血供,使肿瘤发生缺血、缺氧并坏死,结合射频消融术的辅助治疗下,局部组织温度升高也可使肿瘤细胞凝固性坏死[9]。本研究中,治疗前3组肿瘤体积比较,差异无统计学意义(P>0.05);经治疗后,不同治疗方式下肿瘤体积呈现不同的变化规律。治疗后的前2周3组肿瘤均出现缩小,在第2周开始肿瘤体积差异开始体现,治疗后第3周,C组(碘油灌注联合射频消融)肿瘤恢复增长,而rAd-p53给药下肿瘤体积持续缩小,治疗后第4周,C组肿瘤体积在2周基础上继续增加,而2个rAd-p53给药组治疗效果仍持续,肿瘤体积未出现增加。表明rAd-p53联合超液态碘油TACE和射频消融较未使用rAd-p53相比对VX2肝癌治疗效果更好。根据rAd-p53使用说明书,动物体内注射后1 h重组腺病毒颗粒即可进入肿瘤细胞;注射后3 h,p53基因开始表达;第3天达到高峰,3周后,细胞内重组腺病毒DNA被降解[10]。说明p53基因表达可持续3周,本研究中,rAd-p53给药组在治疗后4周仍保持对肿瘤体积的控制,体积变化规律与药代动力学特点具有一定一致性。水化碘油为含碘油剂,经肝动脉灌注后能长期滞留于肿瘤组织内,正常肝组织内则数天后就消失。水化碘油作为抗肿瘤药物的载体,可提高药物浓度、使药物缓慢释放,延长药物作用时间[11]。本研究中,2个rAd-p53给药组,在治疗后4周仍继续发挥抗肿瘤作用,可能是由于碘油栓塞局部靶血管的同时,延长了p53基因在肝动脉和瘤体局部的停留时间,持续保持基因有效浓度,从而发挥诱导肿瘤细胞凋亡、缩小肿瘤体积的作用。
ALT和AST是评价肝脏代谢功能的指标,本研究中,治疗后1 d,ALT和AST均显著升高,由于3组均采用了TACE,介入治疗通过对肿瘤组织主要供血动脉进行栓塞,肝动脉及其分支动脉暂时性缺血,进而造成肝细胞的肿胀、缺血、缺氧,射频消融的高温引起肝脏毛细血管和胆管通透性增加,与肝功能相关的各种酶从细胞内释放入血[12,13],血清ALT和AST水平出现明显的上升。而3组间ALT和AST水平差异无统计学意义(P>0.05),说明无论是灌注碘油还是rAd-p53,对肝脏造成的一过性损伤是类似的。治疗后3 d开始,ALT和AST水平下降,肝功能逐渐恢复,至治疗后2周,A组和B组基本恢复至术前水平,以上数据说明,随着时间的推移,肝脏在因介入栓塞治疗和射频消融损伤后,肝功能将逐渐恢复,且rAd-p53对肝功能的恢复可能有促进作用。wtp53半衰期仅1~2 h,正常细胞内水平低,而mtp53半衰期较长,达2~12 h,因此通常是检测mtp53水平[14]。本研究选择在p53基因表达高峰期比较表达差异,Western blot检测阳性表明了3组肝癌模型均存在不同程度的p53基因突变,A组和B组p53表达明显低于C组,说明给予rAd-p53后,突变型p53蛋白相对表达量下降。结合3组肿瘤体积变化规律,从分子学水平表明了p53蛋白表达与抗肿瘤疗效有相关性。
瘤内注射是rAd-p53的常规给药方式,而已有的关于p53基因治疗与TACE联用则多采用动脉介入灌注的方式[15],本研究中rAd-p53瘤内注射和动脉灌注两种不同给药方式下的对肿瘤大小的影响并不明显,p53蛋白表达差异也不显著,说明p53基因两种给药方式对疗效影响不大,但与碘油联用时p53基因动脉灌注给药便利性更高,且考虑介入途径下给药免疫反应可能较瘤内直接注射低,所以肝动脉灌注p53基因更具优势。
综上所述,p53基因联合TACE和射频消融在兔VX2肝癌模型中疗效肯定。本课题组也考虑从分子学水平考察p53基因治疗影响肿瘤生长的机制,以及安全性等指标,从而为用于p53基因联合TACE和射频消融用于肝癌治疗提供充足依据。
