SM22α在上皮性卵巢癌组织中的表达及意义
2021-11-29宋玉霞赵芳赵涛周莎莎王雪娟郭桦
宋玉霞 赵芳 赵涛 周莎莎 王雪娟 郭桦
卵巢癌(Ovarian cancer)是女性生殖道常见的恶性肿瘤之一,发病率占女性生殖系统肿瘤第三位,病死率居于首位[1]。据中国癌症统计数据显示,2015年我国新发病例5.21万例,因卵巢癌死亡病例2.25万例[2]。卵巢癌患者早期没有典型的临床症状及特异性的标记物,约70%的患者明确诊断时已为晚期;近年来以手术为主的综合治疗的技术有很大提高,然而其5年生存率仍徘徊在30%左右[3]。目前对卵巢癌的发生发展,以及卵巢癌细胞如何扩散到远处器官的分子机制并不明确,探讨其机制的研究对卵巢癌的预防、早期诊断、综合治疗及预后都具有非常重要的现实意义。平滑肌22α蛋白(smooth muscle 22 alpha,SM22α)又称为Transgelin,是一种actin细胞骨架相关蛋白,通过与细胞骨架的肌动蛋白结合调节细胞的收缩功能[4]。SM22α作为信号分子参与细胞的分化、生长及细胞外基质重塑等[5,6]。研究表明,M22α可能在肿瘤的发生发展过程中起作用,其在多种癌组织中,如肺癌[7]、乳腺癌[8]、大肠癌[9]等,表达下调或降低。此外,SM22α还可通过抑制基质金属蛋白酶9(MMP-9)的表达抑制肿瘤细胞的侵袭和转移能力[10]。本研究应用qRT-PCR和Western blot方法检测卵巢癌组织中SM22α的表达情况,探讨其在卵巢癌发生和发展中的作用。
1 资料与方法
1.1 一般资料 收集2015年12月至2018年12月石家庄市第一医院妇科手术治疗的上皮性卵巢癌患者卵巢癌组织标本43例。患者年龄28~72岁,平均年龄53.4岁,所有患者均为初治行肿瘤细胞减灭术,术前均未行新辅助化疗,标本术后经病理确诊。组织学类型:浆液性腺癌31例、黏液性囊腺癌4例、子宫内膜样癌8例;FIGO 手术病理分期:Ⅰ期7例、Ⅱ期3例、Ⅲ期29例、Ⅳ期4例;组织分级:1~2级23例、3级20例。对照组标本选取同期因宫颈癌或子宫肌瘤行全子宫双附件切除患者的卵巢组织50例,对照组患者术中证实无卵巢子宫内膜异位囊肿或卵巢肿瘤等,术后病理诊断为正常卵巢。标本均在离体后30 min内收集,迅速放入-80℃冰箱里低温保存备用。标本和资料收集均由患者本人知情同意,并获得石家庄市第一医院伦理委员会批准通过。
1.2 主要试剂与仪器 TRIzol试剂盒(北京天根生化科技有限公司);PCR 引物(上海生工生物工程有限公司);RevertAid cDNA 合成试剂盒(TaKaRa生物技术有限公司);QuantinovaTMSYBR® green pcr Kit(上海凯杰生物技术有限公司);荧光定量PCR仪(7500 型)为美国ABI公司产品;兔抗人SM22α单克隆抗体(Ab-cam公司);兔抗人单克隆抗体GAPDH(Santa Cruz生物有限公司);荧光标记的羊抗兔多克隆抗体(Santa Cruz生物有限公司);双色红外荧光扫描系统(美国LI-COR公司)。
1.3 检测方法
1.3.1 总RNA提取及qRT-qPCR 应用:TRIzol RNA提取试剂盒按照说明书操作提取组织总RNA,Nanodrop2000检测总RNA的浓度及纯度,要求OD260/OD280值位于1.8~2.0。应用逆转录试剂盒按照说明书操作将5 μg总RNA逆转录合成cDNA,将转录好的cDNA于-20℃冰箱保存,用于后续qPCR扩增。应用QuantiNovaTMSYBR® Green PCR 试剂盒进行qPCR扩增反应,PCR反应体系:Green Master Mix 1.0 μl、上游引物 1.4 μl、下游引物 1.4 μl、Rox 0.1 μl、模板cDNA 1.0 μl、最后加双蒸水至20 μl。qPCR反应条件设定:95℃预变性3 min;然后进行40个循环(95℃变性15 s、58℃退火30 s、72℃延伸25 s);最后进行95℃变性15 s、58℃退火60 s、95℃延伸30 s。反应引物序列:目的基因SM22α的上游引物 5’-AGGTGTGGCTGAAGAATGGCG-3’、下游引物 5’-TCTTCGTCTACATAATCCTC-3’;内参GAPDH的上游引物 5’-ACCACAGTCCATGCCATCAC-3’,下游引物 5’-TCCACCACCCTGTTGCTGTA-3’。根据系统生成的Ct值,采用2-ΔΔCT法计算获得SM22α基因mRNA的相对表达量,每个标本均设3个副孔,取平均值。
1.3.2 Western blot检测SM22α蛋白表达情况:解冻卵巢癌组织及正常卵巢组织标本后,取约200 mg用眼科剪将组织块剪碎后加入蛋白裂解液,组织充分裂解后,4℃离心机上离心提取总蛋白,用定量BCA法进行蛋白定量。制备10% SDS-PAGE分离胶和5% SDS-PAGE浓缩胶,每加样孔上样50 μg样本蛋白,电泳90 min后将分离的蛋白转至PVDF膜上,用含5%脱脂奶粉的TBST液封闭2 h,TBST洗膜后加稀释好的一抗(兔抗人SM22α单克隆抗体1∶1 000;兔抗人单克隆抗体GAPDH 1∶800)、4℃条件下过夜。TBST洗膜3次后加二抗(荧光标记的羊抗兔多克隆抗体1∶10 000)室温避光孵育1 h,TBST再次洗膜4次后抗体结合区带用Odyssey双色红外荧光扫描系统进行成像。

2 结果
2.1 SM22α在卵巢癌组织及正常卵巢组织中的表达情况 利用qRT-PCR检测43例卵巢癌组织及50例正常卵巢组织中SM22α mRNA表达水平,结果显示:卵巢癌组织中SM22α mRNA相对表达水平为(0.72±0.18),正常卵巢组织中其相对表达水平为(1.45±0.63),2组比较差异有统计学意义(P<0.05)。Western blot结果同样显示:与正常卵巢组织相比,SM22α在卵巢癌组织中的蛋白表达水平显著降低,差异有统计学意义(P<0.05)。见图1。
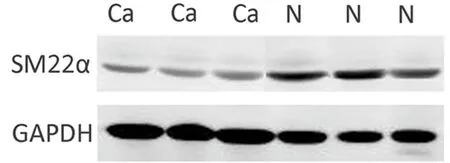
图1 SM22α蛋白表达情况;N:正常卵巢组织,Ca:卵巢癌组织
2.2 SM22α在卵巢癌组织中mRNA表达与蛋白表达的相关性分析 采用Pearson Correlation Coefficients检验,分析结果显示:卵巢癌组织中SM22α mRNA表达水平与其蛋白表达呈正相关性(r=0.701,P<0.05),表明卵巢癌组织中SM22α mRNA和其蛋白表达趋势一致。见图2。

图2 卵巢癌组织中SM22α基因的mRNA与蛋白表达的相关性
2.3 SM22α基因mRNA表达水平与卵巢癌患者临床病理特征的关系 应用t检验将SM22α 基因mRNA表达水平与EOC患者各临床病理参数之间的关系进行统计分析,结果显示淋巴转移阳性患者的癌组织中SM22α基因mRNA的表达水平显著低于淋巴转移阴性患者的癌组织(P<0.05),而其mRNA表达水平与患者年龄、临床分期、组织学分级、肿瘤病理学类型、手术残余病灶等不相关(P>0.05)。见表1。

表1 SM22α基因mRNA的表达水平与卵巢癌患者临床病理特征的关系
2.4 SM22α蛋白表达水平与卵巢癌患者临床病理特征的关系 应用t检验将SM22α蛋白表达水平与EOC患者各临床病理参数之间的关系进行统计分析,结果显示淋巴转移阳性患者的癌组织中SM22α蛋白表达水平显著低于淋巴转移阴性患者的癌组织(P<0.05),而其表达水平与患者年龄、临床分期、组织学分级、肿瘤病理学类型、手术残余病灶等不相关(P>0.05)。见表2。

表2 SM22α蛋白表达水平与卵巢癌患者临床病理特征的关系
3 讨论
本研究发现卵巢癌组织中SM22α mRNA及其蛋白表达水平显著低于正常卵巢组织,且卵巢癌组织中SM22α mRNA及其蛋白表达水平表达与卵巢癌患者的淋巴结转移有相关性。
SM22α通过与细胞骨架蛋白-肌动蛋白结合,参与细胞骨架的重构,在细胞结构稳定和表型分化维持方面起重要作用。近年来研究发现SM22α在肺癌[7]、乳腺癌[8]、大肠癌[9]、前列腺癌[11]等多种恶性肿瘤中异常表达。Thompson等[12]报道了SM22α的表达缺失可导致恶性肿瘤发生;Zhang等[13]研究表明SM22α表达升高可诱导前列腺癌细胞凋亡;Xie等[14]报道了SM22α在结直肠癌组织中表达下调,且其可通过促进细胞的自噬作用来抑制结肠癌细胞的增殖。这些研究表明了SM22α可能是一种抑癌基因。但是,也有研究报道称SM22α在胰腺癌[15]、食管癌[16]及胃癌[17]等癌组织中表达上调。因此,需要更加系统、深入的研究来明确SM22α在不同类型肿瘤发生、发展过程中的功能及作用机制。
本研究应用qRT-PCR及Western blot检测了卵巢癌组织中SM22α mRNA及蛋白的表达情况,结果显示SM22α在卵巢癌组织中的表达水平显著低于正常卵巢组织,且临床病理参数分析显示卵巢癌组织中SM22α mRNA及其蛋白表达水平表达与卵巢癌患者的淋巴结转移有相关性,然而SM22α在卵巢癌组织中的表达水平与患者的年龄、分期、分化及残余病灶等无关,表明SM22α基因的低表达可能增加卵巢癌细胞的侵袭能力。本研究结果与先前的研究结果相似,Lawson等[10]研究表明SM22α表达降低可促进基质金属蛋白酶9(MMP-9)的表达,从而增加肿瘤细胞的侵袭和转移能力。侵袭和转移是恶性肿瘤的主要特征,在肿瘤的发生发展过程中起重要作用。因此,我们推测SM22α表达下调可能增加了卵巢癌细胞的侵袭能力,从而参与卵巢癌发生发展。但其具体分子机制尚需进一步深入研究和明确。
综上所述,本研究结果提示卵巢癌组织中SM22α基因mRNA及蛋白表达低于正常卵巢组织,且其表达水平与卵巢癌患者的淋巴结转移相关,表明SM22α在卵巢癌发生发展过程中可能发挥重要作用,有可能成为卵巢癌分子诊断和治疗的重要靶点。
