circMAN2B2对宫颈癌细胞顺铂敏感性的影响
2021-11-29蒙秋谢兴润张静王海燕黄守国
蒙秋 谢兴润 张静 王海燕 黄守国
化疗是中晚期宫颈癌患者重要的治疗手段,虽然初期患者对化疗反应良好,但随着宫颈癌细胞对化疗药物的抵抗和耐受的产生,化疗耐药会导致宫颈癌化疗失败[1]。顺铂是宫颈癌的基础化疗药,对顺铂的化疗耐药是临床治疗中的一个障碍[2]。因此,研究与顺铂类化疗抵抗相关的分子机制以提高化疗效果具有重要意义。研究表明,circRNA对妇科恶性肿瘤的发生发展具有重要的调控作用,在耐药性中起着至关重要的作用,可为抗肿瘤药物耐药性的研究提供新的靶点,针对其靶向治疗有望成为治疗宫颈癌的新策略[3,4]。研究报道,敲除circMAN2B2可通过调节miR-1205/S100A8轴抑制神经胶质瘤细胞增殖,侵袭,迁移并减小肿瘤大小[5]。circMAN2B2敲低通过miR-1275/FOXK1轴可显著抑制H1299和A549肺癌细胞的增殖和侵袭[6]。而circMAN2B2对宫颈癌细胞及顺铂的敏感性的影响尚不清楚。而circRNA可通过调控miRNA影响肿瘤进展,研究显示,miR-216a-3p在宫颈癌中低表达,高表达可抑制宫颈癌的增殖,集落形成和侵袭[7]。柠檬苦素降低miR-216a甲基化水平,从而增加miR-216a-3p表达并随后抑制Wnt/β-catenin途径来减弱乳腺癌细胞对阿霉素的耐药性[8],表明miR-216a-3p参与调控宫颈癌细胞的进展,且与癌细胞的药物耐药性有关。因此,本实验旨在研究circMAN2B2对宫颈癌细胞及顺铂的敏感性的影响是否与miR-216a-3p有关。
1 材料与方法
1.1 材料 宫颈癌HeLa细胞(货号:HZX600,上海沪峥生物科技有限公司);RPMI-1640完全培养基(货号:M0201A,上海盈湾生物科技有限公司);顺铂(货号:13119-100,艾美捷科技有限公司);MTT试剂盒(货号:M1020,上海恒斐生物科技有限公司);Trizol试剂(货号:5301100,杭州新景生物试剂开发有限公司);反转录试剂盒(货号:R1012,广州东盛生物科技有限公司);SYBR Premix ExTaqTM试剂盒(货号:RR420A,武汉科昊佳生物科技有限公司);双荧光素酶报告基因检测试剂盒(货号:KA3784,上海群己生物科技有限公司);Annexin V-FITC/PI凋亡检测试剂盒(货号:AD10-2,上海经科化学科技有限公司);RIPA蛋白裂解液(货号:RIPA20110527,上海研谨生物科技有限公司);二辛可宁酸(bicinchoninic acid,BCA)试剂盒(货号:701780-480,美国Cayman公司)。
1.2 细胞培养及宫颈癌顺铂耐药细胞的建立 宫颈癌HeLa细胞用RPMI-1640完全培养基在37℃条件下培养,取对数生长期HeLa细胞,将其分别暴露于不同浓度顺铂梯度的培养基中培养,直至在1 μmol/L顺铂浓度的培养基中正常生长,所得细胞即顺铂耐药宫颈癌细胞HeLa/DDP。
1.3 细胞分组 取对数生长期细胞HeLa/DDP,将si-NC、si-circMAN2B2转染至HeLa/DDP细胞中,再用2 μmol/L顺铂处理,记为DDP+si-NC组、DDP+si-circMAN2B2组;将si-circMAN2B2分别与anti-miR-NC、anti-miR-216a-3p转染至HeLa/DDP细胞中,再用2 μmol/L顺铂处理,记为DDP+si-circMAN2B2+anti-miR-NC组、DDP+si-circMAN2B2+anti-miR-216a-3p组。
1.4 MTT检测细胞增殖抑制率 将HeLa、HeLa/DDP细胞分别用浓度为1、2、4、8、16、32 μmol/L的顺铂处理,培养48 h后按MTT试剂盒说明操作,用酶标仪检测490 nm处吸光度(OD)值,细胞增殖抑制率=(1-OD实验组/OD对照组)×100%。绘制抑制率曲线,计算半数抑制浓度(IC50)。其他各组细胞按上述方法检测细胞增殖抑制率。
1.5 实时荧光定量PCR(RT-qPCR)检测circMAN2B2和miR-216a-3p的表达水平 提取总RNA,反转录成cDNA,按照试剂盒说明进行PCR,相对表达量用2-△△Ct法计算。circMAN2B2和miR-216a-3p分别以GAPDH和U6为内参,circMAN2B2上游引物序列:5’-CCCAACATGAGTGAGCCTGT-3’,下游引物序列:5’-GCACCGAGGCATTGAAGAAC-3’;GAPDH上游引物序列:5’-GTCAACGGATTTGGTCTGTATT-3’,下游引物序列:5’-AGTCTTCTGGGTGGCAGTGAT-3’;miR-216a-3p上游引物序列:5’-CACAGTGGTCTCTGGGATTATG-3’,下游引物序列:5’-CAGTGCGTGTCGTGGAGT-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’;引物由上海生工生物工程公司合成。
1.6 双荧光素酶报告实验检测circMAN2B2和miR-216a-3p的靶向调控 构建circMAN2B2野生型表达载体WT-circMAN2B2和突变型表达载体MUT-circMAN2B2,将其分别与miR-NC和miR-216a-3p共转染至HeLa细胞中;按照说明书检测荧光素酶活性。将pcDNA、pcDNA-circMAN2B2、si-NC、si-circMAN2B2转染至HeLa细胞中,按1.5中方法检测miR-216a-3p表达水平。
1.7 流式细胞术检测细胞凋亡 收集1.3中各组细胞,按试剂盒操作进行,用流式细胞仪检测细胞凋亡率。
1.8 蛋白质印迹(Western blot)法检测蛋白表达 提取1.3中各组细胞总蛋白,用BCA试剂盒定量。蛋白经SDS-PAGE,转膜,脱脂牛奶封闭,然后用一抗和二抗孵育,暗室曝光显影,定影,用Quantity One分析蛋白条带灰度值,以GAPDH为内参计算蛋白表达水平。

2 结果
2.1 顺铂对宫颈癌HeLa细胞和宫颈癌顺铂耐药细胞HeLa/DDP增殖抑制率的影响 用不同浓度的顺铂作用HeLa和HeLa/DDP细胞,与HeLa细胞比较,HeLa/DDP细胞增殖抑制率显著降低,IC50值升高(P<0.05)。见表1。
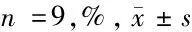
表1 顺铂对宫颈癌HeLa细胞和宫颈癌顺铂耐药细胞HeLa/DDP增殖抑制率的影响
2.2 circMAN2B2和miR-216a-3p在HeLa细胞和HeLa/DDP细胞中的表达 与HeLa细胞比较,HeLa/DDP细胞中circMAN2B2表达水平升高,miR-216a-3p表达水平降低(P<0.05)。见表2。

表2 circMAN2B2和miR-216a-3p在HeLa细胞和HeLa/DDP细胞中的表达
2.3 circMAN2B2靶向调控miR-216a-3p的表达 StarBase预测显示,circMAN2B2的序列中含有与miR-216a-3p互补的核苷酸序列。WT-circMAN2B2与miR-216a-3p共转染的细胞荧光素酶活性低于WT-circMAN2B2与miR-NC组共转染的细胞(P<0.05),而MUT-circMAN2B2与miR-216a-3p或miR-NC共转染的细胞荧光素酶活性比较差异无统计学意义(P>0.05)。过表达circMAN2B2,miR-216a-3p表达水平降低(P<0.05),抑制circMAN2B2表达后miR-216a-3p表达水平升高(P<0.05)。见图1,表3、4。

表3 双荧光素酶报告实验
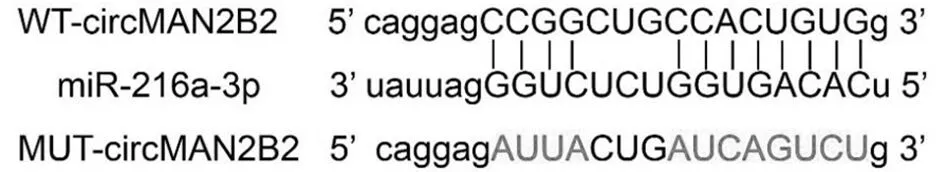
图1 circMAN2B2的序列中含有与miR-216a-3p互补的核苷酸序列
2.4 抑制circMAN2B2表达联合顺铂(2 μmol/L)对HeLa/DDP细胞增殖和凋亡的影响 与DDP+si-NC组比较,DDP+si-circMAN2B2组circMAN2B2表达水平降低,miR-216a-3p表达水平升高,细胞增殖抑制率升高,细胞凋亡率升高,Ki-67、Bcl-2表达水平降低,Bax表达水平升高,差异均有统计学意义(P<0.05)。见图2,表5。

表4 circMAN2B2调控miR-216a-3p的表达

图2 抑制circMAN2B2表达联合顺铂对HeLa/DDP细胞增殖和凋亡的影响;A 增殖、凋亡相关蛋白表达;B 细胞凋亡流式图

表5 抑制circMAN2B2表达联合顺铂对HeLa/DDP细胞增殖和凋亡的影响
2.5 干扰miR-216a-3p表达逆转了抑制circMAN2B2表达对HeLa/DDP顺铂敏感性的作用 与DDP+si-circMAN2B2+anti-miR-NC组比较,DDP+si-circMAN2B2+anti-miR-216a-3p组miR-216a-3p表达水平降低,细胞增殖抑制率降低,细胞凋亡率降低,Ki-67、Bcl-2表达水平升高,Bax表达水平降低,差异均有统计学意义(P<0.05)。见图3,表6。
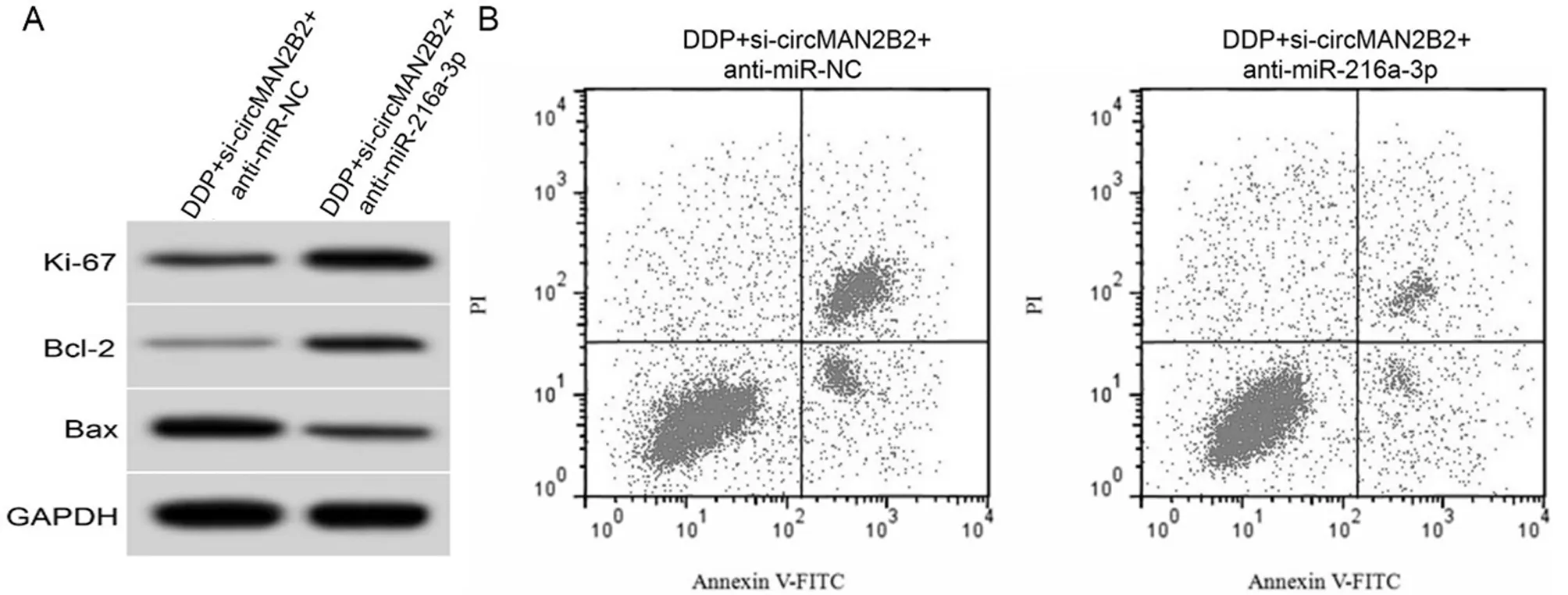
图3 干扰miR-216a-3p表达逆转了抑制circMAN2B2表达对HeLa/DDP顺铂敏感性的作用;A 增殖、凋亡相关蛋白表达;B 细胞凋亡流式图

表6 干扰miR-216a-3p表达逆转了抑制circMAN2B2表达对HeLa/DDP顺铂敏感性的作用
3 讨论
宫颈癌对放化疗不敏感是造成患者复发转移、预后差的重要原因,因此研究宫颈癌化疗敏感性的相关机制,对克服宫颈癌患者的化疗耐药以及延长患者生存期具有重要意义[9,10]。顺铂耐药是宫颈癌化疗的常用药物,本实验通过顺铂梯度暴露法构建顺铂耐药宫颈癌细胞株HeLa/DDP,且发现HeLa/DDP细胞增殖抑制率低于HeLa细胞,而半数抑制浓度高于HeLa细胞,表明HeLa/DDP细胞对顺铂耐药,构建成功。研究报道circRNA可影响肿瘤细胞的化疗耐药性[11]。circMAN2B2在胃癌组织中高表达;沉默circMAN2B2明显降低了SNU-16和AGS细胞的活力,存活率,迁移率,但增强了细胞凋亡,circMAN2B2可能通过调节miR-145以及PI3K/AKT和JNK途径发挥其功能[12]。敲除circMAN2B2可通过海绵化miR-217抑制肝癌细胞系Hep-G2和Huh-7的增殖[13]。本实验发现HeLa/DDP细胞中circMAN2B2表达水平高于HeLa细胞,提示circMAN2B2或与HeLa细胞的顺铂耐药有关。本实验进一步抑制circMAN2B2表达的同时用顺铂作用HeLa/DDP细胞,结果显示,细胞增殖抑制率升高,细胞凋亡率升高,Ki-67、Bcl-2表达水平降低,Bax表达水平升高;表明抑制circMAN2B2表达可抑制HeLa/DDP细胞增殖、促进细胞凋亡;抑制circMAN2B2表达增强了HeLa细胞对顺铂的敏感性。
已有研究报道,miR-216a-3p抑制宫颈癌的增殖和侵袭[7]。且研究报道miR-216a-3p在结直肠癌组织和细胞中下调表达,上调其表达可抑制结直肠癌细胞的增殖[14]。miR-216a-3p可抑制肺癌细胞的活力,迁移,侵袭和增殖,同时促进细胞凋亡[15]。本实验结果显示,miR-216a-3p在HeLa/DDP细胞中低表达,表明miR-216a-3p或与宫颈癌的顺铂敏感性有关。此外,本实验还发现circMAN2B2靶向调控miR-216a-3p;而干扰miR-216a-3p表达逆转了抑制circMAN2B2表达对HeLa/DDP顺铂敏感性的作用。
综上所述,抑制circMAN2B2表达可能通过上调miR-216a-3p增强宫颈癌细胞对顺铂的敏感性。
