新型5-氨基噻唑苯甲酰脲类化合物的合成及生物活性
2021-11-25熊传武张雪鹏罗喜爱刘奕奕刘建兵
熊传武,张雪鹏,罗喜爱,刘奕奕,刘建兵*
(1. 湖南医药学院药学院, 中国 怀化 418000;2. 湖南师范大学石化新材料与资源精细利用国家地方联合工程实验室,化学生物学及中药分析省部共建教育部重点实验室,有机功能分子组装与应用重点实验室,中国 长沙 410081;3. 国网湖南省电力有限公司电力科学研究院, 中国 长沙 410007)
苯甲酰基脲类杀虫剂能有效抑制昆虫的几丁质合成,致使昆虫不育或死亡。由于作用机制特殊,加之环境安全性高、低残留、易降解等优点,故该类化合物及衍生物经多年发展,研究热度依然不减[1,2]。此外,近几十年来,已上市的百来种医药、农药化合物均含氨基噻唑骨架[3],由此引来了药物开发人员对其生物生理活性研究的高度关注[4-7]。鉴于商品化的化合物以含2-氨基噻唑单元占绝大多数,截至目前为止,还没有5-氨基噻唑类农药和医药化合物上市,5-氨基噻唑与2-氨基噻唑又互为生物电子等排体,故合成5-氨基噻唑类衍生物,并研究其生物生理活性具有十分重要的意义。本课题组采用商品化的苯甲酰脲类杀虫剂的基本骨架为先导化合物,利用5-氨基噻唑与2-氨基噻唑互为生物电子等排体,结合活性亚结构拼接理论,苯甲酰基脲中芳胺基被5-氨基噻唑单元替换,设计并制备了两个系列的化合物I和II(图 1),并进一步研究噻唑环2位及芳甲酰基苯环上取代基对杀虫活性的影响。生物活性结果显示:部分化合物具有良好的杀虫活性[8,9]。
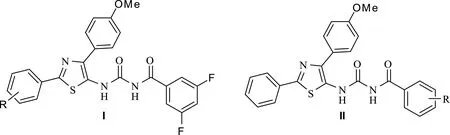
图1 前期合成的含5-氨基噻唑类苯甲酰脲类化合物
为了进一步研究该类化合物的构效关系,以期发现活性更高的该类化合物,笔者在前期工作的基础上,设计并合成了III和IV两个系列含5-氨基噻唑环核的苯甲酰脲类化合物共13个(图 2),研究噻唑环2号位和4号位都为苯基的化合物,芳甲酰基苯环上取代基变化对杀虫活性的影响(III系列);结合I,II和III三个系列化合物的结构特点,设计合成IV系列化合物,探讨4号位苯环含拉电子基氯原子,芳甲酰基苯环上取代基变化对杀虫活性的影响(IV系列)。通过1H NMR和13C NMR,IR,MS以及元素分析手段确认所有新化合物结构。离体的生物活性结果显示,大部分该类化合物具有优良的杀虫活性。
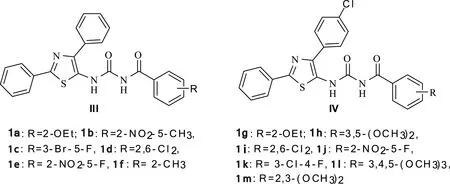
图2 设计合成的含5-氨基噻唑类苯甲酰脲类化合物
1 实验部分
1.1 仪器与试剂
Bruker DPX-500 型核磁共振仪(TMS作内标);GCMS-QP2010 PLUS型GC-MS联用仪;Bruker 22型FT-IR红外光谱仪(KBr压片);X-4型数字熔点仪。目标化合物1按参考文献[10]合成,中间体2-5分别按文献[11-15]合成,目标化合物1a~1m的活性由南开大学生测中心完成,其余为市售分析纯试剂。
1.2 中间体2,4-二苯基-5-氨基噻唑(5a)的合成
先后用分析天平称取2.01 g苯甲醛、3.15 g 2, 4-二甲氧基苄胺加入至50 mL烧瓶中,再用量筒量取8.0 mL甲醇作溶剂,在20~25 ℃氮气保护条件下反应1~1.5 h。随后加入2.33 g苯甲酸以及2.63 g叔辛基异腈,再补充8.0 mL甲醇作溶剂,继续搅拌10~12 h。待反应结束后,通过旋干蒸发除去甲醇得中间体6的粗品,不需处理直接进行后续反应。
用量筒量取10.0 mL二氯甲烷溶解上述所得的中间体6的粗品,再量取8.0~14.0 mL三氟乙酸混入其中,此时混合液呈血红色,20~25 ℃下反应1~1.5 h。待反应结束后,通过旋转蒸发除去反应液得粗品。粗品先用饱和碳酸氢钠溶液洗涤,除去过量的三氟乙酸,直至无气泡产生; 再用乙醚洗涤残留物直至红色褪去,最后进行减压抽滤,得滤渣。所得滤渣再依次用饱和碳酸氢钠溶液、水、乙醚洗涤,随后用氯仿连续萃取洗涤液3次,每次用量20 mL,最后经无水硫酸镁干燥2~3 h,通过旋转蒸发得白色固体7。以上两步收率为63%。
先后用分析天平称取2.10 g制备的中间体7及3.35 g劳森试剂加入至100 mL烧瓶中,再用量筒量取50.0 mL无水甲苯作溶剂,115~120 ℃氮气保护条件下反应3 h。待反应结束后,通过旋转蒸发除去溶剂甲苯,得稠状物。接着用二氯甲烷溶解稠状物,再用饱和碳酸氢钠溶液洗涤直至样品呈碱性。碱化完成后,分液,所得有机相用无水硫酸镁干燥2~3 h,再通过旋转蒸发除去溶剂,得关环产物8,中间体8不需纯化直接进行下一步投料。
先用分析天平称取0.91 g中间体8加入至50 mL烧瓶中,再用量筒依次量取5.0 mL三氟乙酸、5.0 mL二氯甲烷一并加入其中,20~25 ℃条件下搅拌反应。通过薄层色谱法(TLC)监测反应结束后,加入饱和碳酸氢钠溶液,调节pH至碱性区间,弃去水层,得有机层。所得有机层用质量分数为20%的盐酸酸化成盐(TLC检测),后弃去有机层,得水层。所得水层补充适量二氯甲烷后,再用饱和NaHCO3溶液调pH至碱性区间除去盐酸,随后分液得有机层。所得有机层用无水硫酸镁干燥2~3 h,再过滤,随后旋转蒸发除去溶剂得中间体5a,熔点 122.5~124.4 ℃(文献[14]值:124~126 ℃)。
采用相同方式制备中间体5b: 黄色固体, 产率63.6%,熔点(m.p.) 133.4~136.2 ℃;1H NMR δ: 7.85~7.87 (m, 2H), 7.75~7.82 (m, 2H), 7.42~7.46 (m, 4H), 7.36~7.41 (m, 1H), 4.02 (s, 2H);13C NMR δ: 153.3, 141.8, 135.5, 133.6, 133.3, 132.4, 129.1, 128.8, 128.7, 128.5, 125.4; IR (KBr, cm-1): 3 441, 3 315, 3 195, 1 617, 1 524, 1 472, 1 361, 1 143, 839, 764, 702; C15H11ClN2S元素分析理论计算值: C 62.82, H 3.87, N 9.77; 实测值 C 62.77, H 3.92, N 9.85.
1.3 目标化合物1的合成
先后用分析天平称取5.0 mmol取代苯甲酸和5.98 g (50 mmol)氯化亚砜加入至100 mL烧瓶中,在20~25 ℃氮气保护下反应4~6 h。待反应结束后,通过旋转蒸发除去剩余的氯化亚砜,得中间体2粗品,不需纯化直接进行下一步投料。
用量筒量取15.0 mL 25%的氨水加入至100 mL烧瓶中,然后在冰水浴的条件下,通过恒压滴液漏斗向其滴入中间体2的二氯甲烷溶液20.0 mL,注意控制滴速。待试剂滴加完成后,继续搅拌回流0.5 h。待反应结束后,用二氯甲烷作萃取剂,每次用量15.0 mL,萃取水相3次,并合并有机相。有机相先用饱和氯化钠溶液洗涤,随后用无水硫酸镁干燥,最后通过旋转蒸发除去萃取剂,得固体。所得固体用甲苯做溶剂进行重结晶提纯,得中间体3取代苯甲酰胺。
先用分析天平称取2.0 mmol中间体3取代苯甲酰胺加入至100 mL烧瓶中,然后在冰水浴条件下,用量筒量取9 .0 mL无水1,2-二氯乙烷作溶剂,最后通过恒压滴液漏斗向其慢慢滴入6.0 mL 含0.51 g草酰氯的二氯乙烷混合液。反应液先在20~25 ℃条件下反应1~2 h,后升温至50~60 ℃反应3~4 h,最后再加热回流直至无氯化氢气体放出。待反应结束后,通过旋转蒸发除去多余的草酰氯,得黄色油状液体中间体4,不需纯化直接进行下一步投料。
用量筒量取中间体4的甲苯溶液6.0 mL加入至100 mL烧瓶中,待加热至回流后,通过恒压滴液漏斗向其慢慢滴入2.0 mmol 2,4-二苯基-5-氨基噻唑的甲苯溶液。待滴加完成后,继续反应3~5 h后,冷却反应液,过滤,得固体。所得固体用N,N-二甲基甲酰胺作溶剂进行重结晶,最后得目标产物1a~1m。
1-((2,4-二苯基)噻唑-5-基)-3-(2-乙氧基苯甲酰基)脲 (1a): 白色固体,产率82.6%,熔点196.5~198.2 ℃;1H NMRδ: 11.92 (s, 1H), 11.69 (s, 1H), 7.96 (d,J=7.0 Hz, 2H), 7.85 (d,J=7.0 Hz, 2H), 7.76 (dd,J=6.5, 1.5 Hz, 1H), 7.57~7.58 (m, 3H), 7.48~7.51 (m, 4H), 7.19 (d,J=8.5 Hz, 1H), 7.08 (t,J=7.5 Hz, 1H), 4.22 (q,J=7.0 Hz, 2H), 1.42 (t,J=6.5 Hz, 3H);13C NMRδ: 168.1, 158.8, 157.3, 150.6, 140.2, 134.8, 134.1, 133.8, 131.1, 130.3, 129.7, 129.7, 129.4, 128.6, 128.1, 125.8, 121.3, 121.2, 113.8, 65.3, 14.9; IR (KBr)ν: 3 272, 3 142, 1 703, 1 669, 1 560, 1 472, 1 297, 1 131, 1 032, 753, 684 cm-1; MS (70 eV)m/z(%): 443(M+, 25); C25H21N3O3S元素分析理论计算值: C 67.70, H 4.77, N 9.47; 实测值C 67.60, H 4.81, N 9.48。
1-((2,4-二苯基)噻唑-5-基)-3-(5-甲基-2-硝基苯甲酰基)脲 (1b): 黄色固体, 产率85.2%,熔点207.6~209.4 ℃;1H NMRδ: 11.84 (s, 1H), 11.36 (s, 1H), 8.16 (d,J=9.0Hz, 1H), 7.99 (d,J=7.0 Hz, 2H), 7.85 (d,J=7.0 Hz, 2H), 7.61 (d,J=7.0 Hz, 2H), 7.55 (t,J=7.5 Hz, 2H), 7.52~7.55 (m, 3H), 7.46 (t,J=7.0 Hz, 1H), 2.45 (s, 3H);13C NMRδ: 169.4, 159.1, 150.7, 146.5, 143.6, 140.7, 133.8, 133.5, 132.4, 130.4, 129.8, 129.8, 129.6, 128.7, 128.2, 126.1, 124.7, 21.4; IR (KBr)ν: 3 215, 3 109, 1 698, 1 555, 1 437, 1 342, 1 228, 1 132, 829, 753, 698, 677 cm-1; MS (70 eV)m/z(%): 458(M+, 5); C24H18N4O4S元素分析理论计算值: C 62.87, H 3.96, N 12.22; 实测值C 63.08, H 4.04, N 12.11。
1-((2,4-二苯基)噻唑-5-基)-3-(5-氟-3-溴苯甲酰基)脲 (1c): 黄色固体, 产率84.0%,熔点202.1~205.1 ℃;1H NMRδ: 11.68 (s, 2H), 8.04 (s, 1H), 7.97 (d,J=7.0 Hz, 2H), 7.88 (d,J=8.0 Hz, 1H), 7.84 (d,J=8.0 Hz, 3H), 7.57 (t,J=8.0 Hz, 2H), 7.49 (m, 4H);13C NMRδ: 166.9, 163.2, 161.4, 158.9, 150.8, 140.4, 135.8, 134.2, 133.8, 130.3, 129.7, 129.7, 128.7, 128.2, 126.1, 123.9, 123.6, 122.8, 122.7, 115.4, 115.1; IR (KBr)ν: 3 211, 3 101, 1 687, 1 558, 1 483, 1 283, 1 224, 1 126, 762, 715, 676 cm-1; MS (70 eV)m/z(%) 497(M+, 47); C23H15BrFN3O2S元素分析理论计算值: C 55.66, H 3.05, N 8.47; 实测值C 55.60, H 3.10, N 8.57。
1-((2,4-二苯基)噻唑-5-基)-3-(2,6-二氯苯甲酰基)脲 (1d): 白色固体, 产率82.7%,熔点229.5~232.2 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 12.15 (s, 1H), 11.31 (s, 1H), 7.96 (d,J=6.0 Hz, 2H), 7.83 (d,J=7.0 Hz, 2H), 7.58 (d,J=7.0 Hz, 2H), 7.56 (t,J=8.0 Hz, 3H), 7.48~7.53 (m, 3H), 7.43 (t,J=7.5 Hz, 1H);13C NMR (DMSO-d6, 125 MHz)δ: 1 665.4, 159.3, 150.3, 141.2, 133.8, 133.6, 132.8, 131.2, 130.9, 130.5, 129.8, 129.7, 129.6, 129.4, 128.7, 128.3, 126.2; IR (KBr)ν: 3 211, 3 065, 1 692, 1 558, 1 498, 1 435, 1 248, 1 153, 755, 691 cm-1; MS (70 eV)m/z(%): 467(M+, 11); C23H15Cl2N3O2S元素分析理论计算值: C 58.98, H 3.23, N 8.97; 实测值C 59.10, H 3.28, N 8.87。
1-((2,4-二苯基)噻唑-5-基)-3-(2-硝基-5-氟苯甲酰基)脲 (1e): 黄色固体, 产率79.9%,熔点227.5~228.3 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 12.41 (s, 1H), 11.38 (s, 1H), 8.71 (m, 1H), 8.35~8.37 (m, 1H), 8.09~8.13 (m, 2H), 7.68 (d,J=7.5 Hz, 2H), 7.58 (m, 3H),7.44~7.47 (m, 3H), 7.37 (d,J= 7.5 Hz, 1H);13C NMR (DMSO-d6, 125 MHz)δ: 167.6, 161.2, 152.6, 150.1, 146.5, 143.6, 133.2, 132.6, 131.8, 130.5, 129.8, 129.5, 129.6, 128.2, 126.8, 126.4, 123.7, 117.6, 117.1; IR (KBr)ν: 3 216, 3 156, 1 688, 1 559, 1 458, 1 284, 1 253, 1 136, 832, 769, 696 cm-1; MS (70 eV)m/z(%): 464(M+, 5); C23H15FN4O4S元素分析理论计算值: C 59.74, H 3.27, N 12.12; 实测值C 59.72, H 3.32, N 12.30。
1-((2,4-二苯基)噻唑-5-基)-3-(2-甲基苯甲酰基)脲 (1f): 白色固体, 产率90.6%,熔点232.6~233.4 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 11.82 (s, 1H), 11.55 (s, 1H), 7.99 (d,J= 7.0 Hz, 2H), 7.85 (d,J=7.0 Hz, 2H), 7.55~7.61 (m, 5H),7.45~ 7.51 (m, 3H), 7.32~7.37 (m, 2H), 2.41 (s, 3H);13C NMR (DMSO-d6, 125 MHz)δ: 172.1, 158.8, 151.2, 140.1, 136.6, 134.3, 134.2, 133.8, 131.6, 131.3, 130.3, 129.8, 129.6, 129.6, 128.6, 128.6, 128.3, 126.2, 126.1, 19.8; IR (KBr)ν: 3 226, 3 108, 1 691, 1 569, 1 463, 1 259, 1 226, 1 088, 747, 724, 692 cm-1; MS (70 eV)m/z(%): 413(M+, 17); C24H19N3O2S元素分析理论计算值: C 69.71, H 4.63, N 10.16; 实测值C 69.88, H 4.70, N 10.14。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(2-乙氧基苯甲酰基)脲 (1g): 淡黄色固体, 产率84.3%,熔点200.6~202.4 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 11.73 (s, 1H), 10.97(s, 1H), 8.22 (d,J=7.5 Hz, 1H), 8.01 (d,J=7.5 Hz, 2H), 7.82 (d,J=7.5 Hz, 2H), 7.56 (d,J=8.0 Hz, 1H),7.43~7.47 (m, 3H), 7.14 (q,J=7.5 Hz, 3H), 7.01 (d,J=8.5 Hz, 1H), 4.21 (q,J=7.0 Hz, 2H), 1.46 (t,J=6.5 Hz, 3H);13C NMR (DMSO-d6, 125 MHz)δ: 170.9, 167.2, 160.1, 156.6, 148.9, 146.7, 143.4, 134.5, 132.8, 131.3, 130.8, 129.5, 129.3, 128.9, 128.8, 128.2, 120.6, 118.4, 114.5, 64.3, 14.9; IR (KBr)ν: 3 334, 3 147, 1 695, 1 566, 1 475, 1 287, 1 218, 1 125, 1 046, 842, 757, 681 cm-1; MS (70 eV)m/z(%) 477 (M+, 24);C25H20ClN3O3S元素分析理论计算值: C 62.82, H 4.22, N 8.79; 实测值C 62.98, H 4.30, N 8.90。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(3,5-二甲氧基苯甲酰基)脲 (1h): 淡黄色固体, 产率90.0%,熔点198.0~198.5 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 11.87 (s, 1H) 11.57 (s, 1H), 7.97 (d,J=8.5 Hz, 2H), 7.88 (d,J=8.5 Hz, 2H), 7.63 (d,J=8.5 Hz, 2H), 7.48~7.55 (m, 4H), 7.19 (d,J=2.0 Hz, 2H), 3.82 (s, 6H);13C NMR (DMSO-d6, 125 MHz)δ: 169.1, 162.9, 160.9, 159.2, 151.5, 139.2, 133.7, 133.2, 130.4, 129.8, 129.8, 129.7, 126.1, 106.8, 106.2, 56.1, 36.3, 31.3; IR (KBr)ν: 3 392, 3 119, 1 707, 1 651, 1 548, 1 472, 1 354, 1 206, 1 158, 842, 804, 758, 695 cm-1; MS (70 eV)m/z(%): 493 (M+, 5);C25H20ClN3O2S元素分析理论计算值: C 65.00, H 4.36, N 9.10; 实测值C 65.21, H 4.48, N 9.19。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(2,6-二氯苯甲酰基)脲 (1i): 白色固体, 产率94.3%,熔点235.6~238.2 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 12.15 (s, 1H), 11.27 (s, 1H), 7.97 (d,J=6.5 Hz, 2H), 7.85 (d,J=8.5 Hz, 2H), 7.58 (m, 4H), 7.54 (s, 1H), 7.49 (t,J=8.0 Hz, 3H);13C NMR (DMSO-d6, 125 MHz)δ: 166.8, 159.9, 150.4, 140.3, 133.4, 133.0, 132.9, 131.3, 130.7, 130.6, 129.9, 129.7, 129.5, 129.4, 128.7, 128.6, 126.3; IR (KBr)ν: 3 382, 3 103, 1 692, 1 562, 1 493, 1 275, 1 226, 1 144, 833, 714, 768, 697, 671 cm-1; MS (70 eV)m/z(%) 503(M+, 5);C23H14Cl3N3O2S元素分析理论计算值: C 54.94, H 2.81, N 8.36; 实测值C 55.11, H 2.89, N 8.55。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(2-硝基-5-氟苯甲酰基)脲 (1j): 橘黄色固体, 产率72.0%,熔点229.8~231.6 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 12.42 (s, 1H), 11.91 (s, 1H), 8.36 (q,J=6.5, 1H), 8.08~8.12 (m, 2H), 7.95 (d,J=8.5 Hz, 2H), 7.72~7.77 (m, 2H), 7.60~7.65 (m, 2H), 7.48~7.53 (m, 2H), 7.15 (d,J= 9.0 Hz, 1H);13C NMR (DMSO-d6, 125 MHz)δ: 170.9, 169.3, 167.3, 160.2, 148.9, 146.7, 143.4, 141.7, 134.4, 131.3, 130.9, 129.5, 129.3, 128.9, 128.8, 125.7, 124.2, 116.8, 113.2; IR (KBr)ν: 3 215, 3 086, 1 727, 1 646, 1 567, 1 479, 1 357, 1 129, 1 143, 839, 765, 691 cm-1; MS (70 eV)m/z(%): 497(M+, 5);C23H14ClFN4O4S元素分析理论计算值: C 55.60, H 2.84, N 11.28; 实测值C 55.48, H 2.91, N 11.42。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(4-氟-3-氯苯甲酰基)脲 (1k): 淡黄色固体, 产率75.7%,熔点250.1~251.4 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 11.75 (s, 1H), 11.88 (s, 1H) 8.26 (d,J=7.0 Hz, 1H), 8.09~8.13 (m, 2H), 7.97 (d,J=8.0 Hz, 2H), 7.87 (t,J=9.0 Hz, 2H), 7.66~7.71 (m, 2H), 7.50~7.56 (m, 3H);13C NMR (DMSO-d6, 125 MHz) δ: 170.9, 167.4, 162.3, 160.2, 148.9, 146.7, 143.4, 134.5, 131.3, 131.1, 130.9, 130.8, 129.4, 129.2, 129.1, 128.9, 128.8, 127.4, 120.9, 117.1; IR (KBr)ν: 3 235, 3 118, 1 688, 1 564, 1 471, 1 267, 1 227, 1 127, 829, 746, 694 cm-1; MS (70 eV)m/z(%) 485(M+, 5);C23H14Cl2FN3O2S元素分析理论计算值: C 56.80, H 2.90, N 8.64; 实测值C 56.56, H 2.88, N 8.75。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(3,4,5-三甲氧基苯甲酰基)脲 (1l): 白色固体, 产率87.6%,熔点219.4~220.3 ℃;1H NMR (DMSO-d6, 500 MHz)δ: 11.94 (s, 1H), 11.83 (s, 1H), 7.94 (d,J=7.5 Hz, 1H), 7.86 (d,J=7.5 Hz, 1H), 7.63 (d,J=7.5, 1H), 7.49 (d,J= 7.5 Hz, 2H), 7.38 (s, 2H), 7.31 (m, 4H), 3.87 (s, 6H), 3.76 (s, 3H);13C NMR (DMSO-d6, 125 MHz)δ: 166.6, 159.2, 153.4, 153.3, 151.7, 149.5, 142.3, 133.8, 133.1, 129.8, 129.7, 129.7, 127.8, 126.8, 126.1, 106.8, 106.2, 60.8, 56.7; IR (KBr)ν: 3 294, 3 123, 1 691, 1 547, 1 467, 1 332, 1 133, 1 002, 834, 759, 694 cm-1; MS (70 eV)m/z(%): 523(M+, 5);C26H22ClN3O5S元素分析理论计算值: C 59.60, H 4.23, N 8.02; 实测值C 59.50, H 4.28, N 8.14。
1-((2-苯基-4-对氯苯基)噻唑-5-基)-3-(2,3-二甲氧基苯甲酰基)脲 (1m): 淡黄色固体, 产率87.5%,熔点235.9~237.6 ℃;1H NMR (DMSO-d6, 500 MHz) δ: 11.65 (s, 1H), 11.28 (s, 1H), 7.97 (d,J=7.0 Hz, 2H), 7.88 (d,J=8.5 Hz, 2H), 7.62 (d,J=8.0 Hz, 2H), 7.48~7.54 (m, 3H), 7.29 (d,J=7.5 Hz, 1H), 7.20 (d,J=9.0 Hz, 2H), 3.87 (s, 3H), 3.84 (s, 3H);13C NMR (DMSO-d6, 125 MHz) δ: 170.9, 167.4, 160.1, 153.7, 149.3, 148.8, 146.8, 143.5, 134.4, 131.3, 130.8, 129.5, 129.3, 128.9, 128.8, 122.3, 120.9, 119.4, 118.8, 60.9, 56.2; IR (KBr)ν: 3 273, 3 186, 2 930, 2 853, 1 699, 1 562, 1 458, 1 263, 1 222, 1 096, 1 067, 838, 788, 753, 686 cm-1; MS (70 eV)m/z(%): 493(M+, 16);C25H20ClN3O4S元素分析理论计算值: C 60.79, H 4.08, N 8.51; 实测值C 60.70, H 4.13, N 8.65。
1.4 生物活性测试
选用粘虫、棉铃虫、玉米螟和蚊幼虫作为实验对象,对设计并制备的新化合物的杀虫活性进行测试。新化合物杀虫活性测试方案按照文献[9]的方法进行。
2 结果与讨论
2.1 化合物的合成
先以取代苯甲酸为原料,按文献[11-13]经三步法制备芳基异氰酸酯,再用所得的芳基异氰酸酯与2,4-二取代-5-氨基噻唑作用,即可获得目标化合物1(图 3)。实验过程中发现,在合成目标产物1时,甲苯作为溶剂最佳,其产率明显优于其它对照溶剂如乙腈、苯及二甲苯等。
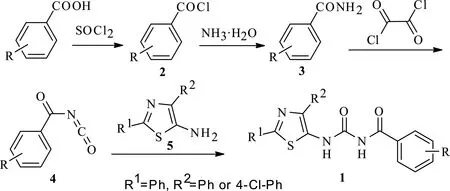
图3 目标化合物1的合成路线
利用文献[14,15]报道的方法合成中间体5(2,4-二取代-5-氨基噻唑),中间体5是制备目标产物1的重要中间体(图 4)。大量实验表明:无水甲苯用作溶剂,采用1.2倍当量的劳森试剂进行硫化关环时产率最高;在20~25 ℃时,采用12倍当量的三氟乙酸用于脱烷基最佳。所得的脱烷基产物采用成盐方式提纯,相较文献报道的柱层析,此法步骤更少,更具经济性及灵活性。
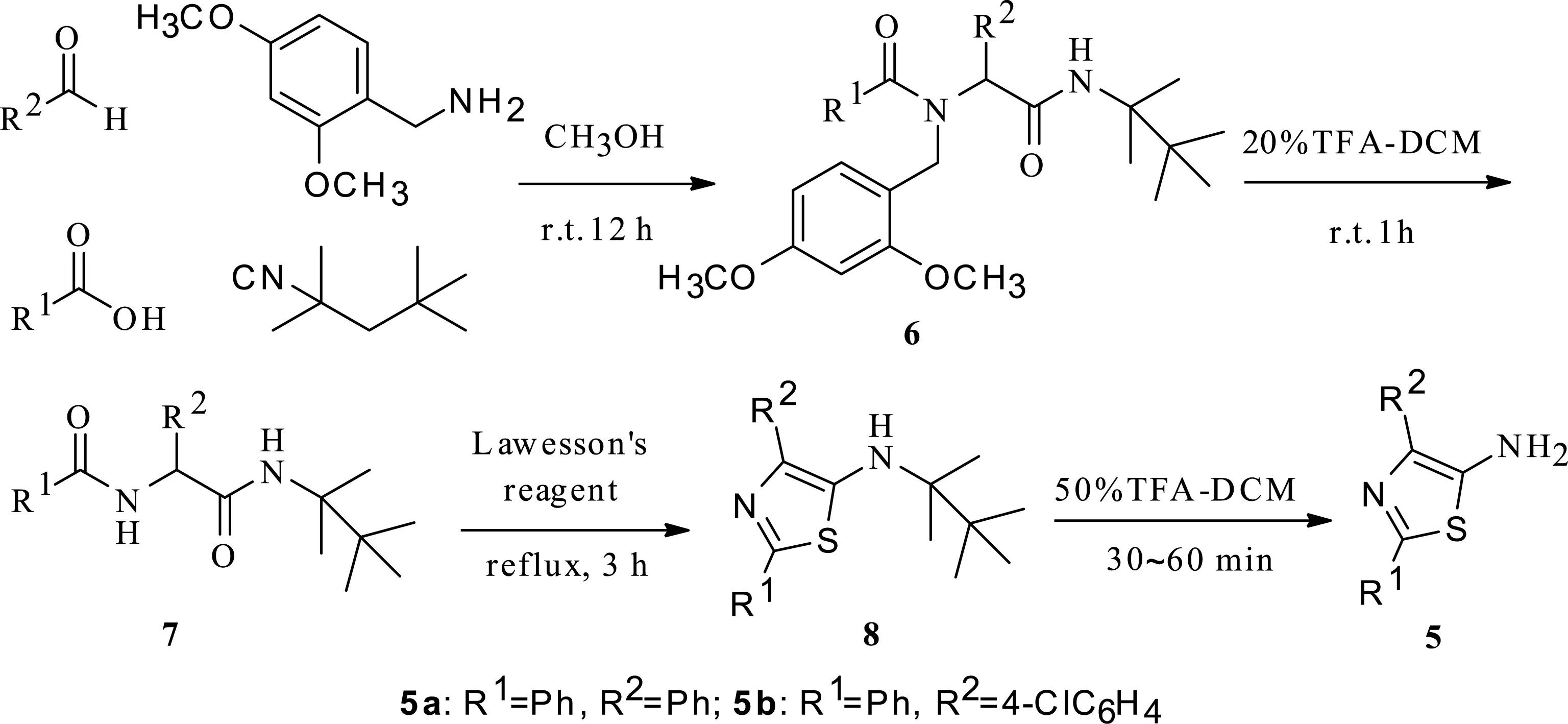
图4 中间体2, 4-二取代-5-氨基噻唑的合成路线
2.2 目标化合物波谱数据分析
以目标化合物1a为例,其1H NMR,13C NMR和IR数据解析如下:δ11.9为噻唑环上氨基氢的吸收峰;δ11.6处为两个羰基之间氨基氢的吸收峰;δ7.0~8.0处多重峰为3个苯环上14个氢的吸收峰;δ4.2处四重峰为取代苯环上乙氧基中亚甲基氢的吸收峰;δ1.4 处三重峰为甲基3个氢的吸收峰;δ168.1,157.3, 134.8处为噻唑环上3个碳的吸收峰,δ158.8处为脲桥上与苯环相连的羰基碳的吸收峰;δ140.2处为脲桥上与两个氮相连的羰基碳的吸收峰;δ150.6, 134.1, 133.8, 131.3, 130.3, 129.7, 129.4, 128.6, 128.1, 125.8, 121.3, 121.2, 113.8为苯环上碳的吸收峰;δ65.3为乙氧基上甲基碳的吸收峰;δ14.9 为乙氧基上亚甲基碳的吸收峰;3 272 cm-1为脲桥N—H伸缩振动吸收峰;3 142 cm-1为氨基噻唑氨基伸缩振动吸收峰;1 703 cm-1为苯甲酰基羰基的伸缩振动吸收峰;1 669 cm-1为脲桥另一羰基的伸缩振动吸收峰;1 560 cm-1为酰基脲C—N伸缩振动吸收峰;753 cm-1为苯环邻位二取代C—H面外弯曲振动吸收峰。
2.3 化合物的杀虫活性
以氟铃脲为阳性对照,采用浸叶法(粘虫、棉铃虫和玉米螟)和浸虫法(蚊幼虫),对目标化合物进行杀虫活性测试(表 1)。初步生物活性测试结果表明:大多数新制备的目标产物均表现出良好的杀虫活性。其中,化合物1c,1e,1i和1k在低浓度10 mg·L-1时,均能对蚊幼虫实现100%的致死率;当其浓度继续降低至5 mg·L-1时,化合物依然表现出较好的杀虫活性。此外,化合物1g对棉铃虫和玉米螟的杀虫活性较佳,当浓度达到200 mg·L-1时,其致死率达到100%;将其浓度降低至100 mg·L-1时,化合物1g对棉铃虫和玉米螟的致死率仍有70%左右。
结合表1中杀虫活性数据和III与IV两个系列化合物结构可以看出:固定噻唑环,芳甲酰基苯环上取代基的种类和位置变化对目标化合物的杀虫活性有很大影响。对于棉铃虫和玉米螟而言,带有给电子基团的化合物1b和1g杀虫活性明显高于其他化合物,说明芳甲酰基苯环上连有给电子基团有利于目标化合物杀虫活性的提高;对于蚊幼虫而言,带有卤原子的化合物1c,1e,1i和1k的杀虫活性明显优于其他化合物,说明在芳甲酰基苯环的3位、4位或5位上引入卤素原子尤其是氟原子有利于活性的提高;对于粘虫而言,在芳甲酰基苯环上引入取代基杀虫活性均较低,且构效关系没有明显规律。同时III与IV两个系列化合物对比,固定芳甲酰基苯环,噻唑环上取代基对目标化合物的杀虫活性也有一定的影响,如化合物1a和1g相比,噻唑环4位上连4-氯苯基的1g相比直接连苯基的1a的杀虫活性更高。
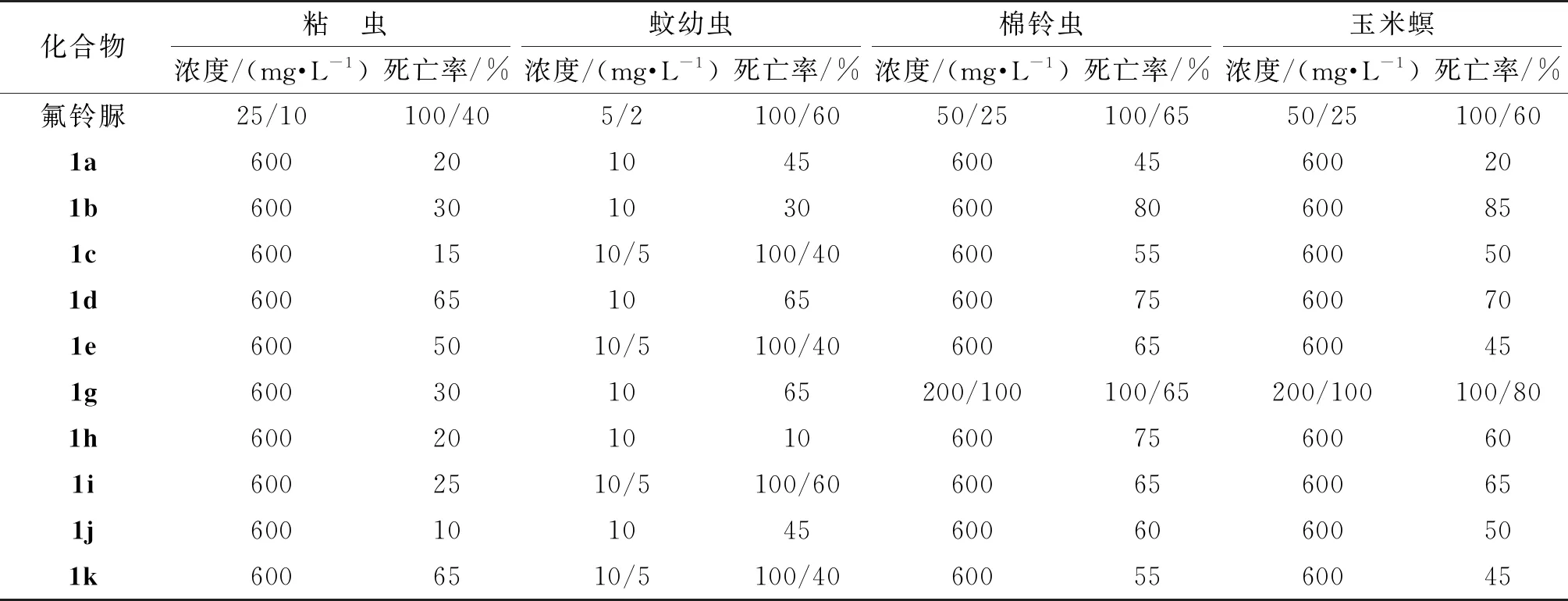
表1 目标化合物的杀虫活性
3 结论
基于2-氨基噻唑与5-氨基噻唑为生物电子等排体,采用活性亚结构拼接法,将5-氨基噻唑环核引入苯甲酰脲类结构中,设计并制备了13个结构新颖的含5-氨基噻唑环核的苯甲酰脲类分子。生物活性测试结果显示:在实验浓度下,目标化合物对粘虫和蚊幼虫显示出很好的活性。当浓度为10 mg·L-1时,化合物1c,1e,1i和1k对蚊幼虫能实现100%的致死率;当进一步降低浓度至5 mg·L-1时,上述化合物仍表现出较好的杀虫活性。此外,目标化合物还对粘虫、棉铃虫和玉米螟显示出一定的杀虫活性,其中化合物1g浓度为200 mg·L-1时,能对棉铃虫和玉米螟实现100%的致死率,故该类型化合物可作结构的进一步优化,以期发现杀虫活性更优的化合物。
