DNTF与凡士林混合体系相互作用研究①
2021-11-24牛诗尧曲文刚高红旭赵凤起
牛诗尧,曲文刚,高红旭,赵凤起
(西安近代化学研究所 燃烧与爆炸技术重点实验室,西安 710065)
0 引言
3,4-二硝基呋咱基氧化呋咱(DNTF)是一种新型高能量密度材料,具有爆速高、密度大等优点,可作为混合炸药和推进剂的主要成分,具有广阔的应用前景[1-4]。同时,由于DNTF对硝化甘油(NG)有增塑作用,因此对于推进剂来说它既是一种高能组分,又是一种增塑剂[5]。为评估DNTF在推进剂中使用安全性,需要DNTF与推进剂中组分形成混合体系后,还能保持各自的物理性质以及化学性质不发生大的改变。当混合组分之间具有较强的物理及化学相互作用时,混合组分会出现晶析、迁移、放热和质量损失等多种现象,因此会造成推进剂的使用和存储出现一定风险。推进剂中组分相互作用的主要研究方法是通过使用真空安定性研究混合体系的化学安定性,以此表征其相互作用强弱[6]。然而,由于DNTF在实验条件下容易熔化和气化[7],该方法在实践过程中危险系数较高,对于研究DNTF体系与其他物质组成的混合体系之间的相互作用有一定的局限性[8]。因此,常用热分析法和化学动力学模拟的方法研究DNTF与其他组分之间的相互作用[9-12]。
为进一步提高和稳定固体推进剂的燃烧效率与工艺性能,一些其他组分常需要添加在推进剂中作为助剂[13-14]。而添加剂所起作用不同,对其性能的要求不同。凡士林是推进剂中较为常用的一种工艺助剂,它可以有效提高改性双基推进剂的工艺性能,同时凡士林为多种长链烷烃形成的混合物,其化学性质是惰性的,一般情况下与有机含能组分之间不会形成强的化学相互作用[15]。
本文通过实验和理论两种手段探索了DNTF与推进剂中助剂凡士林之间的相互作用,通过不同的实验方法研究了DNTF与凡士林之间的化学相互作用,采用计算模拟方法研究了不同温度范围下DNTF与凡士林之间的物理相互作用,为DNTF基推进剂的安全使用提供理论支撑。
1 实验方法
1.1 原料
DNTF(图1),纯度大于99%,西安近代化学研究所提供。凡士林为新能源化工公司提供的白凡士林,本工作中所使用的凡士林均指代白凡士林。
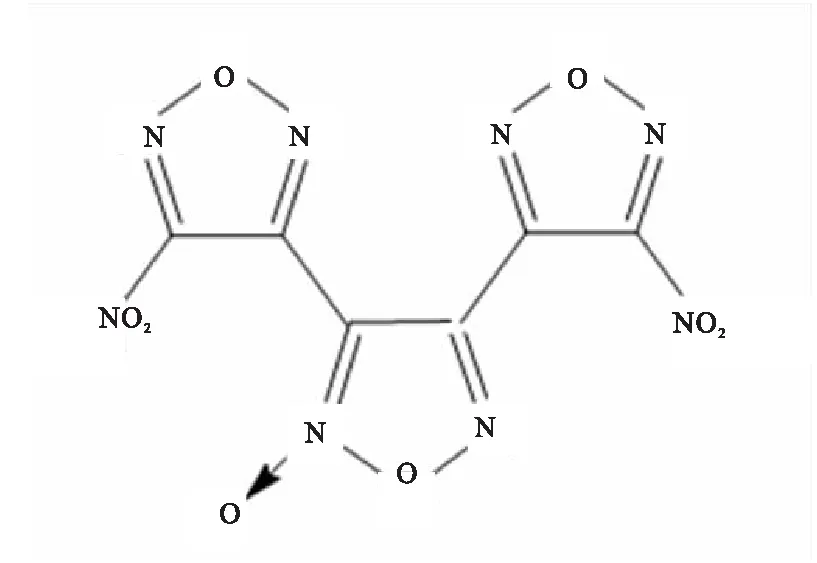
图1 DNTF的分子结构
1.2 实验仪器及测试条件
DSC实验采用德国耐驰 DSC204 HP 型差示扫描量热仪,气氛采用高纯氮,压力为1 MPa,升温速率为10 ℃/min。
TG实验通过力可TGA-701型,反应为常压,气氛为高纯氮气。
原位红外光谱为Nexus870型傅里叶变换红外光谱仪,美国Thermo-Fisher公司,配备MCT-A检测器,反应池为厦门大学制变温反应池,升温速率为5 ℃/min,仪器分辨率4 cm-1。
气质联用仪采用TSQ 8000 Evo,程序升温至80 ℃并保持,采用毛细管色谱柱,选择EI电离源。
DNTF与凡士林混合体系的撞击感度采用GJB 772A—1997方法中601.2特性落高法获得,落锤重量为5 kg,单次实验量为50 mg。
2 计算方法
低温状态下DNTF与凡士林组分之间的相互作用分子动力学模拟研究通过Material Studio软件实现。无定型结构的几何优化选用COMPASS力场和Smart Minimization方法,收敛限为0.001 kcal/mol。MD模拟采用Nose-Hoover控温方法和Berendsen控压方法,范德华和静电作用分别用Atom-based和Ewald方法计算,截取半径选择12.5 Å,样条宽度取0.1 nm,缓冲宽度取0.05 nm,步长选择1 fs,选择等温等压(NPT)系综,温度为298.15 K,压力为1.0×105Pa。模拟时间为250 ps,为消除不合理的能量和体积对计算结果的影响,选择已经平衡的后50 ps体系用来计算相关性能。
3 结果分析与讨论
3.1 凡士林对DNTF的高温分解化学作用的实验研究
3.1.1 DNTF与凡士林热解反应
DNTF与VSL的1∶1混合物在1 MPa下10 ℃/min升温的热解过程放热情况如图2所示。DNTF初始放热温度为232 ℃,分解峰温为271 ℃。该初始放热温度与文献中报道的反应温度240.6 ℃基本相符[16-18]。凡士林在超过200 ℃时缓慢分解,由于凡士林中烷烃组分较为复杂,放热峰形成一个平缓的鼓包。DNTF/VSL与DNTF/C25H52两个混合体系的热分解初始温度为170 ℃,峰温为198 ℃,通过峰温漂移值判断[19],DNTF与凡士林之间分解过程的化学相互作用较明显,放热量(即峰面积积分)也有大幅度提升。

图2 DNTF/VSL的DSC热解曲线(1 MPa)
根据国军标GJB 772A—1997 502.1[20]差示扫描量热法判断相容性的办法,该体系不相容。混合组分较纯DNTF来说,混合体系放热分解峰较存在较大程度的前移,峰温提前了73 ℃。该结果与南京理工大学李席等[11]通过DSC研究DNTF/Wax体系热解得到的结果(峰温提前了87.4 ℃)相似,证明了类凡士林物质与DNTF之间较强的化学相互作用。
凡士林对DNTF的加速分解作用,也可以体现在TG曲线中(图3)。由DSC可知,200 ℃下DNTF只有少量分解。而从TG曲线可以看出,凡士林在升温过程中只有少量分解,DNTF和DNTF/VSL在升温过程中即开始有热损失,是由于DNTF本身的升华现象引起的。而随着温度升高,DNTF/VSL的热损失率在250 ℃之前高于DNTF本身,在250 ℃之后,DNTF纯物质本身快速分解。这可能是由于DNTF分解过程中小分子的自催化作用引起的。而该现象也一定程度上说明了凡士林对于DNTF分解的促进作用。
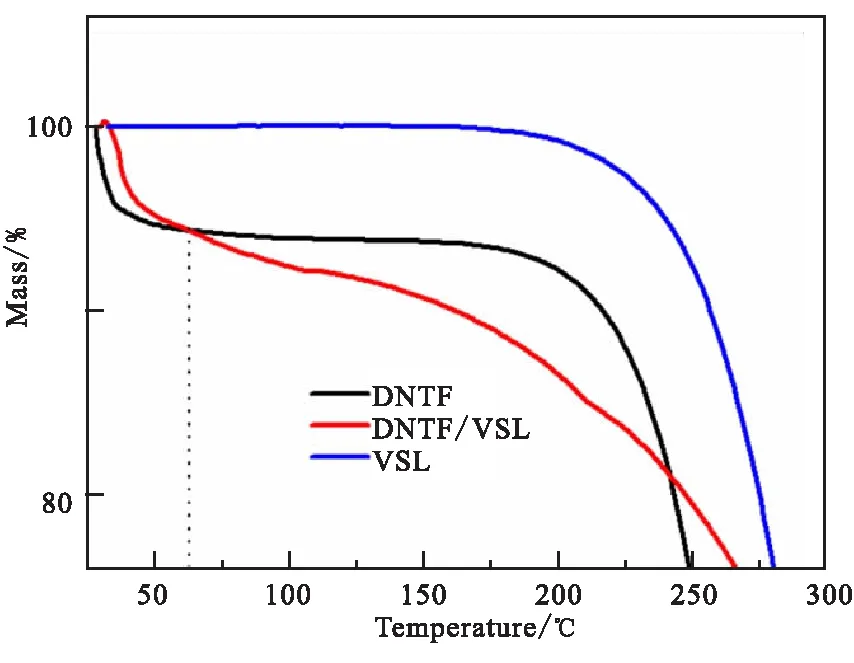
图3 DNTF/VSL的热失重曲线(10 ℃/min)
3.1.2 DNTF/VSL热分解机理
文献[21]表明,DNTF可能有六种解离方式,其中活化能相对较低(30~50 kcal/mol)的有两个过程,其一为C—NO2中NO2的旋转导致CONO异构化中间体的形成,然后导致NO分子碎片的产生;另一种低活化能分解形式是两边的恶二唑环断裂。
凡士林的主要成分是液体烷烃,烷烃可能在低温状态下与氧气或者羟基自由基发生低温氧化反应,而在高温状态直接发生裂解反应。反应遵循链引发、链增长和链终止的自由基反应机理,即通过烷烃分子化学键的断裂产生自由基,再经过自由基之间的转化和传递,最终形成稳定的产物分子[22]。
在3.1.1节中,通过DSC可以判断DNTF分解和烷烃的裂解过程相互促进。为了进一步描述混合组分的分解历程,通过原位红外方法得到了DNTF与凡士林混合组分的分解产物信息。图4描述DNTF/VSL在350 ℃下分解产物与DNTF纯物质分解产物的红外光谱,DNTF/VSL混合体系分解过程中可以看到2240 cm-1处明显的N2O气体峰。同时,DNTF/VSL混合体系在800~1800 cm-1处的峰基本消失,证实DNTF已经分解并趋于基本完全分解,剩余产物中烷烃量较多,在产物的红外光谱中仍有较为明显的烷烃C—H振动峰(3000 cm-1)。烷烃反应中间体极大地加速了DNTF的反应历程,因此DNTF 的反应趋于完成,在350 ℃停止反应会剩余较多凡士林。对于烷烃分解加速DNTF的分解机理,结合文献[23]可以这么解释:由于烷烃分解过程中由于β-裂解产生大量的活性H自由基,H质子有利于与DNTF中初始分解过程中NO2的消除,从而加速DNTF的分解。

图4 DNTF与DNTN/VSL分解产物的红外光谱
3.2 常温下DNTF与凡士林混合的相互作用计算
3.2.1 DNTF与凡士林混合相互作用模型建立
通过红外光谱和气质联用分析(图5)确定,白凡士林中主要成分由C20H42~C35H72的长链烷烃构成,杂质成分为萘等芳香类化合物。
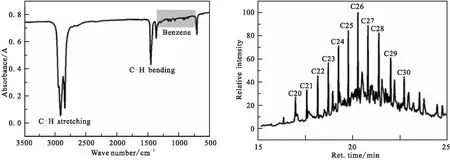
(a) IR spetrum (b) GC-MS spetrum
为构建凡士林中主要成分的模型,选择三种链长烷烃,构建三种链长烷烃(C20H42、C25H52、C30H62)无定型模型,以C25H52/DNTF为例,共混物模型中的原子数为1048,密度为1.12 g/cm3,DNTF与C25H52的质量比为1∶1。以同样方法构建DNTF与凡士林中其他烷烃、杂质萘的共混体系模型,如图6所示。

(a) DNTF/C20H42 (b) DNTF/C25H52
3.2.2 DNTF与凡士林组分混合体系的相互作用
对于分子间没有强极性基团或氢键作用的有机体系,两种材料的溶度参数之差(Δδ)只要满足|Δδ|<(1.3-2.1) J1/2/cm3/2,共混体系就满足相容原则[24-25]。两组分的溶度参数差值越小,越容易满足此条件、相容性越好[26-27]。
表1列出了DNTF与凡士林主要成分不同链长烷烃、杂质萘之间的相溶度参数。通过溶度参数计算可以发现,DNTF与各种烃均之间的溶度参数相差较大,其中与稠环芳烃萘的不溶程度最大。因此,通过溶度积参数判断,DNTF与凡士林主要成分之间均不相容。

表1 DNTF与凡士林组分之间的相容性
混合模型通过无规共混后的稳定结构体积增大,密度减小。说明动力学模拟前初始结构比较松散。而经过混合后(图7),DNTF分子间容易形成团聚,而烷烃分子间则向外围迁移并团聚。DNTF与凡士林中烷烃组分的无规共混结构经过动力学稳定后逐渐趋于相分离[28]。

(a)Before (b)After
径向分布函数RDF(Radical Distribution Function)可以描述混合体系中的相互作用性质。其中,混合体系的径向分布函数表达式为
式中ρ为体系密度;ri为粒子坐标;δ为质点的狄拉克函数。
当原子距离在0.26~0.31 nm之间的相互作用属于氢键,而0.31~0.5 nm属于范德华作用,原子距离大于0.5 nm则属于静电相互作用[6]。
为了更好地揭示分子间相互作用本质,图8中分析了DNTF/CnH2n+2及DNTF/Nap共混物分子模型中的分子间径向分布函数。
由图8可见,DNTF与DNTF之间能形成氢键作用(图8(a))。而混合体系中DNTF与烷烃相互作用本质主要是范德华相互作用和静电作用(图8(b)~(d)), DNTF与凡士林中的烷烃之间混合物的径向分布函数g(r)均不高于单纯物质的径向分布函数。因此,在DNTF与烷烃的混合体系中的相互作用强弱顺序为

(a) DNTF/C20H42 (b) DNTF/C25H52 (c) DNTF/C30H62
DNTF/DNTF> CnH2n+2/CnH2n+2>DNTF/CnH2n+2
由于长链烷烃的链影响,DNTF与凡士林中各组分之间的相互作用强弱顺序为DNTF/Nap>DNTF/C25H52>DNTF/C20H42≈DNTF/C30H62。
3.2.2 DNTF/VSL共混体系的结合能
DNTF与凡士林组分的分子间相互作用可以通过混合组分能量与纯物质能量之差得到。DNTF与凡士林中主要组分烷烃形成的共混物能量中范德华相互作用强于静电相互作用。分子间相互作用能可定量表征分子间的相互作用大小,当分子间相互作用能越大,共混体系越稳定[29]。
表2列出了DNTF与凡士林组分之间相互作用能。DNTF与烷烃之间的相互作用较为接近,而 DNTF与Nap之间的相互作用能较大。通过径向分布函数(3.2节)的分析可以看出,氢键是造成相互作用能差别较大的原因。

表2 DNTF与凡士林组分之间的相互作用能
为表征在贮存和使用条件下温度对混合物相互作用的影响,计算了DNTF/C25H52在不同温度下的溶度参数,见图9。

图9 不同温度下 DNTF/C25H52共混体系中的能量及溶度参数
结果表明,随着温度的升高,DNTF与烷烃之间的相互作用逐渐减增加。从溶度参数逐渐变小也说明了DNTF与烷烃之间的吸引作用越来越小,而排除作用越来越强,两种混合物在升温过程中相分离的趋势越来越明显[30]。
3.3 凡士林对DNTF撞击感度的影响
凡士林对于DNTF的撞击感度影响见表3。混合体系相比于纯DNTF更加敏感。当施加外力撞击时,会使DNTF与凡士林混合组分的安全性降低。说明凡士林对于DNTF的分解与爆炸具有促进作用。普遍认为炸药起爆过程是局部“热点”分解形成[31],从3.1节中DNTF与凡士林之间的热分解研究中,凡士林可以催化DNTF的分解过程,降低DNTF的分解温度。因此结合热点理论,可将凡士林对DNTF撞击感度的影响解释为:在起爆过程中凡士林促进DNTF“热点”处的分子分解,导致混合组分撞击敏感度升高。

表3 DNTF与凡士林混合组分的撞击感度
4 结论
采用差示扫描量热(DSC)与原位红外(In-situ IR)的方法,研究了DNTF与凡士林之间的化学相互作用。实验结果表明,DNTF与凡士林体系的分解过程包含了DNTF的分解和烷烃的氧化和部分裂解过程。在裂解过程中,混合体系的热解初始温度较DNTF自身分解来说明显提前。由于凡士林中烷烃的低温裂解产物可以催化DNTF的热解过程,使DNTF的分解温度明显地提前。
同时,通过分子动力学模拟的方法研究了共混状态下DNTF与凡士林组分之间的相互作用,DNTF/CnH2n+2之间主要为静电相互作用和范德华相互作用,DNTF/Nap之间存在氢键作用。通过溶度分析法判断DNTF与凡士林中组分不相容。同时,研究了升高温度对DNTF与凡士林共混体系的相互作用,发现随着温度升高,DNTF与凡士林分子之间的相互作用能逐渐减小,DNTF与烷烃之间的吸引作用越来越小,排除作用越来越强。
凡士林对DNTF撞击感度的试验结果表明,DNTF与凡士林的混合物感度比纯DNTF高,虽然推进剂中使用的凡士林含量较低,凡士林能够催化DNTF分解的特性是显著的。为了保证安全性,建议在实际过程中,需要在含DNTF的推进剂中尽量避免使用凡士林添加剂。
