海参皂苷Holothurin A 和Echinoside A 对肥胖小鼠尿酸代谢的影响
2021-11-23巨盛楠徐慧静王玉明李兆杰薛长湖张恬恬
巨盛楠,徐慧静,2,王玉明,3,李兆杰,薛长湖,3,张恬恬,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.永嘉县市场监督管理局,浙江温州 325100;3.青岛海洋科学与技术试点国家实验室,山东青岛 266237)
随着膳食结构和饮食生活习惯的变化,肥胖人群的比率呈逐年上升趋势。除糖、脂代谢异常外,肥胖患者存在明显的尿酸代谢紊乱[1−3]。尿酸代谢异常通常表现为体内尿酸水平升高[4−6],临床治疗困难,目前不能完全置治愈。因此,有必要筛选安全有效、天然来源的功能性食品成分预防肥胖引起的尿酸代谢异常。
尿酸代谢异常与肝脏尿酸合成增多及肾脏尿酸分泌减少密切相关[4]。皂苷是一类苷元为三萜或螺旋甾烷类化合物的糖苷。文献报道皂苷具有改善肾脏损伤的作用,但并没有深入研究皂苷对尿酸代谢的影响[7−8]。海参成分复杂,皂苷是海参的主要次级代谢产物[9]。海参皂苷结构上具有明显区别于陆地来源皂苷的硫酸酯化基团。前期研究发现海参总皂苷可显著降低高嘌呤饮食诱导的小鼠血尿酸水平[10−11]。Holothurin A(HA)和Echinoside A(EA)是海参总皂苷中含量较高的两种单体[12−15]。二者结构相似,均为海参烷型三萜皂苷,其母核的20 位C 原子上链有6 个碳原子的侧链,但HA 侧链上存在环氧结构[15]。目前关于HA 与EA 在体内调节尿酸代谢的构效关系尚未报道。
db/db 小鼠是一种自发肥胖性代谢综合征模型[16−17],本研究比较海参皂苷单体HA 和EA 对db/db肥胖小鼠尿酸代谢的影响,为海参皂苷的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
SPF 级雄性C57/BL6 小鼠、db/db 小鼠体重(20±2)g 南京君科生物工程有限公司;海参皂苷单体HA 和EA 均由中国海洋大学食品科学与人类健康实验室提供,纯度为91%,结构如图1 所示;尿酸、尿素氮、肌酐、黄嘌呤氧化酶、腺苷脱氨酶试剂盒 南京建成生物科技有限公司;伊红 上海试剂三厂;苏木精 上海蓝季科学发展有限公司;MMLV逆转录酶 美国Promega 公司;dNTP 大连宝生物工程有限公司;RNAase inhibitor 美国Roche 公司;EvaGreen 2X qPCR MasterMix 爱必梦生物科技有限公司;Random Primer 上海生工生物工程股份有限公司;其他的生化试剂 均为国产分析纯。

图1 海参皂苷Holothurin A 与Echinoside A 结构Fig.1 Structure of Holothurin A and Echinoside A
Spark 10M 型酶标仪 瑞士帝肯公司;UV-2550 型分光光度计 上海元析仪器有限公司;Neofuge 23R 型台式离心机 上海力新仪器有限公司;BH–200 型光学显微镜 舜宇光学科技有限公司;H–7000 型透射电镜 日本日立公司;IQ5 型Realtime PCR 仪 美国Bio-Rad 公司。
1.2 实验方法
1.2.1 动物分组及饲料配制 将雄性db/db 小鼠按体重随机分成3 组,分别是模型组、海参皂苷HA 组(HA)、海参皂苷EA 组(EA),每组8 只,C57/BL6 小鼠为正常对照组。动物饲料配方以AIN-93 配方为基础并加以调整,海参皂苷HA 和EA 组在模型组饲料的基础上减少玉米淀粉的添加量,再分别添加0.07%的海参皂苷单体HA 和EA,饲料成分如表1所示。

表1 动物实验饲料的成分Table 1 Compositions of experimental diets
1.2.2 动物实验 各组小鼠在环境温度(23±2) ℃、相对湿度65%±15%的条件下自由地进食和饮水,适应性喂养2 周,每日记录其体重及摄食量。干预2 周后称重,眼球取血,致死,立即解剖并迅速地取出肝脏、肾脏,称重后经液氮速冻保存于−80 ℃冰箱备用。解剖过程中取2 份肾脏组织分别迅速投入10%中性甲醛和4%戊二醛溶液中固定,用于制备切片。
1.2.3 肾脏生化指标测定 血液在室温静置30 min后,离心(2000×g,15 min)后得到血清,按照试剂盒说明分别测定血清尿酸水平、血清肌酐水平、血清尿素氮水平。
1.2.4 肝脏酶活测定 取小鼠肝脏匀浆取上清液,通过比色法测定肝脏黄嘌呤氧化酶(Xanthine Oxidase,XOD)和腺苷脱氨酶(Adenosine Deaminase,ADA)的活性,按照试剂盒说明书测定。
1.2.5 肾脏切片光学显微镜观察 将10%中性甲醛固定的肾皮质由石蜡包埋制成4 μm 切片,经苏木精、伊红染色后于光学显微镜下观察和拍照。
1.2.6 肾脏切片透射电镜观察 用4%戊二醛溶液固定的肾皮质制备切片,于电镜下观察肾小球的形态结构。
1.2.7 肾脏尿酸代谢相关基因mRNA 测定
1.2.7.1 总RNA 提取 取0.1 g 肾脏,采用Trizol 法[18],提取组织总RNA,测定260、280 nm 下吸光值A,计算A260与A280的比值在1.9~2 之间以保证RNA 的高纯度,再通过1.2%琼脂糖电泳结果验证肾脏RNA 未被降解。
1.2.7.2 RT-qPCR 检测基因表达量 取1 μg 肾脏总RNA,依照逆转录试剂盒的说明书进行逆转录,将得到的肾脏cDNA 稀释到合适的浓度后,用realtime qPCR(RT-qPCR)方法进行测定。PCR 条件为:总反应体系为25 μL,各反应物的用量,参照试剂盒(EvaGreen 2X qPCR MasterMix)说明书进行操作。目的基因产物的专一性验证通过PCR 扩增结束后进行溶解曲线分析。目的基因mRNA 表达量测定时以18s mRNA 表达量作为内参,并且将对照组设为100%。
所使用引物序列均经过 BLAST 验证,并由上海生工生物工程有限公司合成,具体引物序列如下表2所示。

表2 RT-qPCR 引物Table 2 Primers sequences used for RT-qPCR
1.3 数据统计处理
数据重复测定三次,取平均值,结果用平均值±标准差示,采用oneway ANOVA 进行统计分析,P<0.05 表示有显著差异。
2 结果与分析
2.1 海参皂苷HA 与EA 对小鼠生化指标的影响
由图2A 可知,相比对照组小鼠,模型组小鼠表现为血清尿酸含量显著升高(P<0.05)。与模型组比较,HA 组和EA 组均可显著降低(P<0.05)小鼠血清尿酸水平,HA 组降低了12.7%,EA 组降低了18.1%,其中EA 组降低血尿酸水平更为显著,而受试物组与对照组并无显著差异(P>0.05)。文献报道尿酸升高的同时肌酐及尿素氮水平也会升高[19−20]。由图2B可知,模型组小鼠与对照组小鼠血清肌酐水平并没有显著差异(P>0.05)。相比对照组小鼠,模型组小鼠尿素氮水平显著降低(P<0.05)(图2C)。模型组血清肌酐及尿素氮的结果与文献报道不一致[19−20],可能是由于小鼠品系来源并非绝对严格对照。db/db 小鼠是由C57/BL KsJ 小鼠近亲交配衍化而来,而对照小鼠选用的是C57/BL6小鼠。由图2C 可知,HA 和EA 可显著降低模型小鼠尿素氮水平(P<0.05),与相关研究结果一致[10−11]。

图2 海参皂苷HA 和EA 对血清尿酸、肌酐及尿素氮水平的影响(n=8)Fig.2 Effects of HA and EA on serum uric acid, creatinine and blood urea nitrogen in mice(n=8)
2.2 海参皂苷HA 与EA 对肝脏黄嘌呤氧化酶(XOD)和腺苷脱氨酶(ADA)活性的影响
酶活实验结果表明(图3),海参皂苷HA 与EA 干预2 周对db/db 肥胖小鼠肝脏黄嘌呤氧化酶和腺苷脱氨酶的活性均无显著影响(P>0.05),而众多研究证明XOD 和ADA 是尿酸合成过程的关键酶,抑制XOD 与ADA 的活性可以有效降低血清尿酸水平[21−22]。前期研究发现海参中的活性成分如海参多糖、海参皂苷均可以通过抑制XOD 及ADA活性降低高嘌呤饮食诱导的小鼠血尿酸水平[10−11]。

图3 海参皂苷HA 和EA 对肝脏XOD 和ADA 活性的影响(n=8)Fig.3 Effects of HA and EA on hepatic XOD and ADA activity in mice(n=8)
2.3 海参皂苷HA 与EA 对小鼠肾脏组织形态学的影响
2.3.1 小鼠肾脏组织光学显微镜观察结果 肾脏是尿酸排泄的重要场所之一,人体的2/3 尿酸经肾脏排出[23]。由图4 可知,在400 倍的光镜下,对照组正常小鼠肾小球边界清晰、肾小囊体积均匀(图4-A);模型组小鼠肾小球整体体积胀大,膜扩张,边界模糊,肾小囊体积明显变小,肾小球内的毛细血管膨胀,并与肾小囊粘连(图4-B),这与Kosugi 等[24]的研究结果相似;HA 组与EA 组的小鼠,肾小球体积均一、边界清晰,HA 组与EA 组肾小囊均一且毛细血管有所恢复(图4-C、4-D),相较模型组病理变化得到改善,与Strippoli 等[25]的研究中肾脏病理改善情况一致。
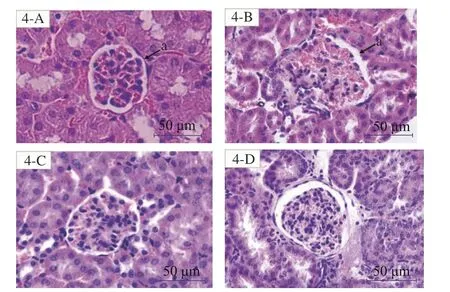
图4 HE 染色下小鼠肾脏切片光学显微镜观察(400×)Fig.4 Optical microscope of HE staining renal cortex(400×)
2.3.2 小鼠肾脏组织电镜观察结果 在10000 倍电镜下,观察小鼠肾小球结构,正常小鼠的肾小球基底膜厚度均匀,足突分布均匀(图5-A);模型组小鼠肾小球内皮细胞三层细微结构出现部分消失,足突出现了融合现象,孔窗结构模糊(图5-B)。海参皂苷HA 和EA 组对足突融合均有所改善,其中HA 组足突均匀分布,孔窗结构有所恢复,但足突融合情况仍存在(图5-C);EA 组孔窗结构恢复清晰,足突融合情况得到很大程度地改善(图5-D)。电镜观察结果表明肥胖小鼠的肾小球结构,在喂食海参皂苷HA 和EA 后,针对足突融合现象均有不同程度的改善,且EA 效果优于HA。
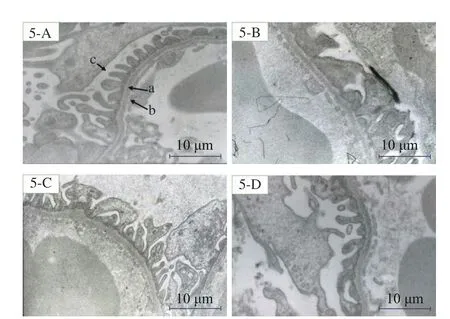
图5 小鼠肾小球电镜观察(10000×)Fig.5 Electron microscopic of glomerular in mice(10000×)
2.4 海参皂苷HA 和EA 对肾脏尿酸代谢相关转运体mRNA 表达的影响
2.4.1 海参皂苷HA 和EA 对葡萄糖转运蛋白GLUT9 mRNA 表达的影响 由图6 可知,与对照组比较,模型组小鼠肾脏GLUT9 mRNA 表达略有下降,但无显著性变化(P>0.05);与模型组比较,HA 与EA 均可显著上调小鼠肾脏GLUT9 mRNA 表达,且EA 组与HA组相比更为显著(P<0.05)。目前许多研究发现尿酸代谢与尿酸转运蛋白密切相关,尿酸转运相关蛋白包括尿酸重吸收相关蛋白与尿酸分泌相关蛋白[26]。其中葡萄糖转运蛋白(GLUT9)是主要的尿酸盐重吸收转运蛋白[27−28],分布在近端肾小管,对尿酸稳态有重要作用[29]。研究发现敲除GLUT9 基因的小鼠,体内尿酸水平明显升高[30]。此结果表明海参皂苷HA 和EA 在促进肾脏对尿酸的重吸收方面有显著作用,且EA 显著优于HA。

图6 海参皂苷HA 和EA 对肾脏GLUT9 mRNA 表达的影响(n=8)Fig.6 Effects of HA and EA on kidney GLUT9 mRNA level in mice(n=8)
2.4.2 海参皂苷HA 和EA 对有机阴离子转运体1(OAT1)mRNA 表达的影响 由图7 可知,模型组小鼠肾脏OAT1 mRNA 表达较对照组显著降低47.4%(P<0.05);干预海参皂苷HA 和EA 后,均可显著(P<0.05)上调模型小鼠肾脏OAT1 mRNA 表达,与模型组相比分别上调了20.1%和127.6%,表明EA 组在调节OAT1 mRNA 表达方面优于HA 组。OAT1 属于尿酸盐有机阴离子转运体(OAT)家族,是与尿酸分泌和排泄密切相关的转运体,负责转运有机阴离子[12,31]。有研究表明,高尿酸血症大鼠模型OAT1蛋白表达显著下降[32],与本文模型组小鼠结果一致。该结果表明HA 与EA 可以促进肾脏对尿酸的排泄,且EA 效果显著优于HA。

图7 海参皂苷HA 和EA 对肾脏OAT1 mRNA 表达的影响(n=8)Fig.7 Effects of HA and EA on kidney OAT1 mRNA level in mice(n=8)
2.4.3 海参皂苷HA 和EA 对有机阳离子转运体(OCTs)和肉碱/有机阳离子转运体(OCTNs)mRNA 表达的影响 由图8A、8B 可知,模型组小鼠相较对照组OCT1、OCT2 mRNA 表达均显著性下降(P<0.05),HA 和EA 均可显著上调模型小鼠肾脏OCT1、OCT2 mRNA 表达(P<0.05),其中HA 组与EA 组无显著性差异(P>0.05)。由图8C、8D 可知,与对照组相比,模型组小鼠OCTN1 与OCTN2 mRNA 并无显著差异(P>0.05),EA组可显著上调模型小鼠肾脏OCTN1与OCTN2 mRNA 表达量(P<0.05),而HA 对模型小鼠并无显著上调作用(P>0.05)。有机阳离子转运体(OCT)家族与肉碱/有机阳离子转运体(OCTN)家族也是影响尿酸代谢的一个重要因素。研究表明,慢性肾功能衰竭的大鼠体内OCT2 及OCTN2 转运蛋白表达量下降,从而引起肾脏有机阳离子重吸收和分泌受损[33−34]。EA 可同时上调OCTs 及OCTNs mRNA的表达,而HA 仅显著上调OCTs 的mRNA 表达,表明EA 可以通过调控OCT 尿酸盐有机阳离子转运体及OCTN 肉碱/有机阳离子转运体调节尿酸代谢。

图8 海参皂苷HA 和EA 对肾脏OCTs 和OCTNs mRNA 表达的影响(n=8)Fig.8 Effects of HA and EA on kidney OCTs and OCTNs mRNA levels in mice(n=8)
3 结论
本研究对海参皂苷单体HA 与EA 在体内调节尿酸代谢的构效关系进行了较为系统的评价。补充海参皂苷HA 与EA 后,db/db 肥胖小鼠血尿酸水平分别降低12.7%和18.1%;肾脏肾小球组织结构病理学变化有了明显改善;海参皂苷对肥胖小鼠肝脏中XOD 及ADA 酶活无显著影响(P>0.05),但显著上调肾脏尿酸代谢相关转运体的mRNA 表达水平(P<0.05)。海参皂苷单体HA 与EA 可能通过同时调控尿酸代谢重吸收转运体GLUT9 与分泌相关转运体OAT1、OCTs、OCTNs 等改善肥胖小鼠尿酸代谢异常,并显著改善肾脏组织结构病理学变化,其中EA 改善效果优于HA。由于本研究选用db/db 肥胖小鼠,其具有严重的糖尿病症状,高血糖可以通过影响肾脏的微循环来间接影响肾功能。因此,海参皂苷直接影响尿酸代谢,还是通过影响糖代谢进而改善尿酸代谢,需进一步开展实验加以验证。本研究成果将为膳食海参皂苷预防尿酸代谢异常提供理论依据。
