酒糟粗提物对肝癌细胞HepG2 增殖的抑制作用
2021-11-23王若帆谢梦忆李敬东
王若帆,侯 茂,谢梦忆,游 川,李敬东,*
(1.川北医学院附属医院肝胆外科,四川南充 637200;2.川北医学院肝胆胰肠疾病研究所,四川南充 637200;3.宜宾学院固态发酵资源利用四川省重点实验室,四川宜宾 644000)
除中草药外,传统发酵食品正在成为一些生理活性物质的重要来源[1],特别是一些采用自然混菌固态发酵方式加工的食品[2]。以浓香型白酒为例,其实质为窖池连续发酵容器,在涵养了大量微生物的发酵糟醅中不断补充新原料、新微生物(粮食、大曲),取出发酵产物(白酒)的混菌固态连续培养体系,经多轮次生产,这一独特的连续培养体系(酒糟)中汇集了多种复杂代谢产物[3−6]。其中容易挥发的微生物代谢产物倾向于通过蒸馏进入馏出液(白酒)中,难挥发的多肽、多糖等活性成分则更容易残留在酒糟中,这些物质可能具有一定的生理活性。
近年来由于人们饮食结构的变化,肝脏承受了远超过去的解毒压力,肝癌(Hepatocellular carcinoma,HCC)已成为导致死亡的第二大癌症[7],具有保肝护肝作用的保健食品开发一直是功能食品领域的研究热点,现有研究主要通过这些天然产物对肝癌细胞的抑制作用来评价其护肝效果。人肝癌细胞HepG2 细胞易于培养,是肝癌研究中使用最广泛的细胞系,此类研究多集中于天然产物对HepG2 细胞增殖的抑制作用、对HepG2 细胞生长过程中关键蛋白表达的影响及细胞凋亡的影响等方面,但同时开展上述研究的报道较少。
近年来的研究发现多种食源性天然产物具有护肝作用[8],包括蓝莓、怀槐、猕猴桃、金银花、松花粉、葛根、余甘子、小麦胚芽等,一些植物经发酵后还会产生新的护肝活性成分[9]。对食品而言,当前的研究主要是在揭示护肝活性成分及药理的基础上,发现一些新的护肝原料,并提取其活性成分或直接以原料配伍,开发风味及护肝效果均较好的护肝食品。酒糟作为谷物发酵产物,其毒副作用相对较低[10],具有作为保健食品原料的潜力,但迄今为止对固态发酵的粮食酒糟中活性成分的研究还很少。本研究在初步测定酒糟粗提物的成分的基础上,探究其对肝癌HepG2细胞的抑制作用及其相关机制,不仅可为各白酒产区酒糟资源的深度开发提供参考,减少生产旺季因酒糟积压而造成的环境压力,也可为护肝功能食品的开发提供一些新的思路,提高白酒产业副产物酒糟的综合利用价值。
1 材料与方法
1.1 材料与仪器
HepG2 细胞 由美国爱因斯坦医学院惠赠;酒糟粗提物 提取自五粮液股份有限公司提供的出窖糟;DMEM 高糖培养基(生化试剂) Thermo Scientific;胎牛血清、0.25%胰酶(2500 U/mL)、链霉素/青霉素双抗液(生化试剂) Gibco;DMSO、BCA 蛋白浓度测定试剂盒(生化试剂) 碧云天;逆转录试剂盒、TRIZOL、SYBR-GREEN(生化试剂)Takara;所有抗体(生化试剂) CST;PCR 96 孔板Roche;10 cm 及4 cm 培养皿 康宁公司;RTCA 增殖板 艾森生物公司;所用引物(生化试剂) 上海生工,见表1。

表1 引物序列Table 1 Primer sequence
6530Accurate-Mass Q-TOF 液相色谱-质谱联用仪 Agilent;xCElligence RTCA DP 实时无标记细胞分析仪、 NovoCyte 流式细胞仪 ACEA;NanoDrop One 微量分光光度计、GeneAmp 9700 PCR 仪 Thermo Scientific;LightCycler96 实时荧光定量PCR 仪 Roche;Fusion Solo 化学发光成像仪VILBER。
1.2 实验方法
1.2.1 酒糟粗提物的制备及活性成分测定 100 g 出甑酒糟加入95%乙醇1200 mL,75 ℃回流提取2 h后,75 ℃、200 mbar 旋蒸浓缩至100 mL,取10 mL经0.22 μm 微孔滤膜过滤,分装入2 mL 样品瓶,采用液质联用色谱仪检测其组分,其余继续浓缩至近干,取出,50 ℃烘干至恒重。
色谱条件[11]:hermo-C18柱(2.1 mm×50 mm,1.8 μm),流动相为0.1 %甲酸溶液(A)和甲醇(B),流速0.2 mL/min,进样量5 μL,ESI 离子源扫描范围50~1000 m/z,干燥温度350 ℃,干燥气流速8.0 L/min,喷雾压力40 psig。采用面积归一化法进行相对定量,采用Agilent 公司TCM 数据库检索对离子进行定性。
1.2.2 样品溶液的制备 将酒糟粗提物称重0.2 g,并将其溶于1 mL DMSO 溶液中混匀,再用DMEM培养基加至40 mL,配成浓度为5 mg/mL 的酒糟粗提物样品溶液。在超净工作台里,用0.22 μm 滤器过滤后放4 ℃冰箱保存并取少量进行无菌测试。
1.2.3 细胞培养 将HepG2 细胞从液氮中取出置于10 mL 离心管中,37 ℃恒温水浴锅中融化复苏,与6 mL DMEM 培养基(1% 双抗液和10% 胎牛血清)混匀后,以1200 r/min 常温离心5 min,丢弃上清液,加入6 mL DMEM 培养基,轻吹制成细胞悬液后将其转移至10 cm 培养皿中,放在恒温孵箱(37 ℃、5% CO2)中培养1~2 d,待细胞铺满培养皿表面积的90%以上进行传代。加入300 μL 浓度为0.25%、酶活为10000 U/mL 的胰酶消化离心获得细胞混悬液,将细胞接分盘接种到2~3 个培养皿中,完成传代培养。
1.2.4 酒糟粗提物对细胞增殖的影响 首先将加入60 μL/孔完全培养基的16 孔增殖板放入实时细胞分析仪(RTCA)中测量基线,再将HepG2 细胞以6000 个/孔接种到16 孔增殖板中,放入孵箱培养至细胞进入对数生长期后,在每孔中加入不同浓度的酒糟粗提物并设置无药物的对照组,再次将加完药物的16 孔板放回孵箱中,设定程序每10 min 进行一次阻抗值读数,48 h 后获得完整的细胞生长曲线[12],实验重复3 次。
1.2.5 酒糟粗提物对细胞周期及细胞凋亡的影响细胞周期实验:取2 mL 密度为1.5×105个/mL 的HepG2 接种到6 孔板中,使用不同浓度的酒糟粗提物分别刺激肝癌HepG2 细胞24 h,再收集细胞于流式管中,加入4 mL PBS 清洗细胞两次,离心弃上清液,逐滴加入预冷的75%乙醇,4 ℃避光过夜后离心弃上清液,先后用PBS 和染液清洗细胞,除去乙醇,最后将PI/RNase 染液0.5 mL 重悬清洗后的细胞,室温孵育15 min 后上流式细胞仪检测[13]。
细胞凋亡实验:使用预冷的PBS 溶液清洗不同浓度酒糟粗提物处理后的HepG2 细胞2 次,再将不含EDTA 的胰酶500 mL 滴入培养皿,37 ℃消化细胞90 s 并转移至离心管中,室温1500 r/min 离心5 min,再用预冷的PBS 洗涤细胞1 次,用400 μL 1×Binding Buffer 重悬细胞,再加5 μL Annexin VFITC 混匀后避光室温孵育15 min,上机前5 min 再加5 μL PI 染色,并在上机前补加200 μL 1×Binding Buffer[14],上述实验重复3 次。
1.2.6 酒糟粗提物对HepG2 细胞CyclinA、CDK2、Bax、Bcl-2 基因表达的影响 采用TRIZOL 法提取使用不同浓度的酒糟粗提物分别刺激肝癌HepG2细胞24 h 的细胞总RNA,测定RNA 纯度及浓度,逆转录试剂盒进一步合成20 μL 体系的cDNA,采用TRIZOL 法 PCR Master Mix 10 μL、上下引物各0.5 μL、ddH2O 7 μL 以及cDNA 2 μL 构成20 μL 的反应体系,为减少误差,每个样本设置三个复孔。将96 孔板放入PCR 仪进行反应:95 ℃预变性2 min,三步扩增共39 个循环(95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸30 s),95 ℃溶解10 s、65 ℃退火60 s、97 ℃解链1 s,37 ℃冷却30 s[15]。引物表见表1,实验重复3 次。
1.2.7 酒糟粗提物对HepG2 细胞凋亡标志蛋白表达的影响 使用PBS 清洗3 次不同浓度酒糟粗提物刺激24 h 后的细胞,收集并转移至1.5 mL 的离心管中,加入300 μL RIPA 裂解液,充分混匀,放置在水平摇床上冰浴反应30 min(适时加入蛋白酶抑制剂PMSF)。上述蛋白液与BCA 试剂盒中的适量A、B 液混匀,放入酶标仪中测量并计算浓度确定上样量后,另取上述蛋白液加入1/4 蛋白液体积的5×蛋白上样缓冲液,水浴煮沸10 min 后采用SDS-PAGE 凝胶电泳分离蛋白,PVDF 转膜2 h,后用含5%脱脂奶粉的TBST 室温封闭PVDF 膜大于1 h,TBST 洗膜3 次(每次10 min),PVDF 膜孵育一抗过夜,清洗后加入二抗孵育2 h,最后向PVDF 膜滴加ECL 超敏发光液A、B 各300 μL 进行显影,使用软件Image J 进行灰度分析[16],实验重复3 次。
1.3 数据处理
用SPSS Statistics 22.0 统计软件进行分析。数据均采用均数±标准差(±S)表示,多组间比较采用方差分析,组间两两比较采用最小显著性差异法(LSD 法),P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 LC-MS 检测酒糟粗提物的组成成分
酒糟粗提物中含有43 种物质,由表2 可知,其中包括多种曾被报道具有护肝作用的活性物质或其结构类似物,如相对含量最高(4.670%)的氟代木犀草素,其结构类似物木犀草素对5-氟尿嘧啶抗肝癌具有增敏作用[17],相对含量为0.207%的环小叶黄杨碱,其结构类似物黄杨碱可调节肝癌周期[18]。小檗红碱具有多种抗癌活性[19],雷藤三萜内酯A、呋喃甲酰胺、异叶乌头碱、榛仁球蛋白、植醇、异叶乌头碱、加拿大麻醇甙、ζ-胡萝卜素等8 种成分也体现出抗肝癌或其他癌细胞的作用[20−24]。
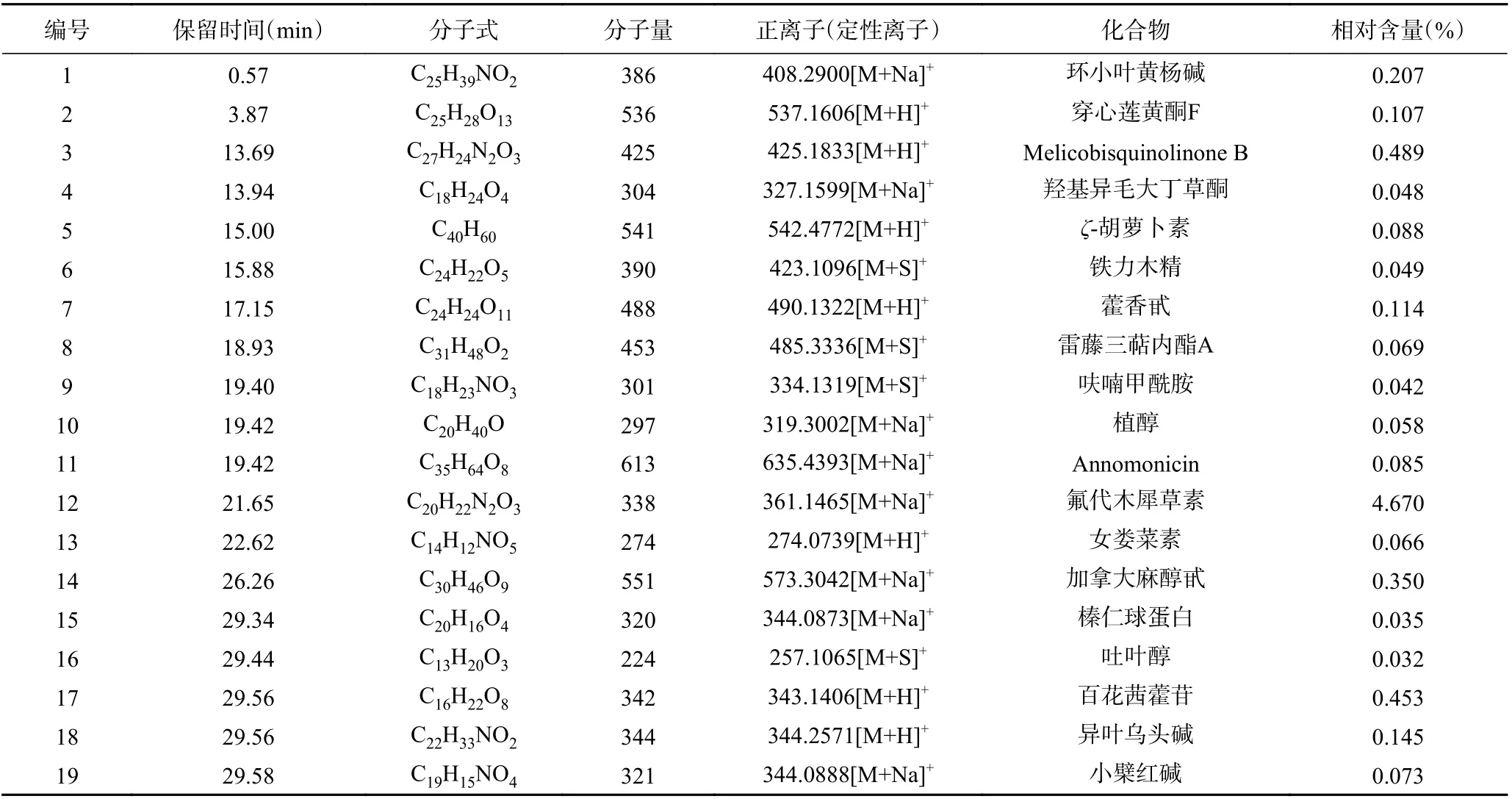
表2 酒糟粗提物的主要活性成分Table 2 Components of abstract from distillers' grains
2.2 酒糟粗提物对HepG2 细胞增殖的抑制作用
不同浓度的酒糟粗提物处理HepG2 细胞后2 d 内每10 min 连续读取HepG2 细胞的NCI 值(Normalized Cell Index),结果见图1。从添加酒糟提取物后12、24、36 及48 h 的不同浓度的NCI 值可以看出,随着作用时间的增加,24 h 后酒糟提取物抑制HepG2 细胞生长的作用开始显现,这与多种中药提取物的作用时间接近[25]。24 h 后,酒糟提取物对HepG2 细胞增殖的抑制作用与酒糟提取物浓度有关,与0 μg/mL 相比,酒糟粗提物在浓度20 μg/mL时对HepG2 细胞NCI 值影响不大,但从浓度60 μg/mL 开始能够显著降低NCI 值(即抑制HepG2细胞的增殖)(P<0.05),差异有统计学意义。根据RTCA 2.1 软件计算得到酒糟粗提物在12 h 的IC50=110 μg/mL。
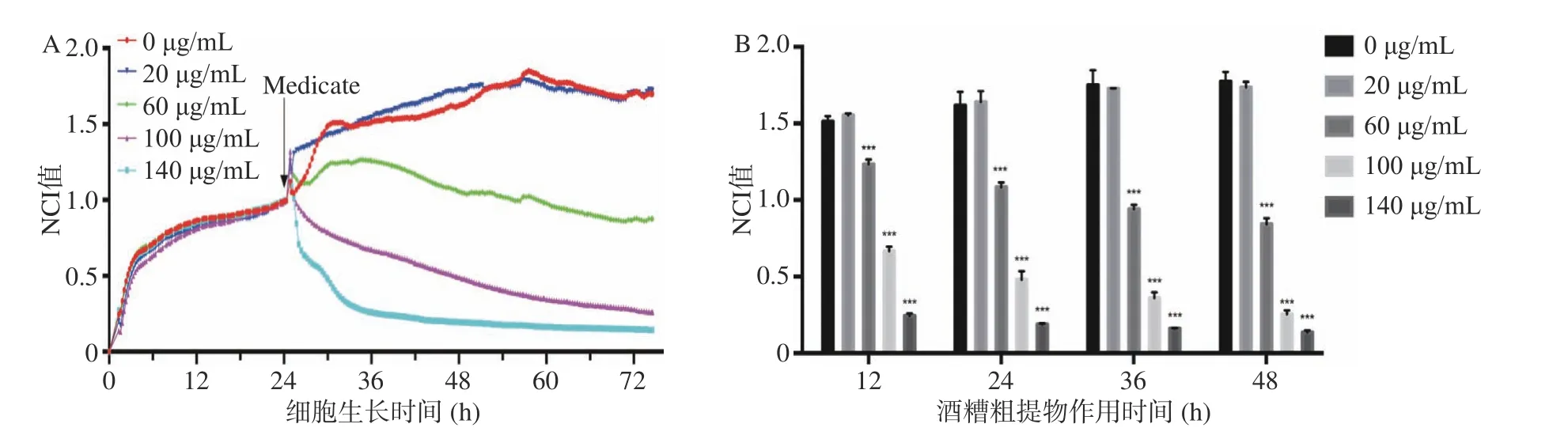
图1 酒糟粗提物对HepG2 细胞增殖的抑制作用Fig.1 Inhibition on proliferation of HepG2 cells of crude extraction from distillers' grains
2.3 酒糟粗提物对HepG2 细胞周期的影响
流式细胞仪细胞周期分析显示,HepG2 细胞在S 期的比例明显高于对照组(P<0.05),推测酒糟提取物可能导致HepG2 细胞阻滞在S 期,当酒糟粗提物的浓度升高S 期占比逐渐升高,见图2A。Real-time PCR 结果表明,添加浓度为78.9 μg/mL 和98.0 μg/mL的酒糟粗提物后,Cyclin A 和CDK2 蛋白的mRNA表达量显著低于对照(P<0.05),见图2B、C,可能是由于酒糟提取物抑制了Cyclin A 及CDK2 的生成,Western-Blot 证实,S 期的周期蛋白CyclinA 及其激酶CDK2 表达量显著低于对照(P<0.05),见图2D、E、F,表明酒糟粗提物使HepG2 细胞周期被阻滞在S 期的机制主要在于DNA 合成期相关的周期蛋白CyclinA 及其激酶CDK2 的mRNA 和蛋白的表达量随酒糟粗提物浓度的增加而降低,使肝癌HepG2细胞不能通过S 期的检查点,无法进入G2/M 期,从而抑制了其增殖[26−29]。
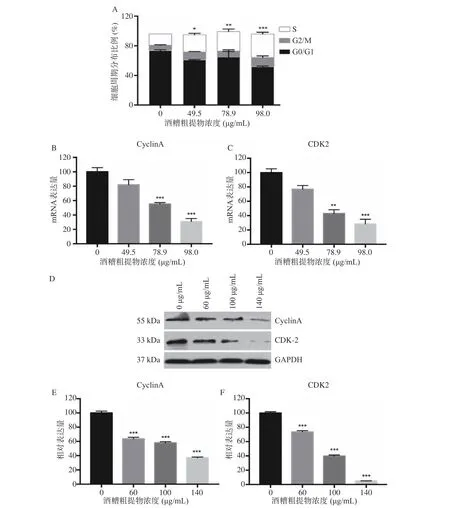
图2 酒糟粗提物对HepG2 细胞周期的影响Fig.2 Effects of crude extraction from distillers' grains on HepG2 cell cycle
2.4 酒糟粗提物对HepG2 细胞凋亡的影响
流式细胞仪检测HepG2 细胞的凋亡情况,结果显示药物处理组的细胞凋亡要显著多于对照组0 μg/mL 且与酒糟粗提物的浓度成正相关(P<0.05),见图3A。Real-time PCR 结果表明,与对照组0 μg/mL相比,随着酒糟粗提物浓度的增加,Bcl-2 的mRNA表达量逐渐降低,49.5、78.9 和98.0 μg/mL 这3 组有统计学意义(P<0.01),而Bax的mRNA 表达量逐渐升高,78.9 和98.0 μg/mL 这两组有统计学意义(P<0.01),见图3B、C。Western Blot 进一步验证表明,酒糟粗提物刺激后的肝癌HepG2 细胞的Bcl-2 的表达量随浓度升高而显著降低,Bax 的表达量随浓度升高而显著升高(P<0.001),见图3D。这表明酒糟提取物诱导HepG2 细胞凋亡与细胞内决定细胞凋亡敏感性起重要作用的Bcl-2 与Bax[30−31]相对表达量有关,其诱导HepG2 细胞凋亡的主要机制在于通过调节Bcl-2 和Bax 的相对表达量,从而诱导HepG2 细胞发生凋亡,该机制类似于5-FU、顺铂、喜树碱等[32]抗癌药物。
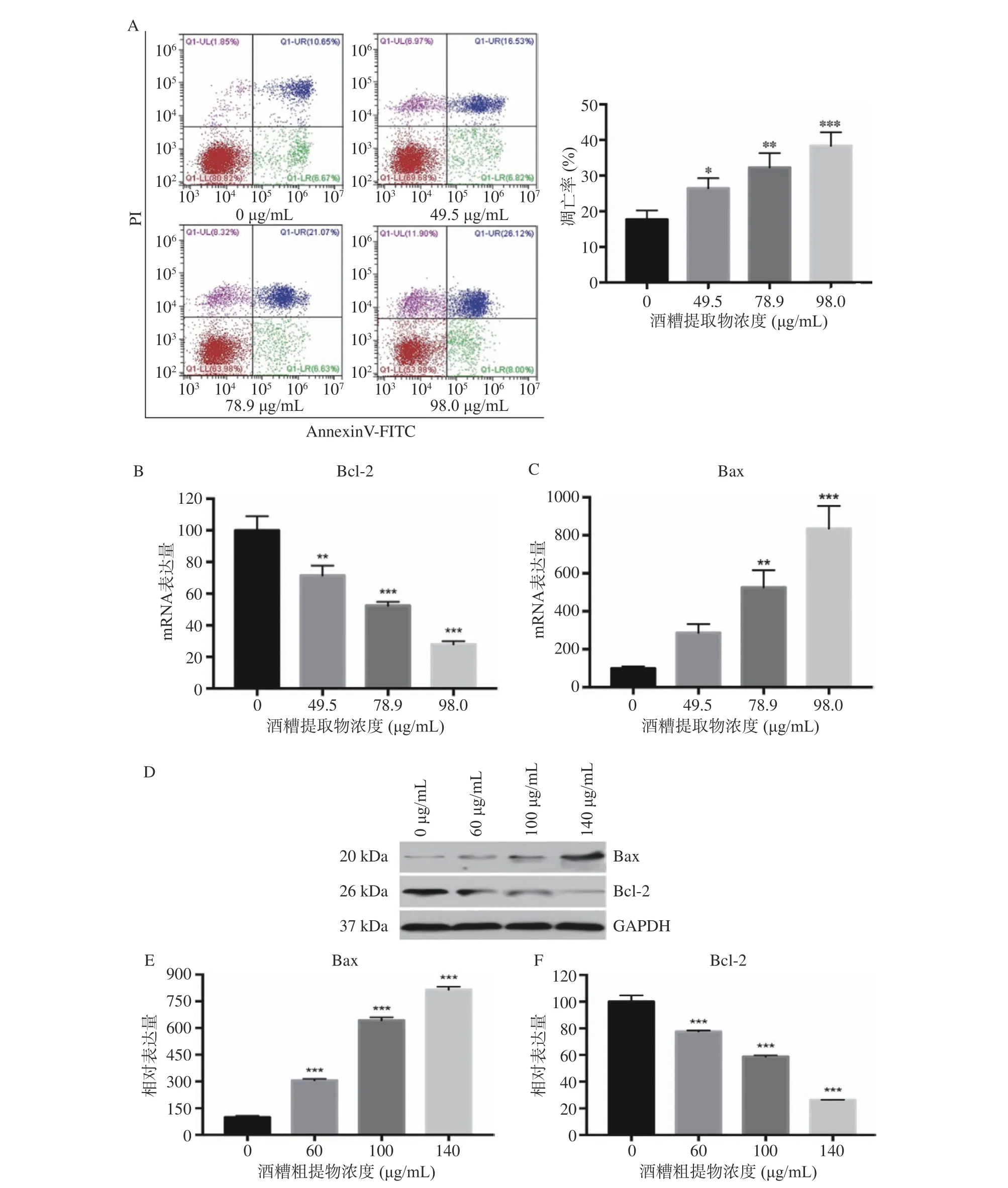
图3 酒糟粗提物对HepG2 细胞凋亡的影响Fig.3 Effects of crude extraction from distillers' grains on apoptosis of HepG2 cells
2.5 酒糟粗提物对介导凋亡的线粒体通路的影响
Western Blot 检测表明,经药物刺激后的肝癌HepG2 细胞,CYTC、Cleaved-Caspase-9 及Cleaved-Caspase-3 的表达量显著升高(P<0.05),Caspase-9 及Caspase-3 的表达量显著降低(P<0.05),见图4,这表明在Bcl-2、Bax 介导凋亡的三条通路(线粒体通路、内质网通路和死亡受体通路)中,酒糟粗提物促进肝癌HepG2 细胞发生凋亡可能和凋亡的线粒体途径被激活相关。
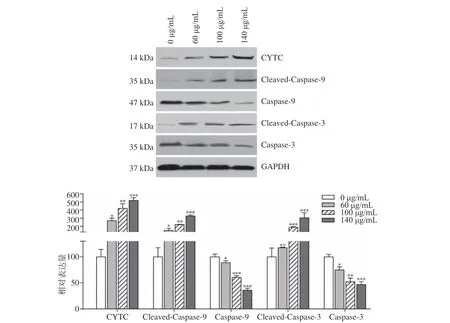
图4 酒糟粗提物对凋亡相关蛋白的影响Fig.4 Effects of crude extraction from distillers' grains on the protein levels of apoptosis-related proteins
3 讨论与结论
本研究主要针对酒糟中的生理活性物质开展研究,采用中药数据库从浓香型白酒糟中鉴定出氟代木犀草素、环小叶黄杨碱、榛仁球蛋白、植醇、异叶乌头碱、加拿大麻醇甙、ζ-胡萝卜素、吐叶醇、小檗红碱等多种具有抗癌活性的成分。体外实验表明,酒糟粗提物可抑制HepG2 细胞的增殖,并通过激活介导凋亡的线粒体通路诱导肝癌HepG2 细胞发生凋亡。
与来源于药物或昂贵天然产物不同,酒糟提取物来源于粮食发酵后的副产物,具有廉价、无害的属性,这不仅为绿色保健食品的开发提出了新的思路,也在酒糟现有利用途径(饲料、肥料、燃料等)的基础上,为酒糟资源的深度综合开发提供了新的视角。但与活性成分含量相对较高的中药相比,酒糟活性成分的提取还存在活性成分浓度相对较低、杂质干扰等问题,后续将进一步优化提取纯化方法,同时采用代谢组学方法进一步分离酒糟粗提物,聚焦其中的抗癌活性成分,解析其分子结构,为相关抗癌药物的研发提供新的思路。
