海藻酸钠裂解酶高产菌株的筛选、鉴定及产酶条件的优化
2021-11-23王巧贞潘信利黄媛林李翠梅黄庶识
王巧贞,潘信利,杨 玲,李 菲,李 喆,黄媛林,李翠梅,黄庶识,*
(1.广西科学院,广西海洋天然产物与组合生物合成化学重点实验室,广西南宁 530007;2.广西师范大学物理科学与技术学院,广西桂林 541004)
褐藻胶是巨藻、墨角藻、马尾藻和海带等褐藻细胞壁和细胞间质中的一类水溶性酸性多糖物质,也是褐藻中含量最多的多糖,其在地球上的含量仅次于纤维素,可作为潜在的生物质能源原料。然而褐藻胶高粘、高凝胶、不易降解、难以被机体吸收利用的特点,限制了它的应用[1],褐藻胶的降解产物海藻酸寡糖在抗肿瘤、抗凝血、抗菌、抗病毒、增强宿主免疫力、抗氧化、神经保护、肠道消化吸收、植物的生长及保鲜等方面有良好的生物活性,被广泛应用于食品、医疗及农业等领域[2−5]。传统制备褐藻胶寡糖的方法主要有物理降解法、化学降解法和生物酶解法[6]等,其中生物酶解法因其专一性高、反应条件温和、易控制、目标产物得率高等优点而备受关注。
褐藻胶裂解酶通过β-消除反应将褐藻胶降解为一系列不饱和的海藻酸寡糖,根据底物专一性不同将褐藻胶裂解酶分为三类:转移性裂解1,4-α-D-甘露糖醛酸片段的裂解酶(Aly;EC4.2.2.3),专一性裂解1,4-α-L-古罗糖醛酸片段的裂解酶(Aly;EC4.2.2.11)以及两种片段都可裂解的双功能裂解酶[7]。褐藻胶裂解酶来源广泛,主要来源包括藻类、动物内脏和微生物等,其中海洋微生物是褐藻胶裂解酶的重要来源之一,目前的研究表明来自于海洋动物的微生物产生的裂解海藻酸钠的酶多数为复合酶,很难分离纯化,如假交替单胞菌Pseudoalteromonas elyakoviiIAM 14954 至少能产生五种不同的海藻酸钠裂解酶,其中一个是胞外酶,四个是胞内酶[8]。现有大部分微生物来源的褐藻胶裂解酶依然存在着酶活力较低、作用位点单一等缺陷,造成酶解法制备海藻提取物的成本过高,且没有统一的发酵工程菌及系统发酵条件,褐藻胶裂解酶稳定性差,达不到工业发酵生产要求[9],发展受限。不同来源的海藻酸钠降解酶所获得的产物聚合度也会有所不同,进而对寡糖的生物活性产生影响。从不同的途径寻找和生产具有高活性的海藻酸钠裂解酶已成为研究焦点[10]。筛选高效降解褐藻胶菌株是开发褐藻资源的重要新途径,目前鲜少有报道在50 g/L 高浓度海藻酸钠培养基中仍保持酶活力较强的菌株,近年来多数报道的降解菌直接利用褐藻胶的浓度低于50 g/L[11−13]。
本研究从北海涠洲岛采集的马尾藻中筛选得到一株褐藻胶降解菌Vibrio ganglieiM0101,该菌株对海藻酸钠具备很强的水解能力,通过对菌株M0101 的产酶条件进行优化,为后期该菌株在生产上的应用提供依据。
1 材料与方法
1.1 材料与仪器
菌株 筛选自广西北海涠洲岛(109°08′00″E,21°01′00″N)的马尾藻;海藻酸钠培养基:(NH4)2SO45 g/L,K2HPO41 g/L,NaCl 15 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 0.01 g/L,海藻酸钠6 g/L,pH7.5;(NH4)2SO4分析纯,广东光华科技股份有限公司;K2HPO4分析纯,天津市大茂化学试剂厂;NaCl分析纯,成都金山化学试剂有限公司;MgSO4·7H2O
分析纯,天津博迪化工股份有限公司;3, 5-二硝基水杨酸 化学纯,成都市科龙化工试剂厂;FeSO4·7H2O 分析纯,国药集团化学试剂有限公司;海藻酸钠 分析纯,阿拉丁;H2SO4分析纯,廉江市廉化试剂有限公司。
HH-2 数显恒温水浴锅 国华电器有限公司;TU-1901 双光束紫外可见光分光光度计 北京普析通用仪器有限责任公司;TS-200B 恒温摇床 上海天呈实验仪器制造有限公司;LHS-250SC 恒温恒湿培养箱 上海天呈实验仪器制造有限公司;Tprofessional PCR 仪 德国biometra;1-14K 小型高速冷冻台式离心机 德国Sigma;Sherolock 全自动细菌鉴定系统 美国MIDI(Microbial Identification)公司;HP6890 气相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 海藻酸钠降解菌的分离 称取0.2 g 马尾藻,置于1.5 mL 的无菌离心管中,加入0.8 mL 无菌水,用电动研磨棒研磨成匀浆液,取匀浆液进行10 倍梯度稀释,取0.1 mL 稀释液涂布于分离培养基上,将平板倒置于30 ℃的培养箱中培养2~5 d,挑取生长好、形态和颜色不同的菌落进行纯化培养,直至获得纯培养物。
1.2.2 产酶菌株的筛选 挑取单菌落点接于海藻酸钠培养基上,30 ℃培养3 d,以10%(w/v)氯代十六烷基吡啶覆盖平板染色(chlorhexadecyl pyridine,CPC)15 min,将显示水解圈的菌株进行褐藻胶裂解酶相对酶活力测定。
1.2.3 菌种鉴定
1.2.3.1 生理生化特征检测 在平板上挑取单菌落至液体分离培养基中,30 ℃,200 r/min 培养 24 h,将菌液用无菌生理盐水稀释到适当浓度,取 100 μL 涂布于初筛培养基中,30 ℃下倒置培养3 d,观察菌株形态,形态鉴定参照《常见细菌系统鉴定手册》[14],将菌体送至中国科学院微生物研究所,由其完成生理生化特征检测和细胞脂肪酸组成测定。
1.2.3.2 细胞脂肪酸组成测定 使用Sherolock 全自动细菌鉴定系统进行菌体脂肪酸成分分析,采用HP6890 气相色谱仪进行色谱分析,配备分流/不分流进样口,氢火焰离子检测器(FID)及HP 气相色谱化学工作站(HP CHEMSTATION ver A 5.05);色谱柱为UItra-2 柱,长25 m,内径0.2 mm,滤膜厚度0.33 μm;炉温为二阶程序升温:起始温度170 ℃,每分钟5 ℃升至260 ℃,随后以40 ℃/min 升至310 ℃,维持1.5 min;进样口温度250 ℃,载气为氢气,流速0.5 mL/min,分流进样模式,分流比100:1,进样量2 μL;检测器温度300 ℃,氢气流速30 mL/min,空气流速216 mL/min,补充气(氮气)流速30 mL/min。
1.2.3.3 分子生物学鉴定 菌株DNA 的提取采用Chelex-100 法,用无菌牙签挑取少量菌体于1.5 mL的离心管中,加入50 μL 10% 的Chelex-100 溶液,振荡混匀,于100 ℃加热10 min,冷却至室温后,12000 r/min 离心10 min,上清液即可用于后续的DNA 扩增。采用 16S rRNA 通用引物 27F(5' GAG TTTGATCCTGGCTCAG 3')、1492R(5'GGTTACCTT GTTACGACTT 3')进行 PCR 扩增,扩增产物送至上海生工进行测序,测序结果在NCBI(National Center for Biotechnology Information)核苷酸数据库上进行BLAST 分析,选取同源性高的 16S rRNA 序列,采用MEGA7.0(邻接法,Neighbor-Joining)构建菌株系统发育树。
1.2.4 菌株产酶活力测定 待测菌株用海藻酸钠液体培养基活化24 h 作为种子培养液,按接种量3%(v/v)接种于装液量为50 mL 的150 mL 三角瓶中,置于摇床上,30 ℃,200 r/min 发酵培养48 h 后,取发酵液于4 ℃,12000 r/min 离心5 min,上清作为粗酶液进行产酶活力测定。采用 3,5-二硝基水杨酸法(DNS)进行海藻酸钠裂解酶活力测定[15],方法略有改动。取100 μL 发酵上清液和900 μL10 g/L 褐藻酸钠溶液(pH7.5 的PBS 配制)混合,在30 ℃下水浴30 min 后,加入0.5 mL DNS 缓冲液沸水浴5 min 终止反应,对照组不水浴直接添加0.5 mL DNS 试剂后沸水浴 5 min,冷却后定容至5 mL,测定OD540nm。
酶活力单位(U/mL)定义为: 在 30 ℃ 条件下,每分钟催化底物产生 1 μg 还原糖(以葡萄糖计)需要的酶量为一个酶活力单位。
相对酶活力测定: 将试验组的最高酶活力定义为 100%,将其他条件下的酶活力与最高酶活力的比值定义为相对酶活力。
1.2.5 产酶条件优化 以海藻酸钠培养基(如1.1 所列)进行产酶条件的优化,在(NH4)2SO4浓度为5 g/L,NaCl 浓度为 15 g/L,初始pH 为7.5,培养温度为30 ℃,转速为 200 r/min 的条件下考察海藻酸钠浓度(18、20、22、24、26、28、32、40、50 g/L)对菌株产酶能力的影响;并依次考察氮源浓度(0.5、1、2、3、4、5、6、7、8 g/L);温度(25、30、35、40、45 ℃)、转速(100、150、200、250、300 r/min)、初始pH(5.5、6.0、6.5、7.0、7.5、8.0、8.5、9、9.5、10.0)及NaCl 浓度(0、20、30、40、60、80、100、120、140、160 g/L)对菌株产酶能力的影响,以确定一个因素的最适条件为基准,依次对其余因素进行优化,确定菌株的产酶优化方案。
1.2.6 菌株生物量的测定 生物量通过OD600的大小来反映,以8 g/L 的海藻酸钠液体培养基为空白对照,按一定倍数稀释菌液,应用TU-1901 双光束紫外可见光分光光度计进行OD600值测定。
1.3 数据处理
运用软件Origin8.5 对数据进行处理、统计和绘图。所有实验均重复三次。
2 结果与分析
2.1 产酶菌株的筛选与鉴定
在以褐藻胶为唯一碳源的培养基上进行初筛,经10%(w/v)氯代十六烷基吡啶(Chlorhexadecyl pyridine,CPC)染色后,获得6 株产酶菌株。将获得的6 株产酶菌株进行液体发酵培养,测定其相对酶活力,发现菌株M0101 的相对酶活力最高(结果见图1、图2),后续将进一步对M0101 的产酶条件进行优化。
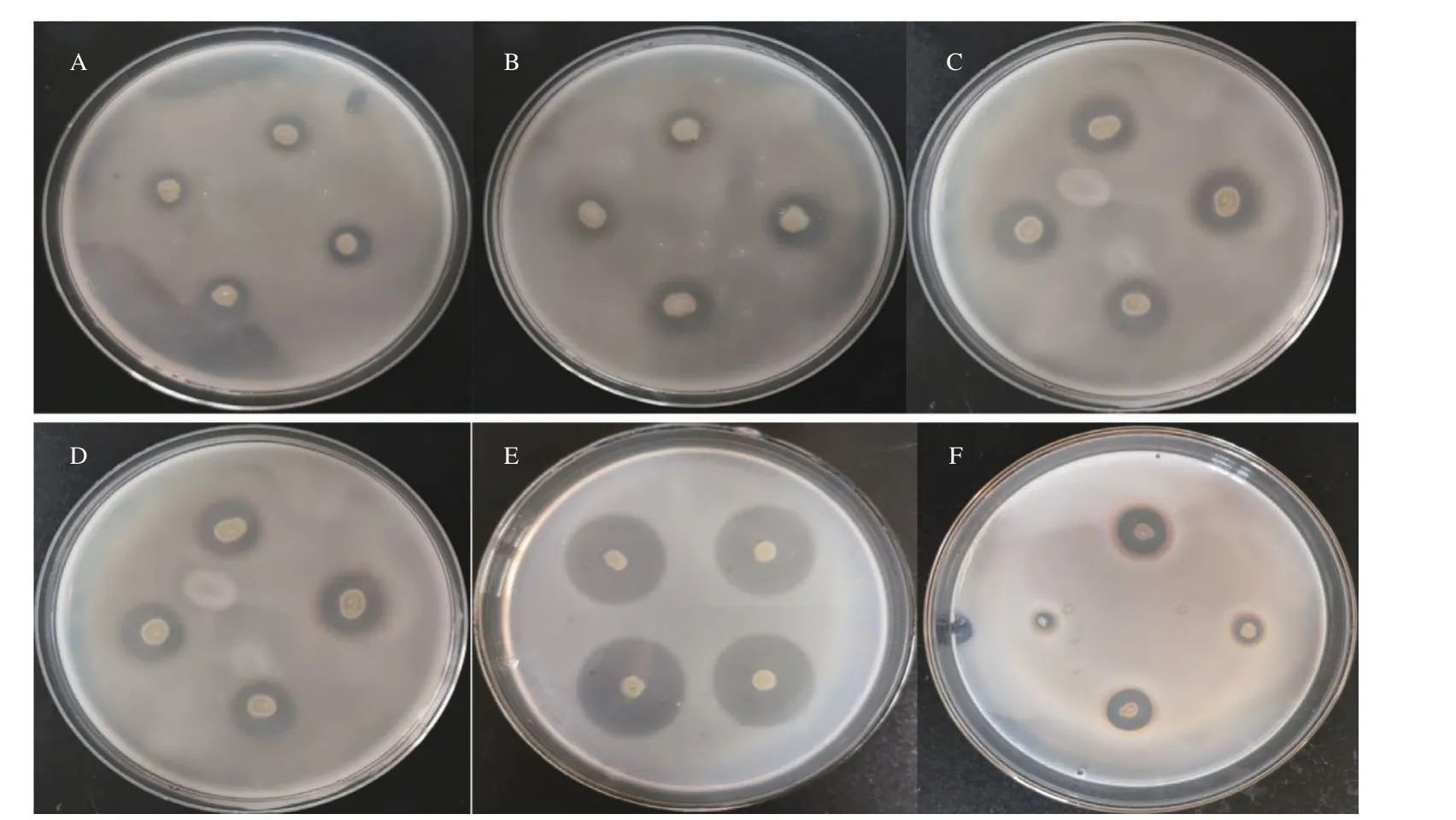
图1 不同产海藻酸钠裂解酶菌株CPC(chlorhexadecyl pyridine)染色结果Fig.1 CPC straining of different alginate lyases-producing bacterial strains

图2 不同产海藻酸钠裂解酶菌株相对酶活力Fig.2 Relative enzyme activity of different alginate lyases-producing bacterial strains
菌株M0101 在筛选培养基上30 ℃培养3 d,菌落呈圆形,边缘整齐,淡黄色,表面光滑(图3)。该菌株在葡萄糖、甘露醇、甘露糖、甘油、乙酰氨基葡糖、麦芽糖中均可生长,其基因组DNA 的G+C 含量为41.1mol%,与弧菌属中相关菌种的生理生化特性的比较见表1。M0101 中主要脂肪酸成分及含量为C12:0(9.38%), C14:0(4.24%), C16:0(15.61%), C18:1ω7c(14.69%), C18:1ω9c(1.95%), C14:03OH/C16:1iso 1(9.09%), C16:1w7c/C16:1w6c(45.06%),与弧菌属相关菌种的脂肪酸成分比较如表2 所示,经中国科学院微生物研究所检测鉴定,菌株M0101 为弧菌Vibriosp.。

表1 菌株的生理生化特征Table 1 Physiological and biochemical characteristics of strains

表2 不同菌株脂肪酸组成(%)Table 2 Fatty acids composition of different strains (%)
图3 M0101 菌落形态Fig.3 Colonial morphology of strain M0101
对菌株的16S rDNA 进行PCR 扩增,产物经测序后,经同源性比对发现菌株M0101 与Vibrio ganglieiSZDIS-1 序列的相似性达100%,该菌株与其近源菌株16S rDNA 序列构建的系统发育树见图4,结合形态与生理生化特征分析,该菌株与弧菌Vibrio ganglieiSZDIS-1 相似性很高,将其命名为Vibrio ganglieiM0101。

图4 菌株M0101 的16S rDNA 序列系统进化树Fig.4 The phylogenetic tree of the 16S rRNA sequence of strain M0101
2.2 产酶条件优化
2.2.1 碳源、氮源浓度优化 培养基成分中海藻酸钠(C 源)、硫酸铵(N 源)对菌株M0101 生长和相对酶活力影响的结果如图5 所示。在18~50 g/L 海藻酸钠浓度范围内,随着海藻酸钠浓度的升高,菌株的海藻酸钠裂解酶的相对酶活力和生物量呈上升的趋势(图5A)。尽管海藻酸钠添加量为50 g/L 的培养基在接入M0101 种子液前呈现极为浓稠的胶状,但接种发酵20 h 后,浓稠胶状的培养基被水解成有较大流动性的溶液状态,细菌在培养基中分布均匀,可直接稀释一定倍数测定OD600反映其生物量。结果表明菌株M0101 具备水解高浓度海藻酸钠的能力,其生物量和相对酶活力均在实验的浓度范围内达到最大值(图5A)。在更高的海藻酸钠浓度条件下,菌株M0101 可能具有更高的水解酶活力,这有待进一步作深入研究,本文没有继续探讨其水解海藻酸钠的能力极限与发酵时间的关系,故选择海藻酸钠添加量为50 g/L 为基准作后续优化。
在0.5~8 g/L 的浓度范围内,(NH4)2SO4对M0101生物量和相对酶活力的影响见图5B。当(NH4)2SO4质量浓度在0.5~2 g/L 时,随着氮源浓度增加,菌株生物量和相对酶活力均随之增加,当(NH4)2SO4质量浓度为2 g/L 时,菌株的相对酶活力达到最大值,之后随着氮源浓度的继续增加,生物量处于稳定的状态,而相对酶活力有所波动,综合考虑生物量、相对酶活力因素及用料成本,选择(NH4)2SO4的添加量为2 g/L,以此为基准作后续优化。
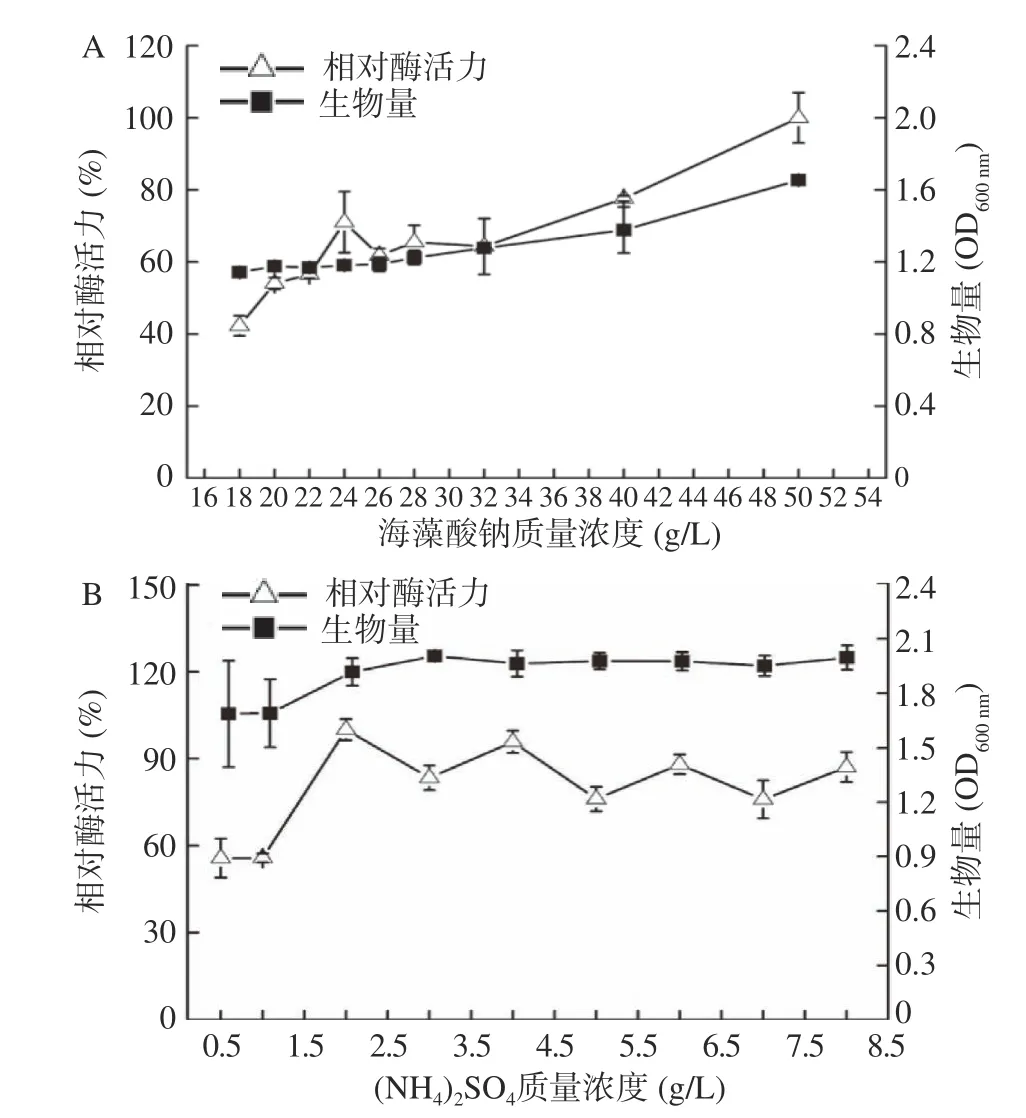
图5 不同碳源、氮源浓度对菌株M0101 产酶和生长的影响Fig.5 The effect of different concentration of carbon source and nitrogen source on enzyme production and growth of strain M0101
2.2.2 培养条件优化 不同温度、转速和初始pH 发酵条件对菌株M0101 产酶和生长影响结果如图6所示。随着发酵温度升高,菌株的生长和相对酶活力增加,相对酶活30 ℃时达到最大值,35 ℃时相对酶活力持平,随后随着温度增加而逐步下降。生物量在35 ℃后下降明显,相对酶活力受温度影响相对较低。当45 ℃时,菌株仍能生长,但生物量只有高峰值的三分之一,相对酶活力达到高峰值的80%左右(图6A);故本研究以较温和的温度30 ℃为基准作后续优化。
转速对菌株相对酶活力影响不大,但对菌株的生长具有一定的影响(图6B),随着转速的增加,相对酶活力呈较平稳状态,而菌株的生长呈上升的趋势,转速低于200 r/min 时,菌株的生长受抑制,可能与转速影响培养基中的容氧量相关。转速在200~300 r/min 的范围内,相对酶活力有所波动,但转速分别为200 r/min 和300 r/min 时,相对酶活力没有显著性差异(P=0.065>0.05),故后续实验选择的转速为200 r/min,以此为基准作进一步优化。
初始pH 对菌株产酶和生长影响结果如图6C所示,在pH5.5~9.5 范围内,其相对酶活力和菌株生长随pH 升高而呈上升趋势,pH 为9.5 时,相对酶活力达到最大值,且与pH 为9.0 时比较,相对酶活力相差不大,没有显著性差异(P=0.605>0.05);当pH大于9.5 时,菌株的相对酶活力和生长能力急剧下降。综合考虑生物量、相对酶活力因素及未来可能的实际应用,后续实验选择的最适宜的酸碱度为pH9.0,以此为基准进一步优化NaCl 浓度。

图6 不同培养条件对菌株M0101 产酶和生长的影响Fig.6 The effect of different culture conditions on enzyme production and growth of strain M0101
2.2.3 NaCl 浓度优化 菌株M0101 分离自腐烂的马尾藻,其生长和产酶需要一定的盐度,在培养基中添加不同浓度的NaCl 对菌株M0101 的生长和产酶影响很大。由图7 可知,M0101 的生长和产酶能力与NaCl 的浓度密切相关,当NaCl 浓度为100 g/L时,菌株的生物量和相对酶活力均达到最高值,尤其是生物量明显高于其他条件,说明其能适应高浓度NaCl 环境,与其同源性很高的菌株Vibrio ganglieiSZDIS-1 能在NaCl 浓度高达14%(140 g/L)的环境中生长[19],表明两者同为耐盐菌;M0101 具有耐盐性推测与菌株生长的海洋环境相关;当NaCl 浓度继续增加,菌株的生长和相对酶活力急剧下降,NaCl 浓度大于140 g/L 时,不利于菌株的生长和产酶。综上所述,选择NaCl 的浓度为100 g/L。
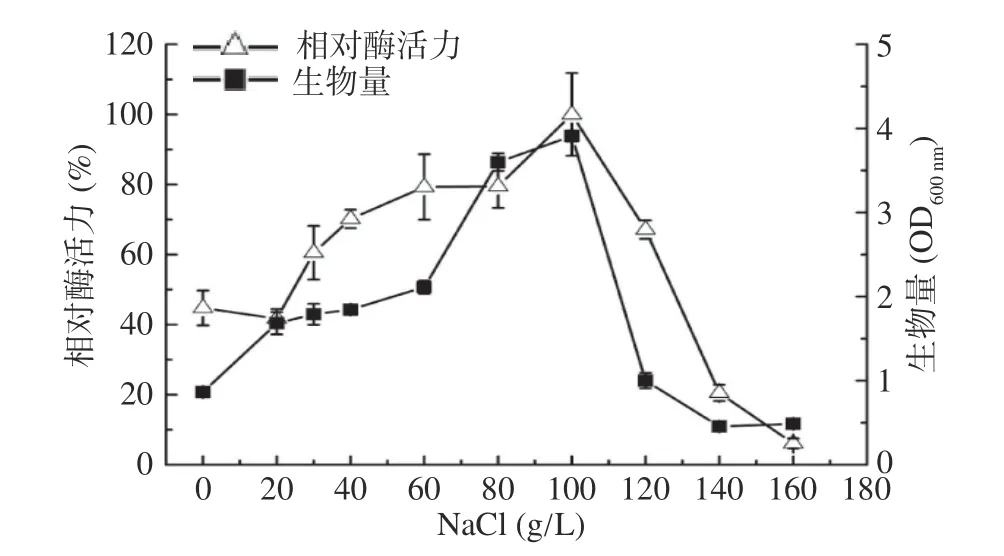
图7 不同NaCl 浓度对菌株M0101 产酶和生长的影响Fig.7 The effect of different concentration of NaCl on enzyme production and growth of strain M0101
2.2.4 优化前后菌株M0101 生长和产酶能力 根据上文优化结果,产酶优化方案确定为:海藻酸钠50 g/L,(NH4)2SO42 g/L,K2HPO41 g/L,NaCl 100 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 0.01 g/L,初始pH9.0,30 ℃,200 r/min。菌株M0101 发酵条件优化前后的生长及产酶能力如图8 所示,优化前,菌株M0101 发酵过程中延滞期较短,24 h 以前已达到稳定期(见图8A),酶活力也处于平稳状态(图8B),酶活力较低。优化后,菌株M0101 对海藻酸钠有较强的利用能力,培养基中碳源浓度高,粘稠,菌株发酵过程中延滞期延后,24 h 以前处于延滞期,经24 h 发酵后,浓稠状态的培养基(含50 g/L 海藻酸钠的培养基呈浓稠状态)才被水解为流动的溶液状态,菌体在培养基中均匀分布,此时可利用紫外可见光分光光度计测定600 nm 处的吸光度值,以此反映发酵菌株的生物量。32 h 后菌株进入对数生长期(图8A),是海藻酸钠裂解酶迅速积累期,发酵32 h 酶活力达到最大值221.90 U/mL(图8B),48 h 后菌株的生长到达稳定期,此时酶活力已开始逐渐降低。相较于发酵条件优化前最大酶活36.32 U/mL,优化后酶活力是优化前的6.11 倍。

图8 菌株M010 发酵条件优化前后生长及产酶曲线Fig.8 Growth and enzyme production curve of strain M0101 before and after optimization of fermentation conditions
3 讨论与结论
褐藻胶裂解酶酶活的高低是微生物吸收利用褐藻胶的关键,其作为一种用途广泛的工具酶,在制备低分子质量的褐藻胶寡糖时,因反应条件温和、专一性强、得率高而逐渐成为制备褐藻胶寡糖的主要方式[20−21]。近年来,从细菌中分离出了许多褐藻胶裂解酶,产酶菌属主要包括Vibrio[22−23]、Flavobacterium[24−25]、Pseudomonas[26−27]、Microbulbifer[28−29]等。本研究中产酶菌株是从北海涠洲岛采集的马尾藻中分离出来的一株产褐藻胶裂解酶菌株,根据菌株形态、生理生化特征和16S rRNA 基因序列分析,鉴定为弧菌属Vibrio,命名为Vibrio ganglieiM0101。弧菌属内不同菌株的褐藻胶裂解酶活力存在较大差异,李云涛等[30]对Vibriosp.SS-1 通过响应面法优化后,酶活力最大可达191.8 U/mL,傅晓妍等[31]筛选到的弧菌Vibriosp.QY102 优化培养120 h 后,产酶达10.2 U/mL,与本文中Vibrio ganglieiM0101 发酵优化后,产酶活性达221.90 U/mL 比较,均存在差异,推测与褐藻胶裂解酶相关基因的差异有关。培养基的成分在微生物发酵过程中对细菌的产酶活力具有决定性作用,合适的碳、氮、金属离子能够促进菌株的生长和产酶[32]。菌株M0101 能够高效利用高浓度海藻酸钠,随着海藻酸钠浓度的升高,菌株的褐藻胶裂解酶活力和生物量呈上升的趋势,具备高效水解高浓度海藻酸钠(50 g/L)的能力。NaCl通常起着维持菌体内外渗透压、维持细胞内外电势差、参与物质运输的作用,在以褐藻胶为碳源的微生物培养基中,还起着运送褐藻胶大分子进入细胞膜的作用,当培养基中NaCl 质量浓度高达100 g/L 时,菌株 M0101 仍能正常生长,符合海洋细菌嗜盐的特点,与其他同类型产海藻酸钠裂解酶的嗜盐菌株相比,该菌株的盐耐受性较强[33];同时,NaCl 还能影响海藻酸钠裂解酶的活性,Xu 等[34]报道的PL7 家族海藻酸钠裂解酶AlyC3 是一种新型的耐低温、盐活化酶,NaCl 浓度为0.5 mol/L(29.25 g/L)时酶活力最强,且浓度为3 mol/L(175.5 g/L)时酶活力仍高于没有NaCl 存在时。Huang 等[35]发现V. weizhoudaoensisM0101(Vibrio ganglieiM0101)中的algM4 基因编码的AlgM4 酶是一种新型的盐活化的双功能酶,经克隆、表达、纯化该双功能酶,发现其最适的NaCl浓度为1 mol/L(58.5 g/L),NaCl 不仅改变了该酶的二级结构元素的组成,同时也提高了该酶的热稳定性;该酶的最适NaCl 浓度与其菌体产酶的最适浓度(100 g/L)差异大,对M0101 基因组数据进行分析,发现M0101 具有5 种海藻酸钠裂解酶编码基因,推测这种差异与M0101 能同时表达多种褐藻酸钠裂解酶有关。
对培养基成分及培养条件优化后,确定菌株M0101 最佳产酶条件为海藻酸钠50 g/L,(NH4)2SO42 g/L,K2HPO41 g/L,NaCl 100 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 0.01 g/L,初始pH9.0,培养温度30 ℃,摇床转速200 r/min,在此条件下可获得最大酶活为221.90 U/mL,是优化前的6.11 倍。这为高活性褐藻胶裂解酶工业制备和褐藻胶寡糖生产提供了理论依据。
