基于群体感应研究苦丁茶多酚对荧光假单胞菌腐败特性的抑制作用
2021-11-23于淑池邢文君冯紫蓝梁宇晴徐小雄裴志胜
于淑池,邢文君,冯紫蓝,梁宇晴,杨 波,徐小雄,裴志胜
(海南热带海洋学院,食品科学与工程学院,海南三亚 572022)
群体感应(quorum sensing,QS)是细菌之间信息交流的一种机制,细菌通过自身合成并释放信号分子(autoinducer,AI)来感知环境变化,当信号分子浓度积累到阈值时,便会与细菌体内特异性受体相结合,从而启动腐败相关基因表达,调控细菌生物被膜的形成、胞外酶的分泌、致腐因子产生及细菌运动等腐败特性[1]。群体感应抑制剂(quorum sensing inhibitors,QSIs)是以细菌群体感应系统为靶点,干扰或抑制腐败菌的生物被膜形成和致腐基因表达,且对细菌正常生命活动不造成破坏[2],不会导致细菌耐药性的形成,具有良好的生态安全性和环境友好性;QSI 主要包括天然来源和人工合成两类[3];从食品安全的角度考虑,天然来源QSI 具有毒副作用小或几乎无毒[4]、成本低廉、便于合成、安全性较高等特点[1],而逐渐成为研究热点。
中草药和药食同源植物中发现大量具有 QSI 活性的天然物质[5],苦丁茶来源为冬青科植物大叶冬青的叶,主要产于我国南部及西南部地区,具有2000多年的饮用历史,也是传统的药用植物,苦丁茶多酚主要包括儿茶素类、黄酮类、黄酮醇类、酚酸类等成分[6];具有较强的抗氧化活性,同时还具有降血压、降脂、抗菌消炎等功效[7];现有文献报道显示,茶多酚(tea polyphenols, TP)是茶叶中多酚类物质的总称,是天然抗氧化剂,同时具有广谱抗菌性,对有细胞壁和无细胞壁的革兰氏阴性、阳性菌均有良好的抑制作用[8],在各种食品的保鲜应用中已经非常广泛[9],但作为群体感应抑制剂研究应用报道较少,黄旭镇[10]研究发现茶多酚作为一种天然来源的QSI,最小抑菌浓度和亚抑菌浓度下可以阻断腐败希瓦氏菌群体感应系统,降低其致腐能力;刘五高等[11]发现茶多酚与常用抗菌药物联用对多重耐药肺炎克雷伯菌具有协同杀菌作用,干扰其生物膜形成和胞外黏液样物质的产生;丹皮提取物与茶多酚复合作为群体感应抑制剂[12],具有协同保鲜效果,可以减缓冷藏大菱鲆鱼块的腐败变质速率。苦丁茶多酚作为群体感应抑制剂,抑制水产品腐败菌荧光假单胞菌(Pseudomonas fluorescens)群体感应及腐败特性的研究还未见报道。
本实验室前期研究从0 ℃贮藏的卵形鲳鲹鱼肉中分离鉴定出一株优势腐败菌荧光假单胞菌(P.fluorescens)[13],研究表明,P. fluorescens是一种典型的革兰氏阴性腐败菌,广泛存在于生鱼、肉类、乳制品及新鲜蔬菜中[14],是引起低温条件下高蛋白和高脂肪食品腐败变质的优势腐败菌[15]。本文以报告菌株紫色杆菌(Chromobacterium violaceum)CV026 为检测模型,以苦丁茶多酚作为群体感应抑制剂,测定苦丁茶多酚对CV026 的群体感应抑制活性;以荧光假单胞菌(Pseudomonas fluorescens)为目标菌株,探究亚抑菌浓度下苦丁茶多酚对荧光假单胞菌群体感应特性的抑制作用;以期拓宽苦丁茶多酚的应用范围,为植物源新型群体感应抑制剂研究开发提供理论基础。
1 材料与方法
1.1 材料与仪器
苦丁茶 购于三亚市胜利路旺豪超市;报告菌株紫色杆菌(Chromobacterium violaceum)CV026购于北京百欧博伟生物技术有限公司;目标菌株荧光假单胞菌(Pseudomonas fluorescens) 自冷藏卵形鲳鲹分离得到,被鉴定为冷藏卵形鲳鲹的特定腐败菌,保存于实验室;无水乙醇、乙酸、氯化钠、乙酸乙酯、结晶氯化铝、氯化锌、甲醇、葡萄糖 均为分析纯,西陇科学股份有限公司;胰蛋白胨、蛋白胨、牛肉膏 北京奥博星生物技术有限责任公司;琼脂粉、卡那霉素、碱性蛋白酶试剂盒 索莱宝生物科技有限公司;酵母粉 广东一品鲜生物科技有限公司;脂肪酶检测试剂盒 南京建成生物工程研究所;N-己酰基-L-高丝氨酸内酯标准品(C6-HSL) Sigma 公司。
SHB-B95 循环水式多用真空泵 郑州长城科工贸有限公司;Multifuge XIR 高速冷冻离心机ThermoFisher 有限公司;RE-52 旋转蒸发器 上海亚荣生化仪器厂;LT-DBX120F 精密可编程热风循环烘箱 立德泰勀(上海)科学仪器有限公司;T6 新世纪紫外可见分光光度计 北京普析通用仪器有限公司;HWS-26 超级恒温水浴锅 金坛市盛蓝仪器制造有限公司;全自动菌落计数仪 杭州迅数科技有限公司;欧诺新一代智能摇床 天津欧诺仪器股份有限公司;TECAN Infinice M NANO 酶标仪 勒菲生物科技上海有限公司;SQ510C 高压蒸汽灭菌锅 重庆雅马拓科技有限公司;SW-CJ-1FD 洁净工作台 苏州安泰空气技术有限公司;BM2000 光学显微镜 南京江南永新光学有限公司。
1.2 实验方法
1.2.1 苦丁茶多酚的制备 苦丁茶多酚的制备参照潘妍霓等[16]的方法并略有改动,称取100 g 苦丁茶粉末加入250 mL 的 45%乙醇溶液,90 ℃水浴浸提25 min,重复2 次后合并浸提液,调pH 至6.0,加入AlCl3(6 g)、ZnCl2(12 g)混合进行沉淀,混合液离心(3000 r/min,10 min)取沉淀,加入12%盐酸200 mL 将沉淀转溶,抽滤后得上清液,400 mL 乙酸乙酯分2 次加入进行萃取,将萃取液进行旋转蒸发(真空度0.07 MPa,60 ℃)浓缩,进一步干燥得到苦丁茶多酚干物质20.3 g,以45%乙醇溶解,配成20 mg/mL母液,4 ℃冷藏备用,使用前经0.22 μm 微孔滤膜过滤除菌。
1.2.2 苦丁茶多酚对荧光假单胞菌的抑菌活性及最小抑菌浓度(MIC)测定
1.2.2.1 苦丁茶多酚对荧光假单胞菌的抑菌活性测定 参照牛慧超等[17]的方法并略有改动。荧光假单胞菌于28 ℃,160 r/min 摇床振荡培养过夜活化后,按2%比例接种于LB 肉汤(酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH7.2~7.4,121 ℃灭菌30 min,固体LB 培养基加入琼脂20 g/L)中,继续培养至菌体密度OD600nm约为0.4,吸取菌液100 μL,均匀涂布于LB 琼脂培养基,牛津杯打孔,每孔加入50 μL不同浓度(2、10、20 mg/mL)苦丁茶多酚,以45%乙醇为空白对照。28 ℃培养静置24 h,观察苦丁茶多酚对荧光假单胞菌的生长抑制情况。
1.2.2.2 苦丁茶多酚对紫色杆菌和荧光假单胞菌最小抑菌浓度(minimum inhibitory concentration,MIC)的测定 采用平板涂布法[18]测定,将苦丁茶多酚母液二倍比稀释成6 个浓度,紫色杆菌、荧光假单胞菌最小抑菌浓度测定的浓度选择分别是0.263、0.525、1.05、2.1、4.2、8.4 mg/mL 以及0.375、0.75、1.5、3.0、6.0、12.0 mg/mL,分别吸取2 mL 苦丁茶多酚溶液加入到无菌平皿内,每皿再倒入18 mL 已灭菌的LB 琼脂培养基,混匀,冷却凝固后,于平板中央分别加入100 μL 过夜活化的荧光假单胞菌菌液,涂布均匀,28 ℃倒置培养24 h,观察菌的生长情况,以完全没有菌生长的最低浓度为苦丁茶多酚的最低抑菌浓度(MIC),每个浓度重复操作3 次。
1.2.3 苦丁茶多酚的群体感应抑制活性检测 参照李晴等[19]的方法并稍作改进,将−80 ℃保存的报告菌株紫色杆菌CV026 接种于LB 肉汤,28 ℃、160 r/min条件下摇床振荡过夜培养,以2%接入量接种于10 mL含有10 μg/mL 卡那霉素的LB 肉汤中,摇床培养16 h 后,吸取1 mL 菌液与100 mL 冷却至40 ℃左右LB 半固体培养基混匀,倒平板。待凝固后用牛津杯打孔,分别加入 100 μL 亚抑菌浓度(0.5、1. 0、1.5和 2. 0 mg/mL)的苦丁茶多酚(均含有20 μg/mL C6-HSL),以只加入100 μL 20 μg/mL C6-HSL 为阳性对照,28 ℃静置培养 1~2 d,观察紫色菌素的产生情况。
1.2.4 苦丁茶多酚对紫色菌素产生及紫色杆菌生长的影响 参照文献[1]的方法,将过夜活化的紫色杆菌CV026,以1:100(体积比)的比例接种于LB 肉汤中,加入苦丁茶多酚,使其终浓度分别为0.5、1.0、1.5和2.0 mg /mL,并添加20 μg/mL 的信号分子C6-HSL,摇床振荡培养(28 ℃、160 r /min)至OD595nm为1 左右,依次取300 μL 添加信号分子菌液于1.5 mL 无菌离心管中,加入150 μL 10%十二烷基硫酸钠,室温下涡旋振荡5 s,静置5 min,加入600 μL饱和正丁醇(正丁醇50 mL 与蒸馏水10 mL),涡旋振荡8 s,离心(10000 r /min,5 min),取含有紫色色素上清液200 μL 加入96 孔板中,测定OD595nm,以未添加苦丁茶多酚的液体培养基为空白对照。以空白对照组的OD595nm为100%,计算苦丁茶多酚各处理组的紫色菌素生成抑制率,计算公式为:

同时为测定苦丁茶多酚对报告菌株CV026 生长的影响,以不加信号分子的实验组作为对照,其余步骤同上,相同条件下培养,测定紫色杆菌CV026 生长情况。
1.2.5 苦丁茶多酚对荧光假单胞菌生长曲线的影响测定 参照王虹懿等[2]的方法,取活化好的荧光假单胞菌,按2%比例接种于LB 肉汤中,加入苦丁茶多酚,使其在培养基中的终浓度分别为0.5、1.0、1.5、2.0 mg/mL,设置未添加苦丁茶多酚的液体培养基作为对照组,于28 ℃、200 r/min 摇床振荡培养,每隔1 h 测1 次各组 OD600nm值,以培养时间为横坐标,OD600nm值为纵坐标,绘制生长曲线。
1.2.6 苦丁茶多酚在亚抑菌浓度下对荧光假单胞菌腐败特性的影响
1.2.6.1 苦丁茶多酚对荧光假单胞菌蛋白酶活性的影响 配置脱脂牛奶平板[2],15%的脱脂乳粉用纯水溶解后单独灭菌(115 ℃,30 min),取10 mL 脱脂乳与90 mL 含0.85%琼脂的LB 半固态营养培养基混合均匀,倾注到水琼脂平板中,蛋白酶活性定性检测参照文献[20]的方法,培养基凝固后用牛津杯打孔,加入过夜培养的含有不同浓度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚的荧光假单胞菌菌液100 μL,28 ℃ 静置培养24 h,以不加苦丁茶多酚的菌液为空白对照,每个处理3 个平行,观察并测量其水解圈直径。
蛋白酶活性定量检测采用碱性蛋白酶活性检测试剂盒进行,将上述步骤中过夜培养的含有不同浓度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚的荧光假单胞菌菌液,离心(4 ℃,10000 r/min,10 min)后取上清液,并用0.22 μm 无菌滤膜过滤除菌,根据碱性蛋白酶活性检测试剂盒说明书进行操作,测定680 nm 处吸光度,计算蛋白酶活性,公式如下:
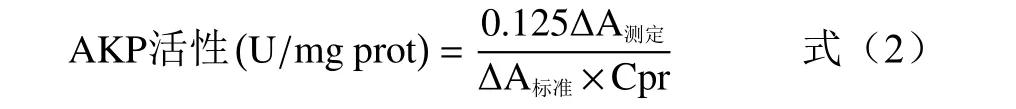
式中:∆A测定=A测定管−A对照管;∆A标准=A标准管−A空白管;Cpr 为样液蛋白质浓度,mg/mL。
1.2.6.2 苦丁茶多酚对荧光假单胞菌脂肪酶活性的影响 将含有不同浓度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚过夜培养的荧光假单胞菌菌液分别于4 ℃,10000 r/min 离心10 min,取上清液并用0.22 μm无菌滤膜过滤除菌备用。根据脂肪酶测定试剂盒说明书进行操作,测定420 nm 处吸光度,计算脂肪酶活性,公式如下:

式中: A1为第一次吸光度值;A2为第二次吸光度值;AS为标准吸光度。
1.2.6.3 苦丁茶多酚对荧光假单胞菌生物被膜形成量的影响 采用酶标法[17],将过夜活化的荧光假单胞菌,按1%的比例接种于LB 肉汤中,分装至无菌离心管,每管1 mL,加入苦丁茶多酚使其终浓度为0.5、1.0、1.5 和 2.0 mg/mL,以无菌去离子水为对照,每组3 次重复,28 ℃静置培养48 h,测定菌液密度后,倾倒菌液,无菌水清洗3 次后,无菌风干燥30 min,采用0.1%(W/V)结晶紫溶液染色15 min,倒去染液用无菌水冲洗5 次,加入33%冰醋酸1 mL 充分溶解,取200 μL 于96 孔板中,用酶标仪在波长595 nm处测定OD 值。按下列公式计算生物被膜形成率:

式中:ODcontrol为对照组测得生物被膜的OD595nm值;ODQSI为抑制剂处理组的OD595nm值。
1.2.6.4 苦丁茶多酚对荧光假单胞菌生物被膜生成的影响 参照文献[1],将载玻片于无水乙醇和去离子水中分别超声处理30 min,烘干灭菌备用。将过夜活化的荧光假单胞菌,按1%的比例接种于LB 肉汤培养基中,吸取10 mL 荧光假单胞菌菌液加入无菌培养皿中,再加入一定量的苦丁茶多酚,使其终浓度分别为0.5、1.0、1.5、2.0 mg/mL,将处理好的载玻片浸在其中,28 ℃培养72 h,同时以不添加苦丁茶多酚为空白对照组。培养完成后取出载玻片,先用无菌水清洗3 次,加入适量甲醇固定15 min,2% 结晶紫染色5 min,无菌水冲洗6 次,无菌风干燥固定,采用光学显微镜(油镜)观察生物膜的生成情况。
1.2.6.5 苦丁茶多酚对荧光假单胞菌群集性和泳动性的影响 参考文献[21]的方法配制群集琼脂培养基(1%蛋白胨、0.5%葡萄糖、0.5%氯化钠、0.5%琼脂)和泳动琼脂培养基(1%胰蛋白胨、0.5%琼脂、0.3%氯化钠),将不同浓度的苦丁茶多酚经0.22 μm的微孔滤膜过滤除菌后,分别与冷却到40 ℃左右的群集、泳动培养基混匀后倒平板,使苦丁茶多酚的终浓度分别为0.5、1.0、1.5、2.0 mg/mL,以未添加苦丁茶多酚的培养基作为空白对照组,待培养基冷却后,向平板中央加入过夜活化的荧光假单胞菌菌液5 μL,无菌风吹干,28 ℃培养24 h,观察菌株的迁移情况,并测量群集、泳动平板中,荧光假单胞菌的群集或泳动直径,根据测得的直径值,进一步计算群集、泳动面积并作图。
1.3 数据处理
采用Excel 处理实验数据及绘图,组间数据差异显著性采用SSPS17.0 进行ANOVA 方差分析,显著性水平设为P<0.05。
2 结果与分析
2.1 苦丁茶多酚的抑菌活性及最小抑菌浓度的测定
抑菌活性可通过抑菌圈的大小初步反映[22]。采用牛津杯打孔法测定苦丁茶多酚的抑菌活性,结果见图1。

图1 苦丁茶多酚对荧光假单胞菌的抑菌效果Fig.1 Inhibitory effect of Kuding tea polyphenols on P.fluorescens
由图1 可知,对照组(图1-1)及低浓度苦丁茶多酚(图1-2)没有抑菌圈产生,说明其对荧光假单胞菌的生长未产生影响;随着苦丁茶多酚浓度的升高,抑菌作用逐渐显现,10、20 mg/mL(图1-3、1-4)苦丁茶多酚处理组的抑菌圈直径分别为8.58 mm 和13.66mm,说明较高浓度的苦丁茶多酚对荧光假单胞菌的生长具有明显抑制作用,在所选择的浓度范围内,抑菌活性与浓度呈正相关。
最小抑菌浓度(MIC)可用于定量表示抑菌剂的抑菌性能。因此,后续苦丁茶多酚对紫色杆菌和荧光假单胞菌的最小抑菌浓度测定,采用1.2.2.2 中设定的浓度范围展开,采用平板涂布法经过24 h 静置培养后,观察所取浓度范围内菌株的生长情况,发现2.1、3.0 mg/mL 的苦丁茶多酚刚好完全抑制紫色杆菌和荧光假单胞菌的生长,因此确定苦丁茶多酚对紫色杆菌、荧光假单胞菌的最小抑菌浓度(MIC)为2.1、3.0 mg/mL,为了保证后续各实验的效果不是由苦丁茶多酚的抑菌作用引起,后续实验选取苦丁茶多酚的亚抑菌浓度进行,即选择0.5、1.0、1.5、2.0 mg/mL 4 个浓度。
2.2 苦丁茶多酚的群体感应活性测定
紫色杆菌(Chnomobacterium violaceum)CV026报告菌株是野生菌株Chromobacterium violaceumATCC 31532 的mini-Tn5 突变体,具有卡那霉素抗性,其本身不产生紫色菌素,也不产生N-酰基高丝氨酸内酯类信号分子(AHLs),但当有外源信号分子AHLs 存在时,能感知其存在[23],并产生紫色素;紫色杆菌CV026 紫色素的产生受细菌群体感应调控,而群体感应抑制剂会抑制其紫色素的产生。采用报告平板法测定苦丁茶多酚对报告菌株CV026 紫色素产生的影响,结果见图2。
图2 显示,平板中添加C6-HSL 信号分子处理组(图2-1),孔径周围出现明显的紫色,表明紫色杆菌CV026 感知到C6-HSL 信号分子存在并产生了紫色菌素;添加苦丁茶多酚的孔径(图2-2~5)周围紫色逐渐减少,随着苦丁茶多酚浓度的提高,颜色逐渐变淡,抑制作用呈剂量依赖性,说明苦丁茶多酚抑制了紫色杆菌的群体感应系统,降低了紫色素的产生。

图2 苦丁茶多酚对紫色杆菌CV026 紫色素产生的抑制作用Fig.2 Inhibitory effects of Kuding tea polyphenols on violacein production of C. violaceum CV026
采用酶标法测定对照组及苦丁茶多酚各处理组紫色菌素生成量,根据公式(1)计算紫色菌素生成抑制率;同时测定紫色杆菌菌液密度,以确定苦丁茶多酚对紫色杆菌生长的影响,结果见图3。

图3 苦丁茶多酚对紫色杆菌CV026 菌落密度和紫色菌素生成抑制率的影响Fig.3 Effects of Kuding tea polyphenols on bacteria concentration and inhibitory rate of production of mycetin of C.violaceum CV026
图3 显示,亚抑菌浓度下,各处理组菌液密度值比较接近,表明苦丁茶多酚对紫色杆菌CV026 生长不产生影响(P>0.05);随着苦丁茶多酚浓度的升高,紫色杆菌色素生成抑制率逐渐升高,当苦丁茶多酚浓度为2.0 mg/mL 时,紫色菌素产量仅为对照产量的31.11%(P<0.05),抑制率达到68.89%。说明苦丁茶多酚在不影响菌株正常生长条件下,对紫色杆菌群体感应系统具有抑制作用。
2.3 苦丁茶多酚对荧光假单胞菌生长曲线的影响
亚抑菌浓度下,苦丁茶多酚处理组对荧光假单胞菌的生长曲线影响情况见图4。

图4 苦丁茶多酚对荧光假单胞菌生长曲线的影响Fig.4 Effects of Kuding tea polyphenols on the growth of P.fluorescens
由图4 可知,亚抑菌浓度下的苦丁茶多酚处理12 h,各组P.fluorescens的生长曲线与对照组生长趋势基本一致,0~2 h 为荧光假单胞菌的生长调整期,细菌密度基本变化不大,2 h 后开始进入对数生长期,细菌进行快速地生长,对照组和0.5、1.0 mg/mL 苦丁茶多酚处理组的生长速度较快。到12 h 时生长曲线已逐渐趋于稳定,对照组和添加0.5、1.0 mg/mL苦丁茶多酚处理组的OD600nm值分别为1.17、1.18、1.15,菌株生长水平整体变化不明显;但2.0 mg/mL苦丁茶多酚处理组的生长速度相较之下稍慢,在12 h时菌体密度OD600nm值为1.11。说明随着苦丁茶多酚浓度的升高,菌株活力逐渐受到抑制,细菌生长速度稍微下降,但总体变化趋势区别不大(P>0.05),苦丁茶多酚对菌株的生长水平影响不明显。
2.4 苦丁茶多酚对荧光假单胞菌胞外蛋白酶活性的影响
腐败细菌在脱脂牛奶平板生长过程中,通过分泌胞外蛋白酶,水解牛奶中的酪蛋白,形成明显的透明圈,蛋白酶水解活性的高低可以通过观察透明圈的大小来判断[24]。荧光假单胞菌可分泌胞外蛋白酶水解水产品中蛋白质及游离氨基酸,产生腐败代谢产物,使水产品腐败变质[25]。由图5 可知,未添加苦丁茶多酚的对照组(图5-1)水解圈最大,为9.41 mm,经苦丁茶多酚处理后蛋白酶水解圈直径逐渐明显减小,0.5、1.0、1.5、2.0 mg/mL 苦丁茶多酚处理组的蛋白酶水解圈直径分别为5.07、3.77、3.63、3.25 mm(图5-2、3、4、5),水解圈直径与苦丁茶多酚浓度呈负相关,说明亚抑制浓度的苦丁茶多酚抑制了荧光假单胞菌的胞外蛋白酶活性。群体感应抑制剂能够抑制腐败菌胞外蛋白酶活性,相关研究报道较多[1,2,17,19]。P. fluorescens是水产品中主要的蛋白分解菌,具有产生高活性蛋白水解酶的能力[26],该过程是由QS 现象调控的[24],崔方超等[27]研究认为,荧光假单胞菌胞外蛋白酶分泌活性受酰基高丝氨酸内酯类信号分子介导的QS 系统调控。为定量确定苦丁茶多酚抑制荧光假单胞菌胞外蛋白水解酶分泌能力,进一步采用碱性蛋白酶检测试剂盒定量测定了苦丁茶多酚对P.fluorescens蛋白酶活性的影响,按公式(2)计算蛋白酶活性,结果见图6。

图5 苦丁茶多酚对荧光假单胞菌胞外蛋白酶活性的影响Fig.5 Effects of Kuding tea polyphenols on extracellular protease activity of P. fluorescens

图6 苦丁茶多酚对荧光假单胞菌蛋白酶活性的影响Fig.6 Effects of Kuding tea polyphenols on extracellular protease activity of P. fluorescens
由图6 可知,对照组荧光假单胞菌蛋白酶活性最高,蛋白酶活性达到2.9×10-2U/mg prot,随着苦丁茶多酚浓度的升高,蛋白酶活性逐渐降低。苦丁茶多酚浓度为2.0 mg/mL 时,蛋白酶活性为0.56×10−2U/mg prot,与对照相比其相对抑制率达到80.68%,差异显著(P< 0.05)。表明苦丁茶多酚对荧光假单胞菌的蛋白酶活性具有抑制作用。这与绿原酸[2]、花椒提取物[19]等对P. fluorescen蛋白水解酶活性的抑制作用测定结果相似,只是研究中发现P. fluorescens蛋白酶活性普遍偏低,可能与所用培养基或培养条件等因素影响相关。
2.5 苦丁茶多酚对荧光假单胞菌脂肪酶活性影响
肉制品腐败菌通过产生脂肪酶降解肌肉组织,将甘油三酯降解为甘油或脂肪酸,从而改变肌肉组织导致腐败发生[2]。按公式(3)计算脂肪酶活性,结果见图7。
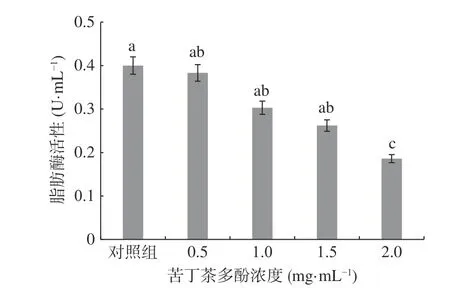
图7 苦丁茶多酚对荧光假单胞菌胞外脂肪酶活性的影响Fig.7 Effects of Kuding tea polyphenols on extracellular lipase activity of P. fluorescens
图7 显示,对照组的脂肪酶活性最高,为0.4 U/mL,处理组随着苦丁茶多酚浓度的增加,荧光假单胞菌的脂肪酶活性逐渐降低,苦丁茶多酚浓度为2.0 mg/mL时,脂肪酶活性为0.186 U/mL,与对照相比其相对抑制率达到53.50%,差异显著(P<0.05)。说明苦丁茶多酚能抑制荧光假单胞菌胞外脂肪酶的活性,且浓度越高,抑制能力越强,研究结果与绿原酸对P. fluorescens脂肪酶活性抑制作用相似[2]。
2.6 苦丁茶多酚对荧光假单胞菌生物被膜形成的影响
在外界环境条件不利的情况下,细菌相互粘连并将其自身克隆聚集缠绕于自身的分泌物以及崩解物中,形成的膜样物为生物被膜(biofilm,BF)[28],其广泛存在于食品加工设备表面,不易清理,对食品容易造成污染[29],苦丁茶多酚对生物膜形成抑制作用的定量测定,按公式(4)计算生物膜形成率,结果见图8。

图8 苦丁茶多酚对荧光假单胞菌的菌液密度和生物被膜形成的影响Fig.8 Effects of Kuding tea polyphenols on bacteria concentration and biofilm formation of P. fluorescens
图8 显示,各组菌液密度值都接近,差异不显著(P>0.05),说明苦丁茶多酚对荧光假单胞菌的生长不产生影响;对照组的生物被膜形成率为100%,0.5 mg/mL 苦丁茶多酚处理组的生物被膜形成率为94.36%;当苦丁茶多酚的浓度为2.0 mg/mL 时,生物被膜的形成率仅为55.10%,抑制率达到44.90%。苦丁茶多酚能够明显抑制荧光假单胞菌生物被膜的形成,且浓度与生物被膜形成率呈负相关,说明苦丁茶多酚对荧光假单胞菌的生长无影响,在其菌液密度基本一致的情况下,苦丁茶多酚可以抑制其生物被膜的形成,图9 为苦丁茶多酚对荧光假单胞菌生物被膜形态的影响显微镜观察结果图。

图9 苦丁茶多酚对荧光假单胞菌生物被膜形态影响的光学显微镜图(100×)Fig.9 Effects of Kuding tea polyphenols on biofilm of P. fluorescens under optical microscope(100×)
由图9 可见,对照组(图9-1)的菌体成大片聚集膜状,比较致密,外凸,能够牢固粘附在载玻片表面,生物膜形成较成熟;处理组(图9-2~5)的生物膜细胞密度、细胞团块的大小随着苦丁茶多酚浓度的升高而降低,0.5 mg/mL 苦丁茶多酚处理组的菌体生物膜产生空隙,呈薄片的网状分布,形成稀疏的小菌落粘附在载玻片表面,1.0 mg/mL 以上苦丁茶多酚处理组的生物膜形态逐渐被破坏,呈稀疏状分散,颜色逐渐变浅,菌体膜状物逐渐稀疏,单个分布呈分散状在载玻片上。说明苦丁茶多酚对荧光假单胞菌生物膜的形成有抑制作用,能够减少并阻止生物膜的形成。显微镜观察结果与生物被膜形成定量测定结果相吻合。茶多酚通过干扰细菌群体感应中信号分子的合成从而影响细菌成膜能力[9],对细胞膜形成起到了抑制作用,茶多酚对肺炎克雷伯菌的生物膜形成也具有类似抑制作用。其机制可能与细菌的群体感应作用有关,本研究也进一步证实了茶多酚的这种抑制机制。推测苦丁茶多酚具有干扰P. fluorescens粘附于接触面的能力,可以通过调控荧光假单胞菌的群体感应活性来调控其生物被膜的生成。
2.7 苦丁茶多酚对荧光假单胞菌群集性与泳动性的影响
群集和泳动是细菌通过鞭毛介导的的两种迁移方式,主要指细菌在大于0.45%或小于0.45%的琼脂培养基表面迁移[30]。图10 为亚抑菌浓度下苦丁茶多酚对荧光假单胞菌群集与泳动性的抑制效果图。
图10 显示,荧光假单胞菌在群集及泳动平板表面培养24 h 后,有向外迁移的趋势,对照组(图10A-1、B-1)迁移能力最强,苦丁茶多酚处理组随着浓度的升高,迁移扩散直径逐渐减小,表明苦丁茶多酚能有效地抑制荧光假单胞菌的群集和泳动能力,抑制活性与质量浓度存在剂量依赖性,这与孙晓佳等[1]及陈桂芳[31]研究结果相似。说明苦丁茶多酚能够调控荧光假单胞菌的迁移(群集和泳动),从而干扰了鞭毛吸附于附着物的能力[32],进而抑制其致腐能力。
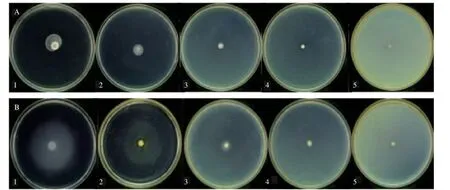
图10 苦丁茶多酚对荧光假单胞菌群集(A)、泳动性(B)的影响Fig.10 Effects of Kuding Tea polyphenols on swarming(A)and swimming(B)of P. fluorescens
图11 为苦丁茶多酚对荧光假单胞菌运动区面积和直径的影响结果。从图11 可以看出,随着苦丁茶多酚的浓度增加,P. fluorescens迁移受到了一定的抑制,群集及泳动的直径及面积与对照相比,均明显减弱,苦丁茶多酚浓度超过1.0 mg/mL 时,减小趋势显著(P<0.05);当质量浓度为2.0 mg/mL 时,苦丁茶多酚对荧光假单胞菌群集和泳动(直径)的抑制率分别达到79.56%和90.12%。

图11 苦丁茶多酚对荧光假单胞菌运动区面积和直径的影响Fig.11 Effects of Kuding tea polyphenolson diameter and area of the motility zone of P. fluorescens
泳动有利于细菌生物膜的形成以及细菌在宿主表面的黏附聚集[19]。细菌迁移运动在生物被膜形成过程中具有极其重要的作用[1,32],苦丁茶多酚对P.fluorescens群集、泳动的抑制作用结果,与上述抑制生物膜形成的结果可以互相验证。
单宁含量丰富的草莓可以通过抑制P.aeruginosa的群体感应系统来干扰其迁移能力[21]。TP 是茶叶中多酚类物质的总称,又叫茶单宁或茶鞣质,主要包括黄烷醇类(儿茶素)、黄酮类、黄酮醇类、花色苷类、酚酸类等成分,特别是儿茶素含量达60%~80%[33],占茶叶干重的30%~40%[34]。黄旭镇[10]研究认为,茶多酚通过其主要成分儿茶素类化合物,调控腐败希瓦氏菌QS 的形成及腐败指标。苦丁茶多酚中黄烷醇类也是主要成分,黄烷醇类物质中又以儿茶素类物质为主[12]。推测苦丁茶多酚的群体感应活性与其多酚中儿茶素成分更相关。曾亮等[35]研究发现,儿茶素25~80 ℃时抑菌效果最好,热稳定性高,且活性不受温度的影响,在酸性条件下更稳定。本研究所制备的苦丁茶多酚与曾亮等的研究报道相似,提取温度高达90 ℃,同时制备过程中,用强酸转溶,60 ℃烘箱干燥,活性依然保持,显示出苦丁茶多酚良好的热稳定性及酸稳定性,揭示苦丁茶多酚作为群体感应抑制剂具有良好的应用前景。
3 结论
以紫色杆菌CV026 为报告菌株,通过添加外源信号分子,证明了苦丁茶多酚在亚抑菌浓度下,对细菌生长不产生影响,能够显著抑制细菌的群体感应活性,抑制CV026 紫色菌素的产生,苦丁茶多酚浓度为2.0 mg/mL 时,紫色菌素生成抑制率达到68.89%;在该浓度下,对荧光假单胞菌胞外蛋白酶活性抑制率为80.68%,脂肪酶活性抑制率53.50%,生物被膜形成抑制率44.90%,群集和泳动能力的抑制率分别达到79.56%和90.12%;抑制作用具有浓度依赖性,制备过程中发现苦丁茶多酚具有较好的热稳定性及酸稳定性,研究结果可以为其天然群体感应抑制剂的开发应用奠定理论基础。
