基于特异质大鼠胆红素相关转运体功能抑制探讨首乌藤肝损伤机制
2017-10-20李红品朱虹宇高兴马鹏凯陈建华毕欣宁汪祺张玉杰
李红品 朱虹宇 高兴 马鹏凯 陈建华 毕欣宁 汪祺 张玉杰
[摘要]考察全粉及提取物对正常和特异质(LPS)大鼠胆红素相关转运体Oatp1a1,Oatp1b2和MRP2活性及mRNA表达的影响,探讨首乌藤致肝损伤的可能机制。正常及LPS大鼠分别连续灌胃首乌藤全粉及提取物7 d后,静脉注射转运体底物磺溴酞钠(BSP),测定其药动学参数,考察各转运体的活性,同时取肝组织检测转运体mRNA的表达。结果首乌藤全粉及提取物可使BSP的t1/2和AUC显著升高,CL显著降低;AST和ALT显著性降低;Oatp1a1,Oatp1b2及MRP2的mRNA表达水平明显下降(P<005),但未见二者与LPS的协同作用。综上首乌藤及其提取物对胆红素相关转运体功能的抑制作用,可能是其是否造成肝损伤的原因之一。
[关键词]首乌藤; 胆红素; 转运体; 特異质; 肝毒性
Study on mechanism of hepatotoxicity of Ploygoni Multiflori Caulis based on
function inhibition of bilirubinassociated transporters in idiosyncratic rat
LI Hongpin1, ZHU Hongyu1, GAO Xing1, MA Pengkai1, CHEN Jianhua1, BI Xinning1, WANG Qi2*, ZHANG Yujie1*
(1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100102, China;
2. National Institute for Food and Drug Control, Beijing 100050, China)
[Abstract]To explore the possible mechanism of liver injury, the effects of Ploygoni Multiflori Caulis and its extractive on the function of bilirubinassociated transporters were investigated in normal (N) and idiosyncratic (LPS) rats (M) The normal and LPS rats were respectively administrated powder of Ploygoni Multiflori Caulis, its extractive and same volume of 05% CMCNa solution for 7 d BSP, a substrate of the transporters of Oatp1a1 and Oatp1b2 was selected, and its pharmacokinetic parameters of intravenous injection were determined to examined the activity these transporters Meanwhile the mRNA expressions of transporters were detected Compared with Nblank control group, besides Mpowder group, the Cmax has no significantly different from other groups, t1/2, AUC0t and AUC0∞ were significantly increased, and CL were significantly decreased However, compared with N blank control group, AST and ALT decreased significantly The expression of Oatp1a1, Oatp1b2 and MRP2 mRNA was significantly decreased (P<005), but there was no act synergistically when Ploygoni Multiflori Caulis and extractive were combined with LPS The function of Oatp1a1, Oatp1b2 and MRP2 in rats were significantly inhibited by Ploygoni Multiflori Caulis and extractive, which may be an important cause of hepatotoxicity.
[Key words]Ploygoni Multiflori Caulis; bilirubin; transporter; idiosyncratic; hepatotoxicity
首乌藤Ploygoni Multiflori Caulis为蓼科植物何首乌Polygonum multiflorum Thunb的干燥藤茎,用于失眠多梦,血虚身痛等[1]。所含化学成分与何首乌类似,主要为蒽醌类、二苯乙烯苷、鞣质和二蒽酮等几类化合物[2]。近年来首乌藤肝毒性作用逐渐被发现,引起各界的关注,但其毒性物质成分及肝损伤机制尚不明了。
临床上,首乌藤的毒性症状主要表现为胆管上皮细胞受损,肝细胞功能紊乱及胆汁瘀积 [34]。胆红素作为胆汁的主要成分,有结合胆红素(BG)和非结合胆红素(UCB)之分,生理浓度的UCB具有抗氧化活性,高浓度则容易产生细胞毒性,是胆汁瘀积性肝损伤的重要原因。血液中的UCB主要通过转运体Oatp1b1和Oatp1b3(大鼠为Oatp1a1和Oatp1b2)摄取入肝脏,在肝脏中经过代谢酶作用成为BG,再经转运体MRP2外排致胆汁中。若胆红素相关代谢酶或转运体的功能出现障碍,都将导致UCB在肝细胞和血液内蓄积,引发肝毒性,产生黄疸[5]。为此有人推测何首乌可能具有抑制胆红素(胆汁酸)相关转运体的作用,从而造成胆红素转运肝细胞受阻,进而形成瘀积,使肝组织受损。目前这一推论已在体外细胞模型上获得证实[6],研究表明何首乌中的多种化学成分对胆汁酸转运体存在抑制作用。由于转运体在体内较之体外所受影响因素的复杂性,以及体内多种代偿调控作用的客观存在,体外结果不能完全反映何首乌对转运体的实际作用情况,体内验证实验研究是十分必要的。此外,最近王伽伯等[7]通过大数据分析,发现何首乌及其制剂所致肝损伤的总体发病率较低,可能存在高危人群,类似于特异质性肝损伤。并且目前对于首乌藤缺乏研究。endprint
为此,本研究采用底物清除法,以磺溴酞钠(BSP)为 Oatp1a1,Oatp1b2和MRP2的底物,考察首乌藤及其总二蒽酮提取物对正常和特异质(LPS)大鼠转运体活性的影响,并采用RTPCR技术,检测转运体mRNA表达的变化,为首乌藤对胆红素相关转运体功能影响提供体内实验依据,为探索其致肝损伤的机制奠定基础。
1材料
11仪器
FW100高速万能粉碎机(北京市中性伟业仪器有限公司);RE52AA旋转蒸发仪(上海亚荣生化仪器厂);TU1901紫外分光光度计(北京普析通用仪器有限责任公司);TGL20M台式高速冷冻离心机(长沙湘智离心机仪器有限公司);DKZ450B型电热恒温振荡水槽(上海森信实验仪器有限公司);VOTEX GENIVS涡旋混匀仪(IKA)。
12试药
首乌藤饮片(北京本草方源药业有限公司,批号20160523);磺溴酞钠(BSP,北京伊诺凯科技有限公司,批号A0357281);脂多糖(LPS,北京兰博利德商贸有限公司,批号046M4045V);谷丙转氨酶试剂盒(ALT试剂盒,南京建成生物工程研究所,批号20161019);谷草转氨酶试剂盒(AST试剂盒,南京建成生物工程研究所,批号20161017);其他试剂均为分析纯。
13动物
SpragueDawley(SD)雄性大鼠,体质量(200±20) g,购于斯贝福(北京)实验动物科技有限公司,许可证号SCXK20110004。标准动物房中饲养,室温22~24 ℃,湿度55%~60%,光照12 h时明暗交替,塑料盒饲养,喂以SPF级标准饲料。
2方法
21溶液的制备
211首乌藤粉供试液的制备精密称取首乌藤粉末(过8号筛)适量,加05%的CMCNa溶液混悬并定容,制成生药质量浓度为250 g·L-1的首乌藤粉混悬液,置于4 ℃,备用。
212首乌藤提取物供试液的制备[8] 取首乌藤饮片800 g,用10倍量70%乙醇加热回流提取3次,提取时间分别为2,15,1 h,滤过,合并提取液,减压回收溶剂,得浸膏8769 g。将浸膏按1∶10的比例分散于水中混悬,用二氯甲烷萃取2次,水溶液部分减压除去有机溶剂,然后过AB8型大孔吸附树脂,按1 g药材/5 mL树脂上样,用95%乙醇2倍柱体积洗脱,将得到的部分浓缩、干燥,得总二蒽酮提取物,得率为616%。精密称取提取物粉末适量,加05%的CMCNa溶液混悬并定容,制成质量浓度为50 g·L-1的混悬液(相当首乌藤生药质量浓度800 g·L-1),置于4 ℃,备用。
213BSP储备液的配制精密称取BSP适量,加生理盐水溶解并定容,制成质量浓度为50 g·L-1的BSP储备液,置于4 ℃,备用。
214LPS静脉注射溶液的配制精密称取LPS适量,加生理盐水溶解并定容,制成质量浓度为28 g·L-1的LPS溶液,置于4 ℃,备用。
22分组及给藥
221LPS大鼠模型的复制[9]36只大鼠随机分为6组,特异质模型(LPS)3组分别为:M全粉组、M提取物组、M空白对照组,每组于第1天经大鼠股动脉注射LPS(28 mg·kg-1)造模;正常3组分别为:N全粉组、N提取物组、N空白对照组,于第1天股静脉注射同体积的生理盐水。参照文献[9]对各组的炎性细胞因子IL1β,IL6,TNFα进行检测,结果与正常大鼠比较,LPS模型大鼠的IL1β,IL6,TNFα均有不同程度的上调(P<005),说明大鼠处于免疫应激状态,但其表达上调量尚未达到引起肝损伤的程度,表明模型复制成功。
222给药2 h后各组分别灌胃首乌藤粉混悬液(5 g·kg-1·d-1,给药体积20 mL·kg-1),首乌藤提取物混悬液(1 g·kg-1·d-1,给药体积20 mL·kg-1),同体积的05%的CMCNa溶液。每日1次,连续给药7 d。实验期间,记录大鼠每日摄食摄水量,体质量、临床观察动物体征及粪便。
23BSP药代动力学试验[10]
231样品采集和处理给药结束后,大鼠禁食24 h,分别由股动脉注射转运体特异性底物BSP,剂量为2 mL·kg-1(100 mg·kg-1)。分别在注射后0,2,5,10,20,25,30,40,50,60 min,由眼眶取血06 mL,置于肝素化的离心管中,15 000 r·min-1离心15 min,取上清血浆,存于-20 ℃,待测。待血液收集完,即60 min后,处死大鼠,取肝脏存于-80 ℃冰箱中,待测。
232大鼠血浆BSP的测定分别取各组血浆样品50 μL于EP管中,各加蒸馏水250 μL,01 mol·L-1氢氧化钠300 μL进行显色。并取A,B 2管,各加空白血浆50 μL,蒸馏水250 μL。于A管中加01 mol·L-1氢氧化钠300 μL进行显色,于B管中加01 mol·L-1盐酸300 μL作为对照,于580 nm测定吸光度,利用标准曲线求得血浆BSP浓度。
24转运体基因表达的检测[11]
称取100 mg大鼠肝脏组织剪碎,经RNA提取,RNA浓度、纯度及其完整性的测定,反转录,PCR扩增等过程。用PCR仪自带软件进行荧光定量分析,得出Ct值,待测样本目的基因表达数的计算方法用2-ΔΔCt法决定目标基因Oatp1a1,Oatp1b2,MRP2表达的相对水平。
25血清生化指标的检测
取各组血浆样品根据试剂盒说明书进行操作,采用TU1901紫外分光光度计测定血清生化指标AST和ALT,并将所测定的结果与N空白对照组比较分析。
26数据处理
大鼠的血药浓度时间数据釆用DAS 211药代动力学软件分析,并计算药代动力学参数。各组数据均采用SAS统计软件处理,所用的统计检验均采用双侧t检验,P<005将被认为所检验的差别有统计意义。endprint
3结果
31方法学考察
311线性关系取试管5只,分别取不同体积BSP储备液,然后依次加入空白血浆使总体积均成200 μL,摇匀,使各管中BSP质量浓度为002,025,050,075,10 g·L-1。再取试管5只,分别加入上述各管BSP储备液50 μL,按照232项方法显色,测定吸光度。以BSP的含量(x)为横坐标,吸光度(y)为纵坐标进行回归分析,BSP对照品含量与吸光度之间满足关系式y=1094 2x+0024 7(r=0999 5)。BSP在002~10 g·L-1与吸光度呈现良好线性关系,检测限为0006 g·L-1。
312精密度取线性关系中低、中、高3个浓度的血浆BSP对照品溶液,连续显色测定6次,记录吸光度,分别求得吸光度的RSD<10%,符合生物样本测定的要求。
313重复性分别准确吸取稀释后样品液各5份,按照232项的方法进行测定,计算含量。求得RSD=017%,表明该方法重复性良好。
314加样回收率向空白血浆中分别加入低、中、高3个浓度的BSP对照品,每组3份,再按照232项的方法测定吸光度。结果3 组的平均加样回收率分别为9986%,9923%,9826%,RSD分别为0090%,034%,059%。说明加样回收率良好,符合方法学测定要求。
32首烏藤及提取物对Oatp1a1,Oatp1b2,MRP2活性的影响
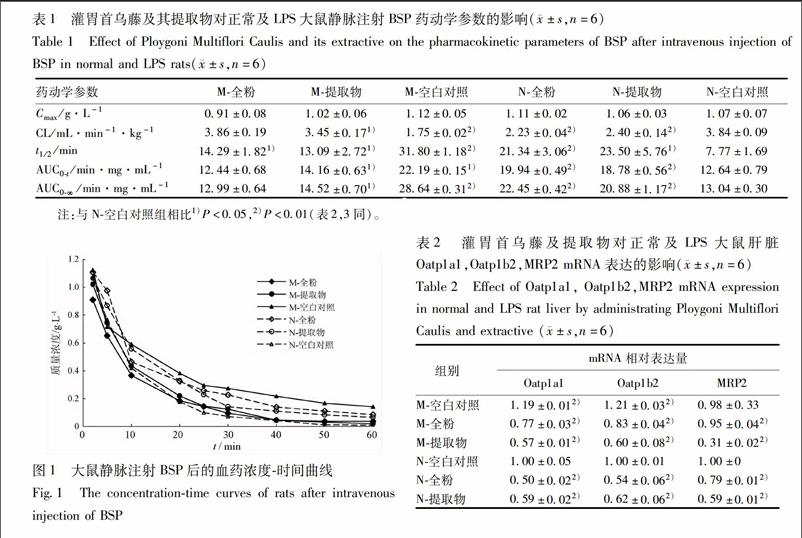
各组Oatp1a1,Oatp1b2,MRP2转运体的特异性底物(BSP)药代动力学试验结果见表1,血药浓度时间曲线见图1。结果显示:除M全粉组,其余各组与N空白对照组相比,Cmax无显著性差异,但各组的t1/2,AUC0t,AUC0∞显著升高,CL显著下降(P<005),由于BSP在体内主要通过Oatp1a1,Oatp1b2,MRP2进行肝脏转运,结果表明首乌藤及二蒽酮对大鼠肝内转运体Oatp1a1,Oatp1b2产生了明显的抑制作用。
血药浓度时间曲线下面积表现为M空白对照组>N全粉组>N提取物组≈M提取物组>N空白对照组≈M全粉组,其中M空白对照组高于其他各组,表明LPS对Oatp1a1和Oatp1b2的活性具有明显的抑制作用;N全粉组>N提取物组≈M提取物组>M全粉组,说明首乌藤全粉对Oatp1a1和Oatp1b2活性的抑制作用强于提取物二蒽酮;并且其在正常组的抑制作用强于模型组,说明首乌藤及二蒽酮与LPS合用时对Oatp1a1和Oatp1b2活性的抑制作用减弱,可能具有一定的保护作用。
33首乌藤及提取物对Oatp1a1,Oatp1b2,MRP2基因表达的影响
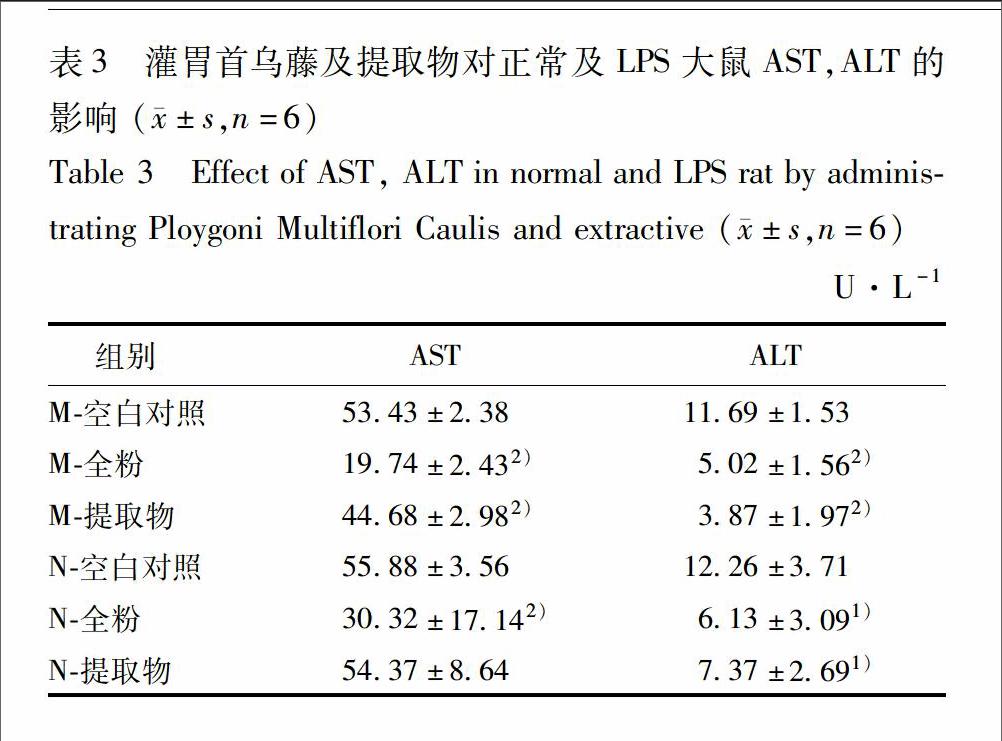
各转运体的mRNA表达结果见表2。Oatp1a1结果显示:与N空白对照组相比,除M空白对照组显著升高,其余各组mRNA的表达均表现为显著性下降的趋势,下降的程度呈现出N全粉组>M提取物组≈N提取物组>M全粉组>N空白对照组。转运体Oatp1b2的mRNA结果与其相似。转运体MRP2的mRNA结果,与N空白对照组相比,除M空白对照组无显著性差异,其余各组mRNA的表达均表现为显著性下降的趋势,但下降程度呈现出M提取物组>N提取物组>N全粉组>M全粉组>M空白对照组≈N空白对照组。
34首乌藤及提取物对血清AST,ALT的影响
大鼠给药首乌藤及提取物后的血清生化指标AST,ALT的检测结果见表3。与N空白对照组比较,AST和ALT均显著性降低。
4讨论
转运体介导药物在组织及细胞中的摄入和外排,并在药物吸收、分布、代谢和排泄(ADME)中起重要作用[12]。肝脏是人体内物质代谢的主要器官,重要的解毒功能,通常情况下,药物经血液进入肝脏,再以原形或代谢物的形式经胆汁分泌至体外。在这一程中,肝细胞血窦侧的摄取转运体协助底物运输至肝细胞内,而胆小管侧和血窦侧的外排转运体则负责将药物或代谢物排至胆汁或重新转运回血液[13]。
BSP与胆红素的代谢途径类似,在机体内几乎完全经过肝胆管清除,主要通过转运体Oatp1a1和Oatp1b2摄取入肝脏,其原型再经过外排型转运体MRP2外排致胆汁中[10]。本研究利用BSP的此特性作为Oatp1a1和Oatp1b2的特异性底物,进而判断其活性变化,BSP药代动力学结果显示:首乌藤及其提取物可使BSP的t1/2,AUC0t,AUC0∞显著升高,CL显著下降(P<005),由于BSP在体内主要通过Oatp1a1,Oatp1b2,MRP2进行肝脏转运,结果表明首乌藤及提取物二蒽酮对大鼠肝内转运体Oatp1a1,Oatp1b2产生了明显的抑制作用。由血药浓度时间曲线下面积可以看出:首乌藤全粉的抑制作用强于提取物二蒽酮;LPS对Oatp1a1,Oatp1b2也有明显的抑制作用;而正常组的抑制作用强于模型组,说明首乌藤及提取物二蒽酮与LPS合用时对转运体活性的抑制作用减弱,可能具有一定的保护作用。
无论正常或LPS大鼠,首乌藤全粉和二蒽酮对Oatp1a1,Oatp1b2,MRP2的基因表达均有显著抑制的作用:在正常大鼠中,二蒽酮对于MRP2的作用高于全粉,而全粉对Oatp1a1和Oatp1b2的作用高于二蒽酮,即二蒽酮对毒性物质或胆红素的外排产生了较强的抑制作用,其毒性作用可能强于全粉;但在LPS大鼠中,全粉对MRP2的作用高于二蒽酮,而二蒽酮对Oatp1a1和Oatp1b2的作用高于首乌藤全粉,说明全粉的毒性作用可能高于二蒽酮;并且M空白对照组对MRP2的基因表达无影响,并对Oatp1a1和Oatp1b2基因表达具有一定的上调作用,说明LPS对肝脏无损伤作用。
ALT与AST主要分布在肝脏的肝细胞内,肝细胞坏死时ALT和AST就会升高,其升高的程度与肝细胞受损的程度相一致,是目前最常用的肝功能指标。因此本研究对这2种指标进行检测,结果与N空白对照组比较, AST和ALT均显著性降低。临床上认为其升高方可说明肝损伤情况,而降低并不具有生物学意义,其原因可能给药时间过短,机体的代偿性调节消除了这2种指标的变化。endprint
综上首乌藤及其总二蒽酮部位对大鼠肝脏内转运体Oatp1a1,Oatp1b2,MRP2的功能具有抑制作用,推测可能与胆红素或毒性物质成分肝内蓄积,形成的肝损伤存在一定的联系,此结论尚需进一步蛋白表达及生化病理学研究证实。
[参考文献]
[1]中国药典. 一部[S]. 2015.
[2]苏建,袁志芳,吴一兵,等. 何首乌和夜交藤药材指纹图谱研究与评价[J]. 中草药,2008,39(5):766.
[3]周甜. 疑似首乌藤致死案:谁能说清中药毒性?[N]. 中国新闻周刊, 20160722.
[4]王濤,王佳颖,周植星,等. 何首乌水提物大鼠连续灌胃给药28 d肝毒性研究——胆汁淤积相关机制探讨[J]. 中国中药杂志,2015,40(11):2163.
[5]Maeda K. Organic anion transporting polypeptide (OATP) 1B1 and OATP1B3 as important regulators of the pharmacokinetics of substrate drugs[J]. Biol Pharm Bull, 2015,38(2):155.
[6]Kang L, Si L, Rao L, et al. Polygoni Multiflori Radix derived anthraquinones alter bile acid disposition in sandwichcultured rat hepatocytes[J]. Toxicol In Vitro, 2017,10(40): 313.
[7]李春雨, 王伽伯, 肖小河, 等. 基于内毒素模型的何首乌特异质肝损伤评价[J]. 药学学报,2015,50(1):28.
[8]张阳. 大孔吸附树脂分离番泻叶中二蒽酮类化合物的研究[D]天津:天津大学,2006.
[9]李春雨. 基于免疫应激的何首乌特异质肝损伤的初步研究[D]成都:成都中医药大学,2015.
[10]Fisher C D, Lickteig A J, Augustine L M, et al. Experimental nonalcoholic fatty liver disease results in decreased hepatic uptake transporter expression and function in rats[J]. Eur J Pharmacol, 2009, 613(1/3):119.
[11]吴双,杨红莉,李浩,等. 制何首乌对大鼠肝CYP1A2酶活性及mRNA表达的抑制作用[J]. 世界中医药,2016,11(3):475.
[12]Sun D L, Jiang H D, Zeng S. Drug design based on the function of membrane transporters in drug absorption, distribution, metabolism and excretion[J]. J Chin Pharm Sci, 2012, 21(6): 544.
[13]Funk C. The role of hepatic transporters in drug elimination[J]. Expert Opin Drug Metab Toxicol, 2008,doi: 101517/1742525544363.
[责任编辑张燕]endprint
