响应面法优化罗非鱼鳞钙结合肽酶解工艺及其特性表征
2021-11-23余可楠廖婉雯钟瑞敏苗建银
黄 文,余可楠,廖婉雯,钟瑞敏,曹 庸,苗建银,*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642;2.韶关学院英东食品学院,广东韶关 512005)
我国是全球最大罗非鱼养殖加工国[1],约占同年全球总产量的13%,此中大部分罗非鱼被用于鱼片加工。罗非鱼加工过程中产生的副产物占所用鱼体总质量的54%,其中鱼头、鱼鳞占43%。然而我国目前对加工副产物合理利用率较低,不但造成了生物资源浪费,也为环境增加负担。因此,开发利用罗非鱼副产物具有丰富的原料基础和广阔的应用前景。
钙是人体的常量元素,占人体体重的1.5%~2%[2],在人体代谢活动中起着重要的作用,如提高细胞内的代谢水平、促进骨骼生长、维持心脏功能的稳定等[3]。研究表明钙摄入不足,会导致一系列疾病的发生,如骨质疏松症、佝偻病[4]、结肠癌[5]、高血压[6]等。我国成年居民钙摄入不足的比例超过95%[7],且由于植物源食材在人类饮食结构中占据很大比例,其所含草酸、植酸等成分在人体小肠弱碱性环境下易与钙元素形成不溶性钙盐,阻碍机体钙吸收,并可能引发结石等病变[8]。目前针对缺钙的治疗以药物治疗为主,如雌激素、雷洛昔芬、氟化物等[9−11],但大多数药物具有较强的副作用,如长期进行雌激素替代治疗可能会导致乳腺癌[12−14]、血栓形成的风险性増加,氟化物可导致腹痛、恶心、呕吐等胃肠道症状[15]。因此,针对缺钙可能诱发的疾病和健康风险,迫切需要研究开发能安全有效提升钙生物利用率的天然生物活性物质。
研究发现,蛋白酶解物具有良好的结合钙和促钙吸收活性。目前有研究在南极鳞虾[16]、鳕鱼皮[17],酪蛋白[18]、猪骨跟牛骨[19−20]等酶解物中获得钙结合肽,并有效提高钙的生物利用率。但以罗非鱼鳞获得钙结合活性肽并对其钙螯合特性进行系统表征的研究鲜见报道。本文利用响应面法对罗非鱼鳞的胶原蛋白的酶解工艺进行优化,从而得到钙结合肽。采用氨基酸分析仪、紫外吸收光谱和红外吸收光谱对罗非鱼鳞钙结合肽的特性进行了分析。为后续罗非鱼鳞钙结合肽的工业化生产及应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
罗非鱼鳞 广东茂名新洲海产有限公司;木瓜蛋白酶(酶活力为2×105U/g) 广西南宁庞博生物工程有限公司;无水氯化钙、8-羟基喹啉和乙醇胺 天津宏达化学试剂厂;邻甲酚酞络合剂 山东西亚化学工业有限公司;其余试剂 均为分析纯。
PHS-3CW pH 计 赛多利斯科学仪器(京)有限公司;DF-101S 数显恒温水浴锅 巩义予华仪器有限公司;L530 台式低速离心机 湖南湘仪实验室仪器开发有限公司;FD-1 型冷冻干燥机 海门市其林贝尔仪器制造有限公司;S-433D 氨基酸分析仪 日本日立公司;UV-240IPC 型紫外分光光度计 日本岛津公司;Vertex70 傅立叶变换红外光谱仪 布鲁克公司。
1.2 实验方法
1.2.1 罗非鱼鳞预处理 罗非鱼鳞脱脂脱钙处理[21],具体操作如下:罗非鱼鳞用自来水将杂质洗干净,放入0.1 mol/L NaOH 溶液(w/v 1:10)搅拌24 h,清洗至中性;放入10% EDTA-2Na(pH 7.2,w/v 1:10)中,并置于4 ℃冷库中,期间进行搅拌处理5 d,随后将鱼鳞清洗至中性后,用质量分数4%的盐酸处理18 h后水洗至中性,即得到脱钙罗非鱼鳞。将水洗至中性的鱼鳞中水分滴干,随后置于55 ℃烘箱中烘干,取出置于密封袋中备用。
1.2.2 罗非鱼鳞酶解工艺 罗非鱼鳞按底物浓度加入蒸馏水→加入木瓜蛋白酶→调节pH 和温度→恒温酶解→灭酶→冷却→离心→取上清
称取罗非鱼鳞于50 mL 离心管,按一定量的底物浓度加入蒸馏水,按一定的加酶量加入木瓜蛋白酶,调节一定的pH,设定一定的温度后在水浴锅中振荡酶解一定的时间。所得酶解物经90 ℃加热10 min灭酶,冷却至室温,随后4000 r/min 离心20 min,取上清液即得罗非鱼鳞酶解物。
1.2.3 罗非鱼鳞钙结合肽酶解工艺单因素实验 酶解的单因素实验采用改变其中一个因素,保持其他因素不变方式,探究底物浓度、酶底比、pH、温度和时间对罗非鱼鳞钙螯合活性的影响。单因素基础条件设为:底物浓度6%,酶底比0.3%,pH7,酶解温度55 ℃和酶解时间3 h。各个因素的水平梯度为,底物浓度:4%、6%、8%、10%;酶底比:0.1%、0.2%、0.3%、0.4%;pH:5.5、6、6.5、7、7.5;酶解温度:45、50、55、60、65 ℃;酶解时间:2、3、4、5 h。
1.2.4 响应面试验 以底物浓度及酶解时间和酶底比为自变量,设计三因素三水平响应面试验,试验设计如表1 所示。
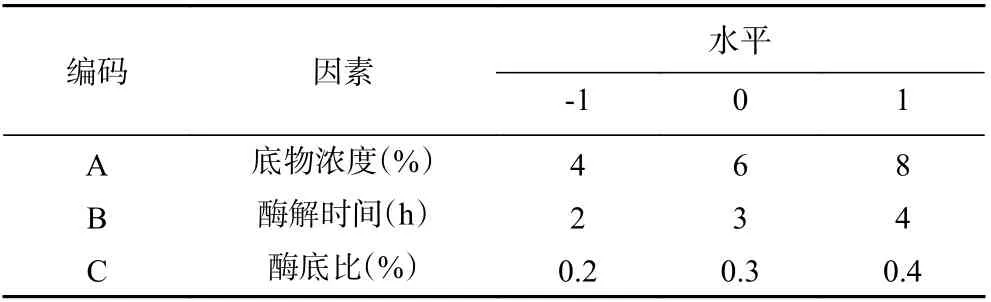
表1 响应面试验因素水平设计Table 1 Factor and level of response surface experiment
1.2.5 钙螯合活性测定 钙螯合活性的测定采用的是邻甲酚酞比色法[21−22]。
1.2.5.1 钙标准曲线的建立 分别取标准钙工作液(50 μg/mL)0、0.1、0.2、0.3、0.4、0.5、0.6 mL 于2 mL离心管中,分别加一级水1.0、0.9、0.8、0.7、0.6、0.5、0.4 mL 混匀,在96 孔板上每孔30 μL,再加工作显色液150 μL,摇匀,于570 nm 处内比色,作标准曲线。
1.2.5.2 酶解液钙螯合活性测定 取1 mL 的酶解上清液,1 mL 5 mmol/L CaCl2及2 mL 的磷酸盐缓冲液(pH7.8)于10 mL 的离心管中,在37 ℃水浴反应1 h,在4000 r/min 离心20 min。取上清液30 μL于96 孔板,在加入150 μL 的邻甲酚酞工作液反应后,在570 nm 测波长。钙螯合活性计算公式如下:
标准曲线公式:

钙螯合活性(μg/mL)则为:

1.2.6 罗非鱼鳞肽钙螯合物的制备 将冻干的最优条件下获得的酶解物,加入蒸馏水,配置成5 mg/mL的溶液,按肽钙比1:1 加入无水氯化钙,在pH8,42 ℃下螯合47 min,加入反应体系5 倍体积的无水乙醇后,4000 r/min 离心20 min,弃上清,取沉淀,冷冻干燥,获得罗非鱼鳞肽钙螯合物。
1.2.7 氨基酸含量测定 样品氨基酸含量测定参照GB5009.124-2016《食品安全国家标准 食品中氨基酸的测定》方法。
1.2.8 紫外吸收光谱测定 以蒸馏水为空白对照,将罗非鱼鳞钙结合肽和肽钙螯合物分别配制1.0 mg/mL的水溶液,在200~400 nm 下进行紫外扫描。
1.2.9 红外吸收光谱测定 分别称取2 mg 罗非鱼鳞钙结合肽、肽钙螯合物样品放入玛瑙研钵中,加入200 mg 干燥光谱纯KBr,混合研磨均匀,装入模具加压得透明样品压片,采用傅里叶变换红外光谱仪在400~4000 cm−1区间扫描。
1.3 数据处理
所有的实验进行3 次重复,结果表示为平均值±标准差(X±SD)。用最小二乘法比较三组实验均值在(P<0.05)水平上是否存在显著性差异。Origin 8.6 进行数据处理与作图。
2 结果与分析
2.1 罗非鱼鳞钙结合肽酶解制备
2.1.1 单因素实验
2.1.1.1 底物浓度对钙螯合活性的影响 如图1 所示,底物浓度在4%~6%,钙螯合活性逐渐上升,在6%~8%,钙螯合活性开始下降,在底物浓度为6%时,钙螯合活性最高,达到(28±0.5)μg/mL。这是因为随着底物浓度的增加,酶与底物的接触增加。当达到一定浓度时,会达到水解峰值[23]。当底物浓度继续增加时,会抑制分子的扩散和碰撞,从而降低了酶解的效率,钙螯合活性降低。因此,选取底物浓度为4%、6%和8%进一步响应面优化。

图1 底物浓度对钙螯合活性影响Fig.1 Effect of the concentration of substance on calcium chelation activity
2.1.1.2 酶底比对钙螯合活性的影响 如图2 所示,随着酶对底物的作用增加,罗非鱼鳞的钙螯合活性增加,当酶底比为0.3%时,钙螯合活性最大。酶底比在0.3%以下,鱼鳞蛋白的浓度一定时,酶解反应并未达到饱和状态,故钙螯合活性小。随着酶底比的增加,底物与酶饱和,酶水解效率不再与酶底比成正比,甚至呈下降趋势[24]。因此选取酶底比为0.2%、0.3%和0.4%进一步响应面优化。

图2 酶底比对钙螯合活性影响Fig.2 Effect of enzyme to substrate ratio on calcium chelation activity
2.1.1.3 pH 对钙螯合活性的影响 如图3 所示,当pH 在5.5~7.5 之间时,随着pH 的增加,钙螯合活性先缓慢增加后下降,pH 为7 时,钙螯合活性最大值为(28.63±0.3)μg/mL。当pH 在7~7.5 之间时,螯合钙活性降低。pH 可以通过影响酶的活性基团和空间结构影响酶解的效果[25]。当pH 高于或低于最佳pH 时,酶的活性中心构象发生变化,破坏其空间结构,从而抑制酶活性,钙螯合活性也因此下降[26]。

图3 pH 对钙螯合活性影响Fig.3 Effect of pH on calcium chelation activity
2.1.1.4 酶解温度对钙螯合活性的影响 如图4 所示,随着酶解温度的升高,钙螯合的活性急剧上升,在60 ℃达到最大值后,活性缓慢下降。这是因为适当的温度可以增加分子的热运动,加速分子间的运动与碰撞,从而促进酶解效果。当酶解温度低于最佳温度时,酶分子的活性降低,从而减少了酶与底物的接触。当酶解温度高于其最佳温度时,酶的结构破坏,导致酶失活,最终导致酶解效果减弱[27−28]。因此酶解温度为60 ℃。
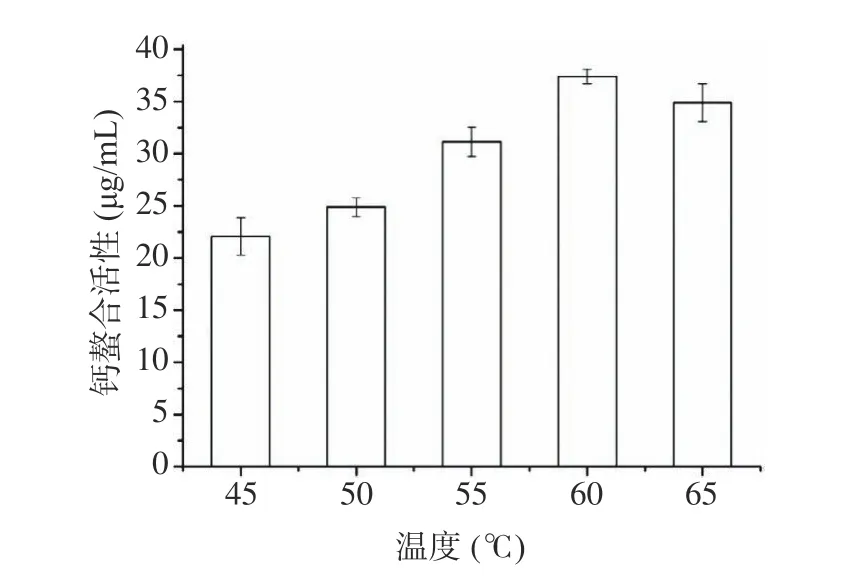
图4 酶解温度对钙螯合活性影响Fig.4 Effect of enzymatic hydrolysis temperature on calcium chelation activity
2.1.1.5 酶解时间对钙螯合活性的影响 如图5 所示,随着酶解时间的延长,钙螯合活性呈现先升高后降低的趋势。在初始阶段水解,底物浓度高,酶解效果增加,但随着酶解时间增加,水解的底物浓度低于初始体系,因此,反应速率降低,钙螯合活性也减少[29]。因此选取酶解时间为2、3 和4 h 进行进一步响应面优化。
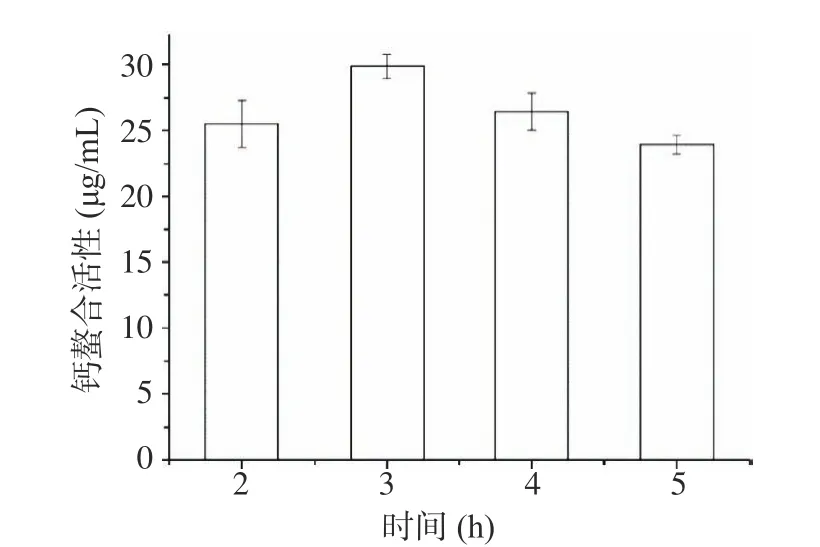
图5 酶解时间对钙螯合活性影响Fig.5 Effect of enzymatic hydrolysis time on calcium chelation activity
2.1.2 响应面优化结果及分析 以底物浓度以及酶解时间和酶底比为自变量,钙螯合活性为指标设计三因素三水平响应面试验,结果见表2。响应面分析图可以直观地表明2 个因素间相互作用对响应值的影响程度,底物浓度(A)、酶解时间(B)、酶底比(C)3 个因素之间耦合作用对螯合活性的影响,如图6所示。
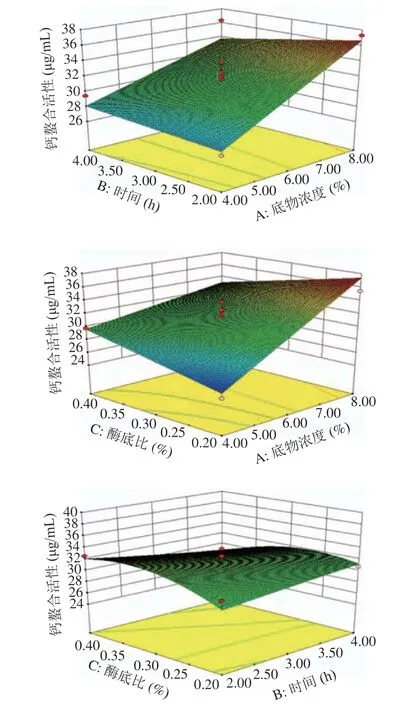
图6 底物浓度、时间、酶底比交互作用对钙螯合活性的影响Fig.6 Effects of concentration of substance, time and enzyme to substrate ratio interaction on calcium chelation activity
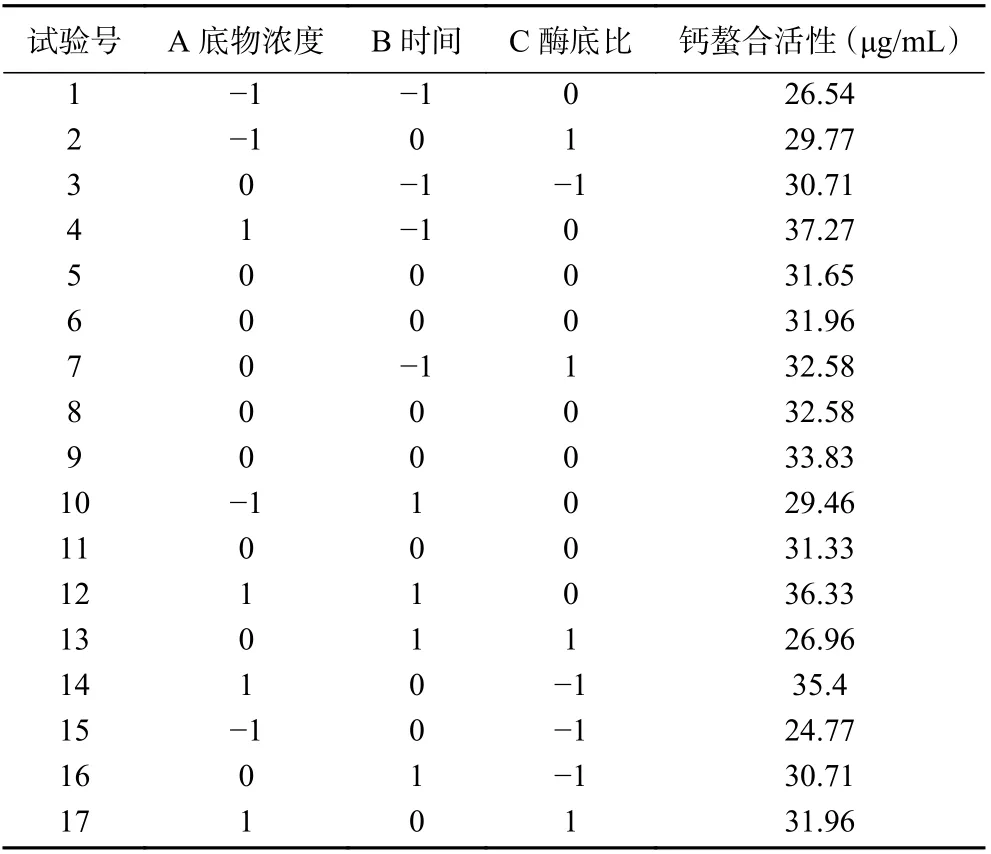
表2 响应面优化试验设计及结果Table 2 Response surface experiment design and results
由回归方程模型的方差分析及显著性分析结果(表3)可知,模型P值为0.0055(P<0.01),失拟项0.1086(P>0.05)不显著,这表明模型显著,试验误差小,实验结果与模型拟合度好。此外,R2的计算值为0.91,表明实验结果与模型预测结果一致性良好,证明该模型结果可靠,可用此模型预测和优化实验结果。此外,方差分析还显示,A、AC、C2对钙螯合活性有显著影响(P<0.05)。

表3 回归模型显著性检验及方差分析Table 3 Significant test and variance analysis for the regression model
以钙螯合活性(Y)为响应值的回归方程为:

响应面得到的最优的酶解条件为底物浓度8%,时间2 h,酶底比0.3%,pH7,温度60 ℃;钙螯合活性预测37.62 μg/mL。验证结果钙螯合活性为(38.31±0.4) μg/mL,与预测值相接近。
2.2 氨基酸分析
最优条件下酶解物(罗非鱼鳞钙结合肽)及其肽钙螯合物的氨基酸含量如表4 所示。与酶解物相比,在肽钙螯合物中,甘氨酸、天冬氨酸、谷氨酸、半胱氨酸、赖氨酸、组氨酸和丝氨酸的相对含量均出现不同程度的增加,其中增幅较大的是天冬氨酸、谷氨酸、赖氨酸和组氨酸,分别增加0.88%、1.48%、0.53%、0.46%,这说明这些氨基酸存在与钙离子结合的作用位点。研究表明,甘氨酸的α-氨基氮原子可与钙结合[30],天冬氨酸和谷氨酸的游离羧基,可以与钙结合形成肽钙螯合物[31],赖氨酸的ε氨基氮与钙有较强的结合能力[32],而组氨酸的N 末端含咪唑环、丝氨酸的羟基以及半胱氨酸的巯基与钙都有较强的结合能力[33−34]。
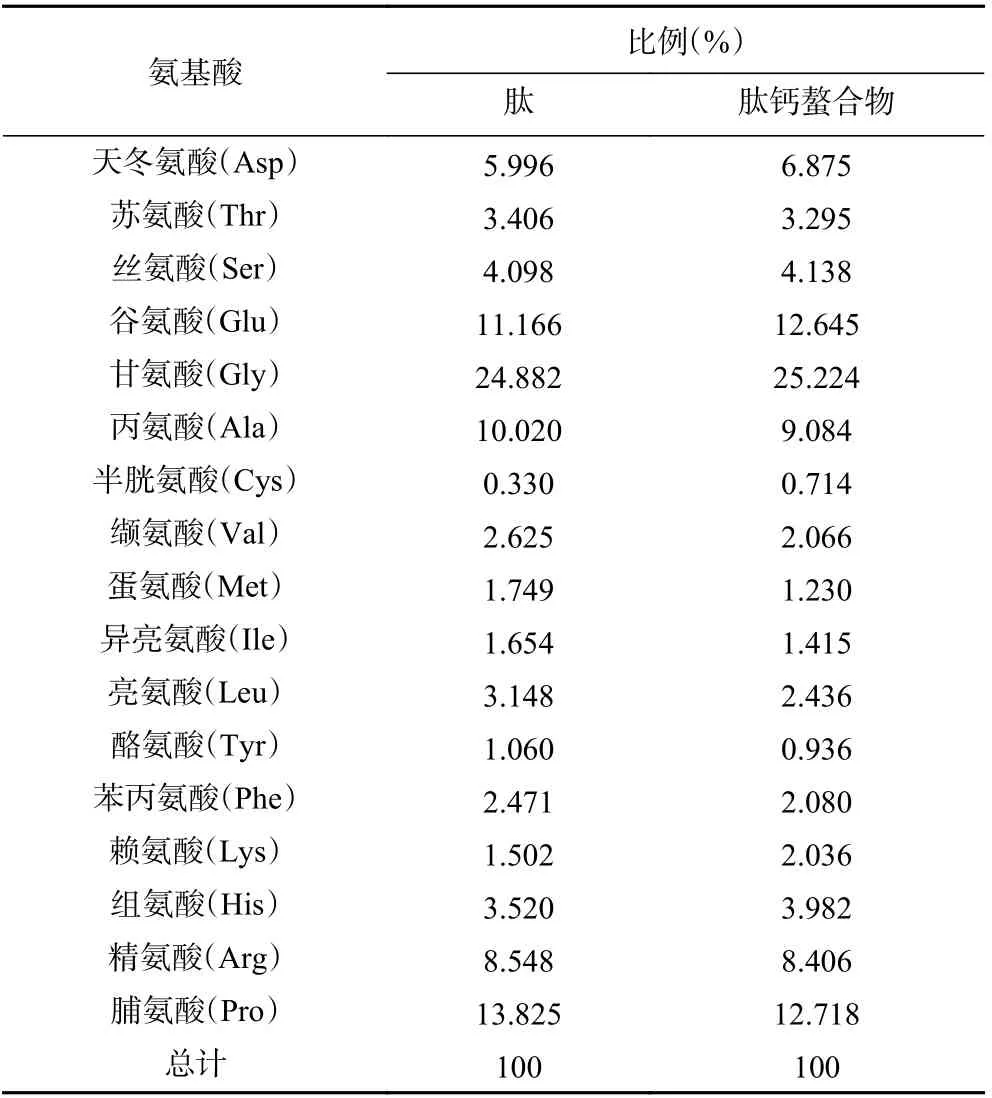
表4 氨基酸分析Table 4 Amino acid analysis
2.3 紫外吸收光谱分析
在紫外分光光度计中,金属离子与有机配体形成复合物会导致新的吸收峰的出现或原始吸收峰的转移或消失[35]。从图7 可以看出,罗非鱼鳞钙结合肽在220 nm、280 nm 附近处有高的吸收峰,这分别是肽键羰基和芳香族氨基酸残基的特征吸收峰[34]。结合钙后,肽钙螯合物的吸收强度都增加。这是因为肽中的显色基团(C=O 和-COOH)和助色基团(-NH2和-NH)空间结构改变,引起紫外光谱强度变化[6]。现象说明罗非鱼钙结合肽与钙结合产生新的物质,并且可以推测-NH-和-NH2的氮原子和-C=O 和-COOH的氧原子参与了螯合作用。
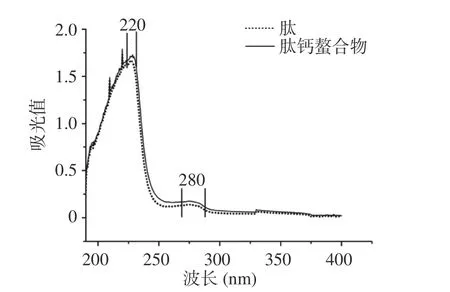
图7 紫外吸收光谱图Fig.7 Ultraviolet absorption spectrogram
2.4 红外吸收光谱分析
钙离子螯合前后的红外吸收峰的特征变化是反映金属离子与有机配体基团相互作用的有效证据[36−37]。如图8 所示,钙结合肽在3326.12 cm−1有一个强的吸收峰,螯合钙离子之后,波数则变为3332.84 cm−1,这是因为诱导效应或偶极场效应和肽中N-H 的电子云密度增强所致[38],这也说明N-H 与钙离子有一定的结合作用。钙结合肽在1657.10 cm−1处的吸收带主要是酰胺I(1700~1600 cm−1)的振动。酰胺I 区的二级结构:β-转角,1660~1700 cm−1;α螺旋,1645~1659 cm−1;不规则结构,1640~1644 cm−1;和β折叠,1620~1640 cm−1[39]。结合钙后,波数(1657.10 cm−1)移至较低频率(1648.65 cm−1),表明C=O 基团参与了与钙的共价键合反应,且肽钙螯合物形成α螺旋结构。钙结合肽中-COO 的波数(1400.65 cm−1)向更高的频率(1412.09 cm−1)移动,这可能是由于羰基氧的自由电子对螯合钙离子,表明-COOH 可能与钙结合[40]。在500~1000 cm−1范围内,与钙结合后,几个吸收峰发生了变化,这是由N-Ca 键取代C-H 键和N-H 键振动引起的[41]。总的来说,罗非鱼鳞钙结合肽中的羧基氧和氨基氮等基团参与了与钙离子结合,形成了罗非鱼鳞肽钙螯合物。
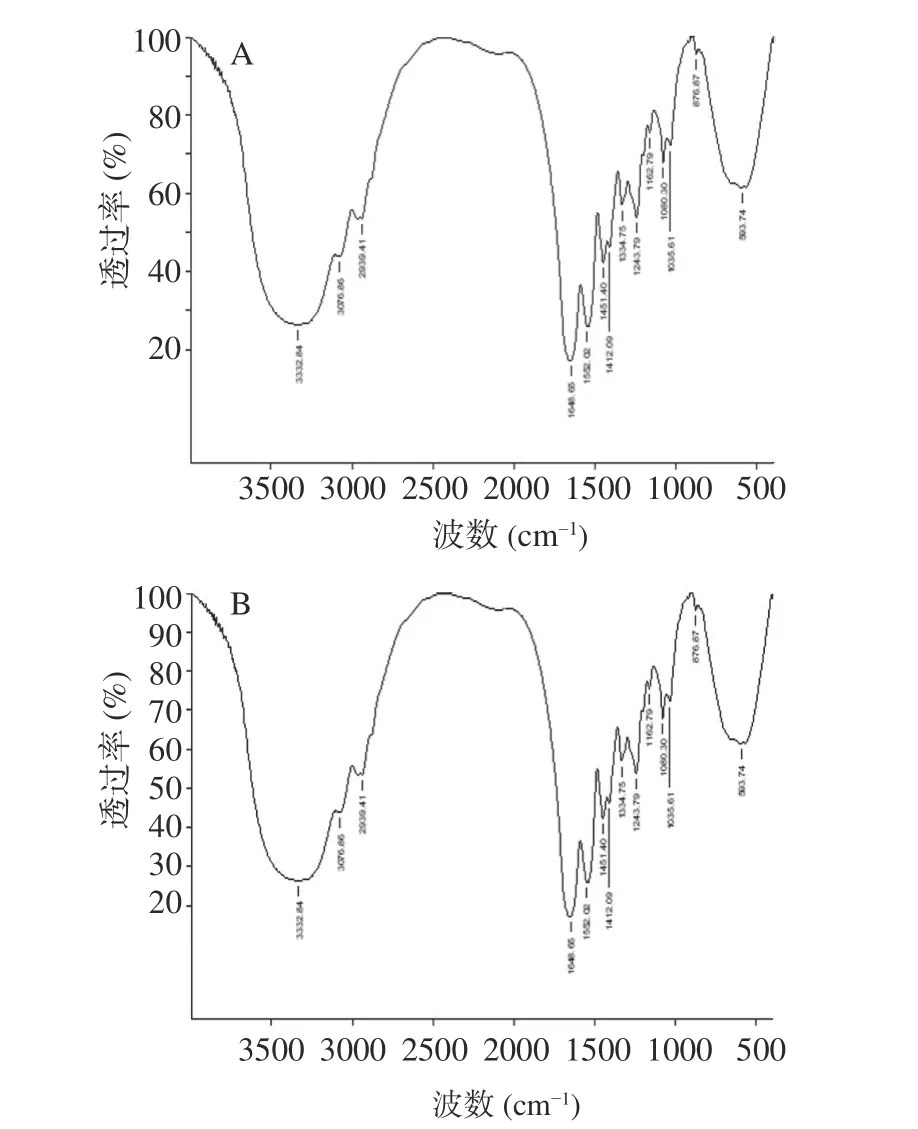
图8 肽(A)及肽钙螯合物(B)的红外光谱扫描图谱Fig.8 Infrared spectra of peptides(A)and peptide-calcium chelate(B)
3 结论
本研究通过单因素和响应面优化试验,获得罗非鱼鳞钙结合肽的最优酶解工艺条件(底物浓度8%、时间2 h、酶底比0.3%、pH7、温度60 ℃),钙螯合活性为(38.31±0.4)μg/mL。最优酶解条件下制得的罗非鱼鳞钙结合肽及其肽钙螯合物的表征结果表明,肽钙螯合物中的天冬氨酸、谷氨酸、甘氨酸、赖氨酸、丝氨酸、半胱氨酸及组氨酸含量增加,说明这些氨基酸在与钙离子结合的过程起到关键作用;且钙结合肽中的羧基氧和氨基氮等基团参与了与钙离子结合,形成肽钙螯合物。本研究制备的罗非鱼鳞钙结合肽对于替代传统的补钙剂具有一定的市场优势和前景。
